Навигация
Сродство к электрону и характер его изменения
3.4.3. Сродство к электрону и характер его изменения.
Способность атома присоединять электроны может быть количественно оценена энергией, которую обозначают понятием «сродство к электрону».
Сродством к электрону называют количество энергии E, которое выделяется в результате присоединения электрона к нейтральному атому и превращением его в отрицательно заряженный ион.
А+е=А–+Е
Сродство к электрону выражается в тех же единицах, что и энергия ионизации (кДж/моль или ЭВ/атом). Однако экспериментально его определить труднее, чем энергию ионизации. Поэтому надежные значения Е получены лишь для небольшого числа элементов. По имеющимся данным можно сделать однозначный вывод о закономерности изменения сродства к электрону по периодам и группам.
Характер изменения сродства к электрону рассмотрим на примере элементов второго периода и главной подгруппы седьмой группы показан на рис.3.5.

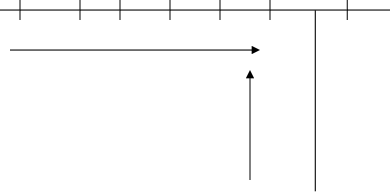 Li Be B C N O F Ne ЭВ/атом
Li Be B C N O F Ne ЭВ/атом
0,57 -0,6 0,2 1,25 -0,1 1,47 3,6 -0,57
3,8 – Cl
Увеличение сродства к
электрону 3,5 – Br
3,3 – I
– At рис.3.5.
Из приведенного рисунка следует, что в периоде от начала к концу сродство к электрону увеличивается, а в группах увеличение идет в направлении снизу вверх. Можно сделать такой вывод: чем меньше радиус атома, тем легче к нему присоединяется электрон, тем больше высвобождается энергии и, следовательно, больше сродство к электрону. Однако монотонности в изменении сродства к электрону нет, как и не было ее в изменении энергии ионизации.
Для элементов VII A группы, обладающих в своих периодах наименьшими радиусами, величина сродства к электрону наибольшая. Наименьшее значение сродства к электрону и даже отрицательное значение имеет место у элементов с электронными структурами s2(Be, Mg, Ca), s2p6(Ne, Ar, Kr) и с наполовину заполненным p-подуровнем, т.е. структурой s2p3 (N, P, As). Это служит дополнительным доказательством повышенной устойчивости указанных конфигураций.
Изменение сродства к электрону в ряду d-элементов покажем на примере d-элементов 4-го периода.
| Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | |
| Е ЭВ/атом | –0,40 | 0,15 | 0,65 | 0,85 | –1,20 | 0,1 | 0,70 | 1,10 | 1,40 | –0,9 |
| электронная конфигурация | s2d1 | s2d2 | s2d3 | s1d5 | s2d5 | s2d6 | s2d7 | s2d8 | s1d10 | s2d10 |
Здесь тоже устойчивые конфигурации s2d5, s2d10 имеют отрицательное значение сродства к электрону. Принцип изменения сродства к электрону в ряде d-элементов такой же как у ряда s- и p-элементов.
Еще раз обратимся к характеру изменения Е в группах. Из данных, приведенных для галогенов, видно, что величина сродства к электрону у фтора (3,6) меньше, чем у хлора (3,8). Такую аномалию можно объяснить отталкиванием электрона в плотно заполненном 2р-подуровне. Такие аномалии встречаются у элементов других групп.
3.4.5. Изменение электроотрицательности.
Для того, чтобы решить вопрос: атом данного элемента легче теряет или присоединяет электрон – необходимо учесть энергию ионизации I и сродство к электрону Е. Сумму энергии ионизации и сродства к электрону называют электроотрицательностью (ЭО). Например, для нахождения электроотрицательности атома фтора (ЭОF) необходимо суммировать его энергию ионизации (IF) и сродство к электрону (ЕF).
ЭОF= IF + ЕF =1736,36+339,74=2076,2 кДж/моль
Электроотрицательность измеряется в тех же единицах, что и энергия ионизации: кДж/моль или ЭВ/атом.
Однако для удобства применения вместо абсолютных значений электроотрицательности (кДж/моль или ЭВ/атом) используют значения относительной электроотрицательности (ОЭО или . За единицу относительной электроотрицательности принята электроотрицательность атома лития.
ОЭО=ЭОLi=ILi+ELi=
Cоответственно определены величины ОЭО всех элементов. Их значения приведены в таблице 3.4.
Характер изменения относительной электроотрицательности элементов рассмотрен на примере элементов второго периода и главной подгруппы первой группы. (рис.2.6)
Можно сделать следующий вывод: чем меньше радиус атома, тем больше значение электроотрицательности.
Электроотрицательностью называют свойство атома притягивать к себе электроны.
Наименьшим значением электроотрицательности обладают s-элементы, поэтому щелочные металлы легко отдают электроны. Их можно назвать наиболее электроположительными элементами. В противоположность щелочным металлам, галогены имеют большую электроотрицательность, поэтому они легко притягивают к себе электроны и с большим трудом отдают их.

Li Be B C N O F
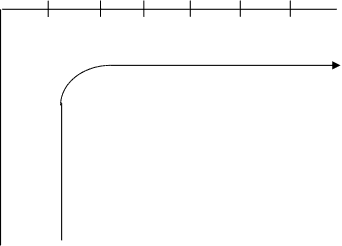
1 1,5 2,0 2,5 3,0 3,5 4,0
Na – 0,97
K – 0,91 Увеличение
Rb – 0,89
Cs –0,86
Fr – 0,7 рис. 3.6.
Наименьшим значением обладает Fr(0,7) а наибольшим значением обладает F(4,0). Понятие электроотрицательности служит также мерой относительной способности атомов в молекуле притягивать к себе электроны или оттягивать на себя электронную плотность.
По возрастающей величине относительной электроотрицательности неметаллы можно расположить в следующий ряд:
| Si | At | В | Te | P | H | As | I | S | Sc | C | Br | Cl | N | O | F |
| 1,74 | 1,9 | 2,01 | 2,01 | 2,06 | 2,1 | 2,2 | 2,21 | 2,44 | 2,48 | 2,5 | 2,74 | 2,83 | 3,07 | 3,5 | 4,0 |
Как видно из приведенного каждый элемент в этом ряду обладает большей электроотрицательностью, чем элемент находящийся левее его.
Похожие работы
... , как в общенаучном плане, так и прикладном плане. Это дает нам возможность проанализировать содержание данной темы в курсе химии средней школы. Глава 2. МЕТОДИКА ИЗУЧЕНИЯ КРИСТАЛЛОГИДРАТОВ В КУРСЕ ХИМИИ СРЕДНЕЙ ШКОЛЫ 2.1 Тема «Кристаллогидраты» в стандарте школьного образования Стандарт среднего (полного) общего образования по химии определяет собой обязательных минимум, который должен ...
... г. для химической лаборатории построено отдельное здание. При чтении лекций в это время профессора придерживаются большей частью руководств Теннара, Пайена, Розе, Пфаффа и Берцелиуса. Следовательно, новое направление химии в России было усвоено весьма скоро. К этому же времени относится и появление, кроме переводных, также и первых оригинальных руководств по химии на русском языке. В 1810 - 1813 ...
... поскольку ускорение химических реакций заметно влияет на снижение издержек производства. 9. Атомно-молекулярное учение Ведущей идеей атомно-молекулярного учения, составляющего фундамент современной физики, химии и естествознания, является идея дискретности (прерывности строения) вещества. Вещество не заполняет целиком занимаемое им пространство, оно состоит из отдельных, находящихся на очень ...
... и т.д. Человек начал применять лекарственные вещества очень давно, несколько тысяч лет назад. Древняя медицина практически полностью основывалась на лекарственных растениях, и этот подход сохранил свою привлекательность до наших дней. Множество современных лекарственных препаратов содержат вещества растительного происхождения или химически синтезированные соединения, идентичные тем, которые можно ...
0 комментариев