Навигация
Волновая функция и волновое уравнение
2.1.3. Волновая функция и волновое уравнение.
Так как электронам присущи волновые свойства и они обладают неопределенностью положения в пространстве, их движение характеризуется при помощи волновой функции и описывается волновым уравнением. Физический смысл волновой функции заключается в том, что ее квадрат 2 пропорционален вероятности нахождении электрона в элементарном объеме атома V с координатами x, y, z.
Значение волновой функции находят при решении волнового уравнения Шредингера:
2/x2 + 2/y2 +2/z2 +82m/h2*(E–U)=0
В этом сложном дифференциальном уравнении с частными производными: Е–полная энергия частицы, U – потенциальная энергия, –волновая функция.
В олновая
функция, получаемая
при решении
уравнения
Шредингера,
может иметь
ряд значений.
Эти значения
зависят от
квантовых
параметров
n, l, me,
названных
квантовыми
числами
олновая
функция, получаемая
при решении
уравнения
Шредингера,
может иметь
ряд значений.
Эти значения
зависят от
квантовых
параметров
n, l, me,
названных
квантовыми
числами
![]() n
n
![]()
![]() l
l
me
В итоге – значения квантовых чисел есть не что иное как результат решения уравнения Шредингера. Следовательно, при решении уравнения Шредингера получены значения волновой функции и возможные /допустимые/ значения квантовых чисел.
2.1.4. Квантовые числа. Атомные орбитали.
Так как электрон имеет четыре степени свободы, то для характеристики его поведения в атоме требуется четыре квантовых числа.
Главное квантовое число n определяет удаленность атомной орбитали от ядра и характеризует общий запас энергии электрона на данном энергетическом уровне. n принимает целочисленные значения от единицы до бесконечности. В зависимости от цифровых значений главного квантового числа приняты буквенные обозначения квантовых уровней n=1, 2, 3, 4,…
обозначение К, L, M, N,…
Чем больше n, тем слабее электрон связан с ядром и более емким становится квантовый уровень. Числовые значения n определяют также и количество подуровней, содержащееся на данном квантовом уровне /т.е. числовые значения n определяют емкость квантового уровня/. Так, если n=3, то это значит, что имеем третий квантовый уровень, который состоит из трех подуровней.
Орбитальное квантовое число l характеризует момент количества движения электрона относительно центра орбитали. Наличие такого движения приводит к делению квантового уровня на подуровни. Орбитальное квантовое число характеризует так же пространственную форму электронного облака. Это квантовое число предопределяется главным квантовым числом n и принимает ряд целочисленных значений от нуля до n–1. В зависимости от числовых значений l приняты буквенные обозначения подуровней:
n=1, 2, 3, 4,…
l=0, 1, 2, 3,…,–1
обозначение подуровня: s, p, d, f,…
ф![]()
![]()
![]()
![]()
![]() орма
орбитали
орма
орбитали
Магнитное квантовое число ml характеризует магнитный момент электрона. Определяет ориентацию квантового подуровня в пространстве. Число проекций подуровня на направление магнитных силовых линий квантуется и оно равно количеству орбиталей на данном подуровне. Можно сказать, что магнитное квантовое число определяет количество орбиталей на подуровне. ml принимает значения от –l через ноль до +l.
ml = –l,…,+1, 0, –1,…, +l.
Рассмотрим подуровень s. Для него: l=0, ml=0
![]()
![]()
![]() H рис.2.1.
H рис.2.1.
У подуровня
шарообразной
формы может
быть только
одна проекция.
(рис.2.1.), имеющая
значение «ноль».
Следовательно,
на s -подуровне
только одна
s-орбиталь.
подуровня
шарообразной
формы может
быть только
одна проекция.
(рис.2.1.), имеющая
значение «ноль».
Следовательно,
на s -подуровне
только одна
s-орбиталь.
П![]() одуровень
Р имеет l=1,
а ml
= –1, 0, +1
одуровень
Р имеет l=1,
а ml
= –1, 0, +1
l=1
В![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() данном случае согласно правил
квантования
уже три проекции.
данном случае согласно правил
квантования
уже три проекции.
С![]()
![]() ледовательно
на р-подуровне
три р-орбитали. рис2.2.
ледовательно
на р-подуровне
три р-орбитали. рис2.2.
Для d-подуровня: l=2, ml = –2, –1, 0, +1, +2. Это значит, что согласно квантовой теории d-подуровень состоит из пяти d-орбиталей.
Подуровень f имеет l=3, ml = –3, –2, –1, 0, +1, +2, +3. Следовательно f-подуровень состоит из семи f-орбиталей.
Число орбиталей на подуровне можно определить из выражения ml =2l+1:
значение l: 0, 1, 2, 3, …….
подуровень: s, p, d, f, …….
число орбиталей: 1, 3, 5, 7, …….
Спиновое квантовое число ms характеризует собственный момент количества движения, возникающий как бы из-за «вращения» электрона вокруг собственной оси. Принимает два значения: +1/2 и –1/2, что соответствует двум возможным направлениям вращения электрона.
ms= +1/2; –1/2.
Оно получено из опытов Штерна и Герлаха.
Рассмотренные квантовые числа определяют энергию электрона, объем и форму пространства, в котором вероятно его пребывание в околоядерном объеме, т.е. размер, форму и ориентацию орбитали в пространстве.
Так как волновая функция является решением уравнения Шредингера при всевозможных значениях квантовых чисел, то можно сказать, что волновая функция является в свою очередь функцией рассмотренных квантовых параметров n, l и ml, где:
n= 1, 2, 3, 4,…,
l= 0, 1, 2, 3,…,n–1
ml=–l,…, –1, 0, +1,…, +l
Атомные орбитали. Так как вероятность нахождения электрона в пространстве далеком от ядра очень мала, когда говорят об орбиталях, то имеют в виду такую область вокруг ядра атома внутри которой сосредоточено 90–95% электронного заряда. С точки зрения квантовой механики атомные орбитали являются геометрическим изображением волновой функции (n, l, ml).
Z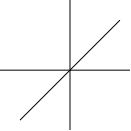
 Электронное
облако. Если
бы в каждый
момент времени
Электронное
облако. Если
бы в каждый
момент времени
![]()
![]() y определяли
положение
электрона в
трехмерном
пространстве
и
y определяли
положение
электрона в
трехмерном
пространстве
и
![]()
![]()
![]() ставили в
том месте точку,
то через множество
таких определений
ставили в
том месте точку,
то через множество
таких определений
![]() X получили
бы картину в
виде пространственного
облака изображен-
X получили
бы картину в
виде пространственного
облака изображен-
![]() ного точками
с размытыми
краями /рис.2.3.)
ного точками
с размытыми
краями /рис.2.3.)
рис.2.3.
Т акое
зарядовое
облако называют
электронным
облаком. Его
плотность,
пропорциональная
2, является
непосредственной
мерой вероятности
нахождения
электрона.
Граничная
поверхность
облака, внутри
которой содержится
90–95% электронного
заряда, дает
форму орбитали.
акое
зарядовое
облако называют
электронным
облаком. Его
плотность,
пропорциональная
2, является
непосредственной
мерой вероятности
нахождения
электрона.
Граничная
поверхность
облака, внутри
которой содержится
90–95% электронного
заряда, дает
форму орбитали.
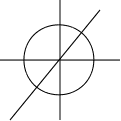 Z s-орбиталь.
Она существует
при l=0. Значение
ml
тоже равно
Z s-орбиталь.
Она существует
при l=0. Значение
ml
тоже равно
Y нулю. Имеем только одно значение ml =0. Следовательно,
s-орбиталь имеет максимальную симметричность. У нее
X сферическая форма (рис.2.4.). В этом случае вероятность на–
хождения электрона в околоядерном пространстве определя–
рис.2.4. ется только радиусом-вектором и не зависит от угла координат.
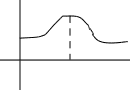 Радиальное
распределение
электронной
плотности для
1s
Радиальное
распределение
электронной
плотности для
1s
электрона соответствует кривой с максимумом (рис.2.5.).
Максимум распространения вероятности находится на
0 r1 r,A0 расстоянии от ядра r1, которые соответствует радиусу
рис.2.5. первой боровской орбиты.
р-орбиталь. Существует при l=1. ml = –1, 0, +1.
![]() Z р-орбиталь
появляется
на втором и
всех последующих
Z р-орбиталь
появляется
на втором и
всех последующих
 Рz
уровнях. Так
как ml
имеет три значения,
то на р-подуров-
Рz
уровнях. Так
как ml
имеет три значения,
то на р-подуров-
Y не каждого уровне может быть три р-орбитали. р-орбиталь
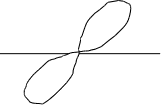 имеет гонтелеобразную
форму. Все три
р-орбитали
распо-
имеет гонтелеобразную
форму. Все три
р-орбитали
распо-
X лагаются в пространстве по направлению координатных
Px осей. Их называют соответственно рх, рy, рz-орбитали
Py (рис.2.6.).
Р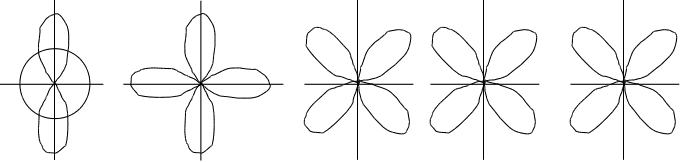 ис.2.6.
Z Y Y Z Z
ис.2.6.
Z Y Y Z Z
X X X X Y
dz2 dx2 y2 dxy dxz dyz
рис.2.7.
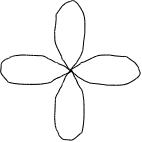
d-орбиталь. Появляется при l=2 на третьем квантовом уровне. На d-подуровне может быть уже пять различных состояний электронов, поэтому на d-подуровне каждого квантового уровня содержится пять d-орбиталей. В этом случае ml принимает пять значений: ml = –2, –1, 0, +1, +2, d-орбитали имеют более сложную форму, чем р-орбитали, они либо в виде четырех лепестков либо в виде гантели с ободком (рис.2.7.).
f-орбиталь. Появляется при значении l=3. f-орбитали могут быть только на четвертом и более отдаленных уровнях. Так как при l=3 ml имеет 7 значений /–3, –2, –1, 0, +1, +2, +3/, то на f-подуровне может быть семь орбиталей. Форма f-орбиталей еще более сложная, чем у d-орбиталей. f-орбитали изображают в виде сложных шестилепестковых фигур.
Форма орбиталей и ее направленность играют существенную роль при образовании химических связей, т.к. эти два фактора определяют характер и степень перекрывания электронных облаков соединяющихся атомов.
Похожие работы
... , как в общенаучном плане, так и прикладном плане. Это дает нам возможность проанализировать содержание данной темы в курсе химии средней школы. Глава 2. МЕТОДИКА ИЗУЧЕНИЯ КРИСТАЛЛОГИДРАТОВ В КУРСЕ ХИМИИ СРЕДНЕЙ ШКОЛЫ 2.1 Тема «Кристаллогидраты» в стандарте школьного образования Стандарт среднего (полного) общего образования по химии определяет собой обязательных минимум, который должен ...
... г. для химической лаборатории построено отдельное здание. При чтении лекций в это время профессора придерживаются большей частью руководств Теннара, Пайена, Розе, Пфаффа и Берцелиуса. Следовательно, новое направление химии в России было усвоено весьма скоро. К этому же времени относится и появление, кроме переводных, также и первых оригинальных руководств по химии на русском языке. В 1810 - 1813 ...
... поскольку ускорение химических реакций заметно влияет на снижение издержек производства. 9. Атомно-молекулярное учение Ведущей идеей атомно-молекулярного учения, составляющего фундамент современной физики, химии и естествознания, является идея дискретности (прерывности строения) вещества. Вещество не заполняет целиком занимаемое им пространство, оно состоит из отдельных, находящихся на очень ...
... и т.д. Человек начал применять лекарственные вещества очень давно, несколько тысяч лет назад. Древняя медицина практически полностью основывалась на лекарственных растениях, и этот подход сохранил свою привлекательность до наших дней. Множество современных лекарственных препаратов содержат вещества растительного происхождения или химически синтезированные соединения, идентичные тем, которые можно ...
0 комментариев