Навигация
Альтернативные методы обеззараживания воды
1.3. Альтернативные методы обеззараживания воды
К настоящему времени разработаны и внедряются в промышленных масштабах
следующие альтернативные методам на основе хлора методы обеззараживания воды:
озонирование, ультрафиолетовое облучение и другие методы.
Антисептик под названием "анавидин" разработан специалистами Иркутского института химии СО РАН. С его помощью можно осуществлять обеззараживание питьевой и бытовой воды. При этом, в отличие от жидкого хлора, которым сейчас осуществляется обеззараживание, антисептик не обладает вредным воздействием на организм человека.
Анавидин обладает широким спектром антибактериального действия, причем уничтожает ряд бактерий и вирусов, устойчивых к хлору. Кроме того, анавидин не имеет токсичного действия, хорошо растворяется в воде, не придает ей дополнительных вкусов и запахов. В процессе приготовления не требует специальных сооружений и дополнительных мер безопасности. Для обеззараживания воды требует 1 мг препарата на 1 л воды, полная очистка воды происходит через 60 минут.
Применение анавидина для очистки питьевой воды разрешено Департаментом Государственного санитарно-эпидемиологического надзора РФ. Препарат может использоваться как в промышленности, так и в системе очистки городских сточных вод.
Также применяются другие дезинфицирующие вещества: Аламинол, Акватабс 8, Деконекс 50, Гипохлорид кальция, Дехлор, Жавелион 1500, ЖавельСолид 1500, Клорсепт-17, Клорсепт-25, Ника экстрам, Пюржавель 1500, Хлорамин и т.д.
1.3.1. Электрохимические методы
Наиболее часто при этом прибегают к использованию электрохимических методов.
Электрохимические методы обеззараживания природных и сточных вод находят всё более широкое применение в технологии водоподготовки как у нас в стране, так и за рубежом.
В настоящее время наиболее перспективным методом является метод обеззараживания воды с использованием электролитического гипохлорита натрия, получаемого на месте потребления путем электролиза растворов хлоридов. Сохраняя все достоинства метода хлорирования с применением жидкого хлора, метод обеззараживания электролитическим позволяет избежать основных трудностей таких как транспортирование и хранение токсичного газа.
Гипохлорит натрия применяется для обработки бытовых и промышленных вод, для разрушения животных и растительных микроорганизмов, устранения запахов (особенно образующихся из серосодержащих веществ), обезвреживания промышленных стоков, например, от цианистых соединений.
Он может быть использован для обработки воды, содержащей аммоний. Процесс осуществляют при температуре выше 700С в щелочной среде с добавлением СаСl2 или CaCO3 для разложения соединений аммиака.
Для очистки от фенолов ( содержание 0,42 – 14, 94 мг/л) используют 9% раствор гипохлорита натрия в количестве 0,2-8,6 мг/л. Степень очистки достигает 99,99%. При обработке гипохлоритом воды, содержащей фенолы, происходит образование фенолоксифенолов.
В ходе обработки вод, содержащих гумусовые кислоты, последние превращаются в хлороформ, дихлоруксусную кислоту, трихлоруксусную кислоту, хлоральдегиды и некоторые другие вещества, концентрация которых в воде значительно ниже. Известны данные об использовании натрия для удаления ртути из сточных вод.
2. Процесс обеззараживания воды на основе гипохлорита натрия

гипохлорита натрия
При электролизе на электродах при пропускании электрического тока через растворы или расплавы электролитов протекают окислительно-восстановительные реакции.Электрохимический способ получения гипохлорита натрия (NaClO) основан на получении хлора путем электролиза водного раствора хлорида натрия (NaCl) и его взаимодействии со щелочью в одном и том же аппарате – электролизере.
В данном случае, когда в качестве электролита используется раствор поваренной соли, сущность процесса заключается в следующем:
На аноде идет разряд ионов хлора (процесс окисления):
2Cl- =Cl2 + 2e-
Выделяющийся хлор растворяется в электролите (NaCl) с образованием хлорноватистой и соляной кислот:
Cl2 + H2O = HClO +HCl
На катоде происходит разряд молекул воды (процесс восстановления):
H2O + e- = OH- + H+
Атомы водорода после рекомбинации выделяются из раствора в виде газа, оставшиеся же в растворе ионы OH- образуют возле катода с ионами Na+ щелочь.
Вследствие перемешивания анолита с католитом происходит взаимодействие хлорноватистой кислоты со щелочью с образованием гипохлорита натрия:
HClO + NaOH = NaClO + H2O
Если все количество щелочи, образующееся на катоде, будет поступать к аноду, то процесс электролиза протекает только с образованием раствора гипохлорита натрия.
Получающийся гипохлорит натрия в значительной степени диссоциирует с образованием ионов ClO- , которые способны к дальнейшему анодному окислению с образованием хлорат-иона СlO3-:
6СlO-+6OH- -6e-=6H2O +4Cl- +2ClO3- + 1,5O2
Концентрация ионов СlO- существенно влияет на дальнейший ход электролиза. Ионы ClO- разряжаются при значительно меньших потенциалах анода, чем ионы Сl-, поэтому уже при незначительных концентрациях гипохлорита натрия на аноде начинается совместный разряд ионов Сl- и СlO-.
Образование хлората может протекать и химическим путем по реакции:
2HClО+ClO- = ClO3-+2Cl- + 2H+
Получаемый раствор гипохлорита натрия достаточно стоек и может длительное время храниться без значительного разложения при соблюдении следующих факторов, влияющих на его стойкость:
1. низкая температура ( не более 200С)
2. исключение воздействия света
3. отсутствие ионов тяжелых металлов
4. значение водородного показателя рН не менее 10
Разряд ионов Сl- приводит к образованию гипохлорита натрия с постепенно увеличивающейся концентрацией, а разряд ионов СlO- уменьшает его концентрацию. При достаточной длительности электролиза скорости этих двух процессов становятся одинаковыми (v1=v2) и дальнейший рост концентрации образующегося гипохлорита натрия прекратится.
Поэтому задачей получения гипохлорита натрия является осуществление процесса электролиза в таких условиях, при которых равновесная концентрация гипохлорита натрия наступала бы как можно позднее. Очевидно, что этим условиям будут благоприятствовать все факторы, облегчающие разряд ионов Сl- и затрудняющие разряд ионов CIО-.
2.2.Факторы, влияющие на электролиз хлорида натрия
Наиболее существенное значение для ведения электролиза на оптимальном уровне имеют следующие факторы:
1. концентрация растворов хлоридов
2. температурный режим
3. анодная плотность тока
4. характер движения жидкости
5. способ разложения электродов
1. Чем выше концентрация хлоридов, тем меньше перенапряжение выделения хлора и тем больше сдвигается его равновесный потенциал в электроотрицательную сторону. Следовательно, увеличение концентрации NaCI облегчает выделение хлора. Однако чем выше концентрация раствора NaCI, тем больше расход поваренной соли на 1 кг гипохлорита натрия, поэтому в практических условиях концентрацию раствора хлористого натрия выбирают в зависимости от требуемой концентрации гипохлорита натрия. Чем меньше раствор должен содержать гипохлорита, тем меньше может быть исходная концентрация NaCI .
2. Процесс окисления гипохлорита с последующим образованием хлоратов замедляется при понижении температуры раствора, поэтому электролиз целесообразно вести при низких температурах в интервале 20—25°С.
3. Выход гипохлорита по току увеличивается с возрастанием анодной плотности тока, так как в этих условиях затрудняется доступ ионов СlO- каноду. При очень малых плотностях тока, отвечающих интервалу потенциалов +0,8—1,33 В, на аноде будет выделяться кислород, затем при достижении равновесного потенциала выделения хлора начнется совместное выделение кислорода и хлора, причем с ростом плотности тока выход хлора по току будет быстро возрастать. При плотностях тока около 1000 А/м2 на выделение кислорода будет расходоваться всего несколько процентов тока.
4. Весьма существенное значение имеет характер движения электролита. Если прианодный слой электролита не нарушается, то в нем находится преимущественно слабо диссоциированная хлорноватистая кислота, а образование гипохлорита натрия происходит на некотором расстоянии от анода. В этом случае ионы СlO- могут поступать к аноду из глубины раствора только благодаря диффузии и электропереносу, поэтому при отсутствии перемешивания прианодного слоя в растворе может накапливаться гипохлорит натрия более высокой концентрации, чем это соответствует началу разряда ионов СlO-, Из сказанного следует, что необходимо избегать механического перемешивания раствора.
5.Для проведения процесса электролитического получения гипохлорита натрия с минимальными энергетическими затратами большое значение имеет выбор материала анода. Аноды работают в условиях непосредственного соприкосновения с химически активными веществами, поэтому основным требованием к материалу анода является их химическая устойчивость. От стойкости электродных материалов и их удельного износа зависят продолжительность эксплуатации, затраты на ремонт и обслуживание электролизеров. Материал анода должен способствовать разряду ионов Сl-,т. е. перенапряжение хлора на нем должно быть наименьшим.
2.3.Характеристика катодов и анодов установки электролиза
хлорида натрия
С конца 60-х годов началось широкое внедрение в хлорную промышленность и постепенная замена графитовых электродов на титановые аноды из диоксидов рутения и титана. За рубежом они нашли применение под названием DSA (dimensionally stable anodes). В отечественной практике они применяются под названием ОРТА (оксидные рутениево-титановые аноды). ОРТА являются официально зарегистрированным товарным знаком.
Малоизнашиваемые аноды типа ОРТА обладают рядом неоспоримых преимуществ по сравнению с графитовыми электродами:
Они обладают более высокими селективными и электрокаталитическими свойствами (перенапряжение выделения хлора на ОРТА значительно ниже) по отношению к основному процессу – выделению хлора на аноде. Это позволяет при всех прочих равных условиях ведения электролиза осуществлять процесс при более низком значении напряжения на ванне и интенсифицировать его, используя более высокие анодные плотности тока (вплоть до 10 кА/м2 на ртутных электролизерах, что недостижимо на графите). Тем самым увеличивается выход конечного продукта с единицы поверхности анода, что обеспечивает возможность выполнять конструкции электролизеров меньших габаритов при аналогичной производительности.
Коррозионная стойкость ОРТА значительно выше, чем у графитов анодов – время непрерывной эксплуатации металлоксидных анодов (без существенной потери своих электрофизических характеристик) в диафрагменных хлорных электролизерах составляет ~ 5-6 лет, в электролизерах с ртутным катодом ~ 1,5 и более лет, в хлоратных и гипохлоритных электролизерах ~ 1 год. Графитовые аноды в хлорных электролизерах имеют срок пробега не более 6 месяцев; в хлоратных и гипохлоритных электролизерах не более 3-4 месяцев. При этом ОРТА, имея достаточно хорошие технико-эксплуатационные характеристики, позволяют проводить процесс электролитического получения ГПХН при минерализации хлорида в питающем растворе до 20-25 г/л. Это обстоятельство дает возможность проводить электролиз до более глубокой степени конверсии поваренной соли и снижает ее удельный расход в пересчете на конечный продукт.
Аноды типа ОРТА и их модификации (термин «dimensionally stable anodes» дословно означает «размерно стабильные аноды» или, что более принято на практике – «аноды неменяющихся размеров») в процессе длительной эксплуатации не меняют своей формы и в первую очередь межэлектродного расстояния по отношению к противоэлектроду (катоду), что несвойственно графиту. Титановую подложку анодов по мере срабатывания активного покрытия можно подвергать многократной регенерации и повторному нанесению активного покрытия, что в условиях и относительной дороговизны титана является немаловажным положительным фактором.
К недостаткам ОРТА можно отнести их сравнительно высокую стоимость. Для сохранения их коррозионной стойкости следует предусматривать меры, предотвращающие повышение анодного потенциала. ОРТА нельзя рекомендовать для использования в установках с периодическим изменением полярности электродов, поскольку в результате восстановления окислов образуется металлический рутений, который не стоек в условиях анодной поляризации. Однако, несмотря на указанные недостатки окисно-рутениевых анодов, из всех новых разработанных МИА они нашли наиболее широкое применение на практике.
Что касается катодного материала, то в промышленности используются, в основном, сталь, графит и титан. Важными их свойствами являются стойкость при анодной поляризации, низкий потенциал выделения хлора и высокая электропроводность.
Процесс электролиза растворов хлоридов сопровождается образованием на катодах отложений солей жесткости. Первоначально появляются тонкая пленка и отдельные кристаллы, количество которых со временем увеличивается, и вся поверхность катода постепенно покрывается осадком. Толщина осадка непрерывно возрастает, в связи с чем межэлектродное пространство забивается отложениями, снижается сила тока через электролизер и уменьшается производительность установки.
Рядом исследователей было установлено, что скорость образования осадков и структура солевой пленки зависят от плотности тока, времени поляризации, химического состава раствора, состояния поверхности электродов.
С увеличением плотности тока и времени поляризации обрастание катода происходит интенсивнее. Скорость налипания отложений снижается при применении электродов с более гладкой поверхностью. Наилучшие результаты достигаются при использовании полированных катодов.
Из перечисленных факторов наибольшее влияние на образование отложений на катодах оказывает химический состав воды и главным образом общая жесткость. С увеличением жесткости скорость образования катодных отложений возрастает. Механизм образования отложений, по-видимому, следующий. В прикатодном пространстве первичным продуктом является щелочь, получающаяся в результате разложения воды. При наличии в растворе ионов Са 2+и Mg2+ происходит образование соответствующих гидроокисей, а в присутствии ионов СО3- карбонатов.
Существует несколько технических приемов, применение которых предотвращает рост осадков на катодах:
- создание высокой линейной скорости движения жидкости относительно электродов; механическая очистка поверхности катодов;
- растворение отложений кислотой;
- «скалывание» осадков с катодов методом временной перемены полярности электродов.
При создании высокой линейной скорости движения жидкости относительно электродов отложения отрываются от поверхности катода и выносятся потоком. Скорость движения жидкости должна составлять не менее 1,5—2 м/с. Техническое осуществление данного способа возможно при применении специального насосного оборудования или электролизеров специальной конструкции, благодаря чему в межэлектродном пространстве создаются требуемые линейные скорости.
Электролит насосом под давлением снизу вверх вводится в электролизер и по магистрали поступает в сепаратор. Сепаратор оборудован устройством для удаления водорода, конусообразным дном для сбора отложений, штуцером для подвода электролита и штуцером с клапаном для отвода готового продукта.
Электролит непрерывно с заданной скоростью циркулирует по замкнутому объему до достижения требуемой концентрации по активному хлору. Катодные отложения выносятся из электролизера, собираются в конусной части сепаратора, откуда периодически удаляются. Новая порция электролита добавляется в количестве, равном отведенному готовому продукту.
Впускная камера обеспечивает равномерное распределение электролита по сечению электролизера. В электролизной части аппарата вертикально поочередно расположены анодные и катодные пластины.
В разделительной секции смонтированы устройства, сужающиеся в верхней части. Ширина зазора в этих устройствах меньше, чем расстояние между
электродами.
Ячейка снабжена патрубком для подвода электролита, крышкой с гидравлическим затвором и отверстием для удаления водорода, штуцером для отвода получаемого гипохлорита натрия и патрубком с пробкой для периодического удаления отложений солей жесткости.
Электролит движется снизу вверх со скоростью, затрудняющей образование катодных отложений. Продукты электролиза взаимодействуют не в электролитической ячейке, а в разделительной камере.
В случае применения механической очистки снятие отложений осуществляется вручную или с помощью специальных механизмов. При ручной очистке требуются полная разборка установки и выполнение обслуживающим персоналом трудоемких работ.
Типичная конструкция электролизера состоит из ряда биполярно включенных дисков, закрепленных поочередно на валу, покрытом изоляционным материалом. Электролизер закрывается крышкой и стягивается болтами. Для снятия отложений солей жесткости в электролизер введены скребковые механизмы. Удаление отложений с поверхности электродов осуществляется при повороте вала.
Технически более простой операцией является растворение отложений кислотой, в связи с чем этот метод нашел довольно широкое применение в практике. Сущность метода заключается в том, что периодически по мере обрастания катодов солями жесткости через установку пропускают 3— 5%-ный раствор соляной или азотной кислоты, который и растворяет отложения. Кислота на промывку подается с помощью так называемого замкнутого кислотного контура, состоящего из насоса небольшой подачи, бачка с кислотой, соединительных магистралей и запорной арматуры. Все оборудование выполняется из антикоррозионного материала. При проведении кислотной промывки закрывают задвижки и прекращают поступление электролита в электролизер. Открывают спускной вентиль, воздухоотделитель и сливают рассол из установки. Включают насос и в установку подают раствор кислоты, который сливается в сборный бачок по возвратной магистрали. Промывку осуществляют до полного растворения отложений, после чего электролизер снова включают в работу.
Периодичность промывки и ее длительность зависят от интенсивности обрастания катодов.
Одним из наиболее предпочтительных методов снятия отложений является способ «скалывания» осадков, который осуществляется путем проведения временной перемены полярности электродов. В этом случае исключается необходимость применения ручного труда и реагентов и, кроме того, возможна автоматизация процесса. Однако этот метод применим только для ограниченного числа материалов, способных попеременно работать как в качестве анода, так и катода. К числу таких электродов относятся, например платиновые, магнетитовые, из платинированного титана.
2.5.Виды электролитических ванн установки электролиза
хлорида натрия
В практике электрохимического производства хлорпродуктов нашли применение разнообразные конструкции электролитических ванн. На основании общих признаков они могут быть разделены на две группы: монополярные и биполярные. Схема включения электродов в электрическую цепь для ванн каждой из этих групп является общей.
Монополярные ванны имеют ряд параллельно расположенных электродов, одна половина которых соединена с положительной шиной цепи - аноды, другая - с отрицательной шиной - катоды. При таком соединении каждый электрод имеет только одну полярность, т. е. является или анодом, или катодом. Сила тока на ванне пропорциональна плотности тока и поверхности всех электродов одной какой-либо полярности, напряжение на ванне определяется разностью потенциалов на одной паре электродов (катоде и аноде), поэтому для работы монополярных ванн требуется большая токовая нагрузка при низком напряжении.
Биполярные ванны, так же как и монополярные, имеют ряд расположенных параллельно друг другу электродов, но включенных в электрическую цепь последовательно. Ток подводят только к крайним электродам — аноду и катоду. Промежуточные электроды включены в электрическую цепь через проводники второго рода — электролит.
При наложении напряжения на крайние токоподводящие элементы промежуточные электроды поляризуются. На одной их стороне, обращенной к аноду, концентрируются отрицательные заряды, на другой — положительные.Таким образом, крайние электроды и являются монополярными, а все промежуточные — биполярными электродами, т. е. одной стороной они работают как катоды, а другой — как аноды.
Сила тока на биполярной ванне зависит только от плотности тока и площади поверхности одного монополярного электрода (анода или катода) и не зависит от числа биполярных электродов. Напряжение на ванне, наоборот, зависит от разности потенциалов между соседними электродами и прямо пропорционально числу пар анодов и катодов. Современные электролизеры в основном относятся к биполярному типу.
Количество продукта Gт, кг, которое теоретически должно выделиться на аноде при электролизе, может быть определено, согласно закону Фарадея, по формуле:
GT = AInt/ 1000
А – электрохимический эквивалент, г/(Ач)
I – полный ток через электролизер
n- число работающих анодов
t – продолжительность работы электролизера
2.7.Побочные процессы и основные показатели электролизахлорида натрия
Важно отметить, что на электродах параллельно с основными процессами образования целевых продуктов происходят другие побочные электродные процессы. В связи с этим количество выделившегося продукта всегда меньше теоретического. К таким процессам относятся: ■ реакция образования по химическому механизму хлората, протекающая в объеме: 2HClO + ClO- = ClO3- +2Cl- + 2H+■ реакция электрохимическое окисление гипохлорита до хлората:
6ClO- - 6 e- = ClO3- + 1,5O2 + 5Cl-
■ химическая реакция разложения гипохлорита, которая особенно активируется в присутствии загрязнений электролита, особенно железа, меди, никеля:
2СlO- = O2 + 2Cl-
восстановление гипохлорита и хлората на катоде:
ClO- + H2O + 2e- = Cl- + 2OH-
ClO3- + 3H2O + 6e- = Cl- + 6OH-
По количеству реально полученного продукта можно подсчитать, какая часть тока израсходована полезно. Эта часть тока, выраженная в долях единицы, называется коэффициентом использования тока, а выраженная в процентах— выходом по току.
Если теоретически рассчитанное количество продукта электролиза обозначить GT, а практически полученное количество G, то коэффициент использования тока ŋ = G/GT, а выход по току равен G/GT 100% .
Значение ŋ является основным показателем процесса электролиза. Чем выше его значение, тем эффективнее течение электролиза и ниже энергетические затраты на получение единицы готового продукта. При более высоких значениях ŋ можно уменьшить требуемую площадь рабочей поверхности электродов для достижения заданной производительности, применить более компактные установки и снизить расходы на их изготовление.
На изменение коэффициента использования тока ŋ влияет ряд факторов:
- величина напряжения на разрядный промежуток
- исходная концентрация электролита
- степень использования раствора хлоридов
Величина выхода хлора по току сказывается в первую очередь на изменении затрат электроэнергии W, кВт-ч/кг, при получении гипохлорита натрия, которые могут быть подсчитаны по формуле:
W = I *U* t/G
или
W = U/ A*ŋ*n
где U—напряжение на токоподводящих электродах, В.
Можно указать один из возможных способов регулирования производительности электролизера. Повышая напряжение на токоподводящих электродах, а следовательно, повышая и силу тока, можно увеличить в определенных пределах производительность установки без существенного отклонения энергетических затрат от минимальных при сохранении максимально возможного значения выхода хлора по току.
Межэлектродное расстояние δ существенно не влияет на изменение величины ŋ и другие параметры работы электролизера. Изменение величины δ при сохранении площади рабочей поверхности электродов сказывается только на производительности установки. При увеличении межэлектродного расстояния происходит пропорциональное снижение плотности тока i и соответственно снижение общего выхода гипохлорита натрия. С точностью, приемлемой для инженерных расчетов, зависимость между δ и i может быть выражена соотношением:
δ2/δ1 = i1/i2
Для создания малогабаритных и высокопроизводительных установок наиболее целесообразно предусматривать минимально возможные межэлектродные расстояния, равные 3—6 мм, что позволяет вести процесс электролиза при больших плотностях тока.
Технико-экономические показатели работы электролизера определяются не только затратами электроэнергии, но и достигаемой степенью использования исходного раствора. Особенно большое значение это имеет в случае применения в качестве электролита растворов поваренной соли, поскольку затраты на соль являются одной из главных статей расхода при производстве гипохлорита натрия. Под степенью использования соли (процентом разложения) λ, %, понимают отношение концентрации активного хлора в растворе гипохлорита натрия, полученного в результате электролиза, к концент-рации NaCI, вводимой в установку:
λ = (ССl акт /CNaCl)*100
ССl акт – концентрация активного хлора в гипохлорите натрия
CNaCl– концентрация NaCl в электролите, г/л.
Затраты на соль зависят от достигаемой степени полезного использования исходного продукта. По мере увеличения концентрации активного хлора и растворе расход соли на получение единицы готового продукта снижается. Так, при электролизе раствора с концентрацией 100 г/л NaCI и достижении содержания активного хлора на выходе из электролизера 5 г/л расход соли составляет 20 г на 1 г готового продукта (5% - разложение). При содержании же хлора в растворе 10 г/л затраты на соль уменьшаются и составляют всего 10 r/л (10%-ное разложение). Таким образом, для снижения расходов на соль предпочтительно ведение процесса электролиза при глубоком разложении NaCl. Однако увеличение степени использования поваренной соли приводит к росту энергетических затрат, поэтому должен быть какой-то оптимальный режим эксплуатации установки, при котором суммарные затраты на соль и электроэнергию будут минимальны.
В случае использования природных электролитов основной статьей расхода являются затраты электроэнергии на подачу рассола, его транспортирование к объекту применения и производство гипохлорита натрия. Оптимальная степень использования растворов определяется в каждом конкретном случае в зависимости от исходной минерализации и требуемой концентрации активного хлора. В энергетическом отношении наиболее предпочтительно получение гипохлоритов небольшой концентрации.
Расчет электролизной установки в общих чертах сводится к следующему. Для заданной по активному хлору производительности электролизера по закону Фарадея с учетом коэффициента использования тока, значение которого зависит от типа применяемых электродных материалов, концентрации хлоридов в электролите, вида рассола и требуемой степени использования раствора, определяют необходимую токовую нагрузку:
I*n =G / Aŋt
В соответствии с выходными параметрами стандартных выпрямительных агрегатов, серийно выпускаемых электротехнической промышленностью и предполагаемых для комплектования с данным электролизером, выбирают допустимую величину полного тока и напряжения. Соответствие номиналов выпрямительных агрегатов и параметров режима работы электролизера достигается правильным выбором числа разрядных промежутков.
Площадь рабочей поверхности электродов S определяется из соотношения
S = I/I ((???чего то не хватает))
Похожие работы
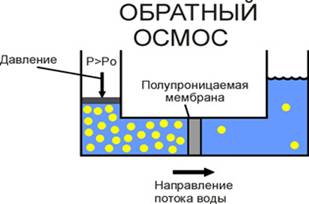
... для этого реагентный метод или мембранные методы обессоливания (обратный осмос, электродиализ). По технологическим процессам и, соответственно, применяемому оборудованию, методам очистки сточных вод гальванического производства можно дать следующую классификацию: · механические / физические (отстаивание, фильтрация, выпаривание); · химические (реагентная обработка); · коагуляционно ...
... с 8,3 до 0,03 мг/л, что ниже ПДК, степень очистки 99,6 % поэтому возможно использовать реагентную очистку в этом случае. Глава 4. Экономическая часть В данной работе проводилась очистка сточной воды машиностроительного предприятия , в процессе которой было использовано оборудование, химическая посуда, химические реактивы. В данной главе просчитаны общие затраты за год на очистку сточных вод ...
... (обработка минеральными солями и кислотами, коагулянтами и флокулянтами); физико-химические (электрокоагуляция, ультрафильтрация). Метод деэмульгирования масляных эмульсий путем коагуляции дисперсной фазы неорганическими электролитами получил широкое распространение в практике очистки сточных вод. По литературным данным, для очистки маслоэмульсионных сточных вод могут быть использованы NaCl, ...
... процесса, а также возможность получения шлама более низкой влажности (90-95%), высокая степень очистки (95-98%), возможность рекуперации удаляемых веществ. 3.2.3 Сорбция Среди физико-химических методов очистки сточных вод от нефтепродуктов лучший эффект дает сорбция на углях. Сорбция – это процесс поглощения вещества из окружающей среды твердым телом или жидкостью. Поглощающее тело называется ...




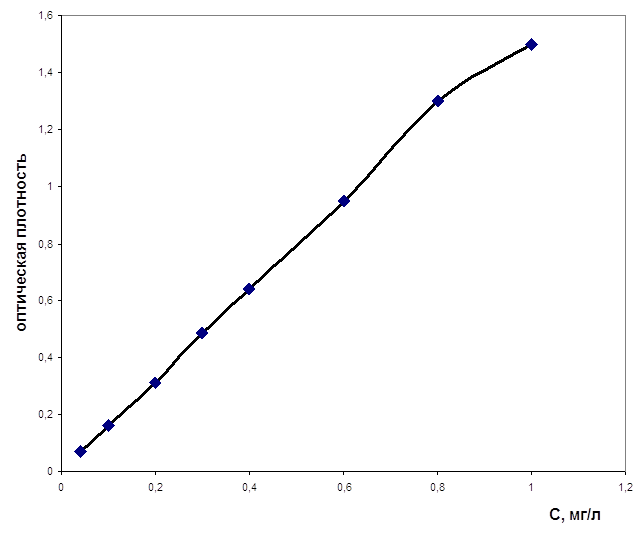
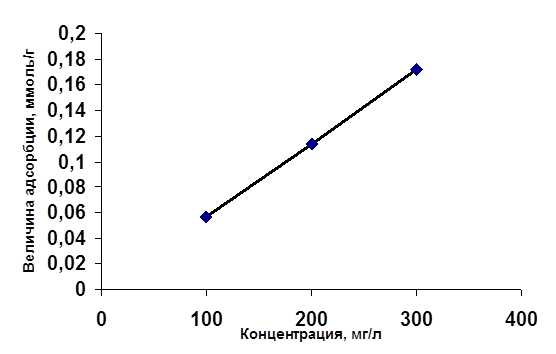
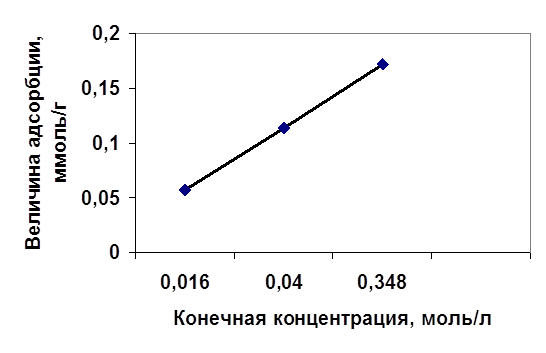

0 комментариев