| Электролит | Формула | Степень диссоциации % |
| Кислоты Соляная Бромоводородная Йодоводородная Азотная Серная Сернистая Фосфорная Фтороводородная Уксусная Угольная Сероводородная Синильная Борная | HCL HBr HI HNO3 H2SO4 H2SO3 H3PO4 HF CH3COOH H2CO3 H2S HCN H3BO3 | 92 92 92 92 58 34 27 8,5 1,3 0,17 0,07 0,01 0,01 |
| Основания Гидроксид бария Гидроксид калия Гидроксид натрия Гидроксид яммония | Ва(OH)2 KOH NaOH NH2OH | 92 89 84 1,3 |
| Соли Хлорид кальция Хлорид аммония Хлорид натрия Нитрат калия Нитрат серебра Хлорид цинка Сульфат натрия Сульфат Цинка Сульфат меди | KCL NH4CL NaCL KNO3 AgNO3 ZnCL2 NA2SO4 ZnSO4 CuSO4 | 86 85 84 83 81 73 69 40 40 |
Похожие работы
... важно для выяснения механизмов электролиза, электрокатализа, электрокристаллизации, коррозии металлов и др., для совершенствования механизмов разделения веществ - экстракции и ионного обмена. Исследование свойств электролитов стимулируется энергетическими проблемами (создание новых топливных элементов, солнечных батарей, электрохимических преобразователей информации), а также проблемами защиты ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
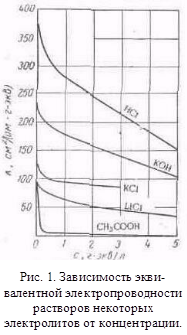
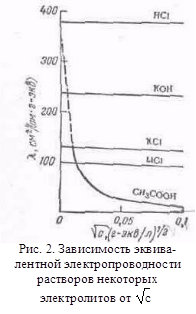
... с другими растворителями рассмотренные закономерности сохраняются, но имеются и отступления от них, например на кривых λ-с часто наблюдается минимум (аномальная электропроводность). 2. Подвижность ионов Свяжем электропроводность электролита со скоростью движения его ионов в электрическом поле. Для вычисления электропроводности достаточно подсчитать число ионов, ...
... электролита в растворе и принимает максимальное значение a = 1 в бесконечно разбавленном растворе. так как процесс диссоциации является эндотермическим, то степень диссоциации слабого электролита в водных растворах будет увеличиваться с повышением температуры. Константой электролитической диссоциации К называется постоянная химического равновесия в растворе электролита: , где [К+], [A-] и [KA] - ...





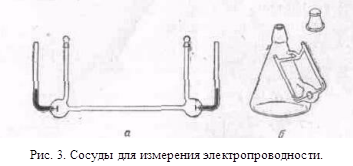
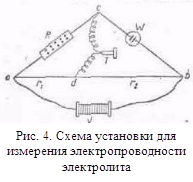
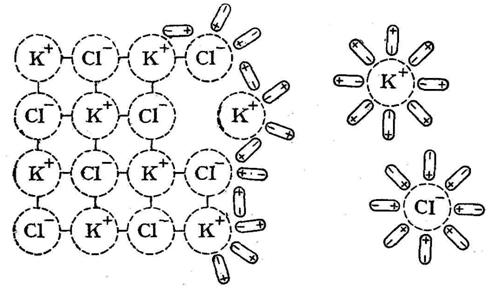
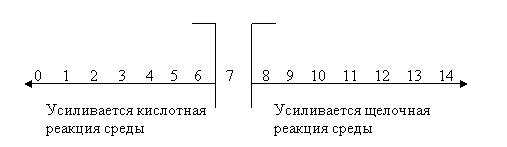
0 комментариев