Навигация
Вирус синдрома приобретенного иммунного дефицита.
1. Введение
Еще каких-нибудь два десятка лет назад человечество пребывало в уверенности, что инфекционные болезни не больше не представляют опасности для цивилизованного мира. Однако с появлением в начале 80-х годов синдрома приобретенного иммунного дефицита (СПИДа) эта уверенность существенно поколебалась. СПИД не является редким заболеванием, от которого могут случайно могут пострадать немногие люди. Ведущие специалисты определяют в настоящее время СПИД как “глобальный кризис здоровья”, как первую действительно всеземную и беспрецедентную эпидемию инфекционного заболевания, которое до сих пор по прошествии первой декады эпидемии не контролируется медициной и от него умирает каждый заразившейся человек.
СПИД к 1991 году был зарегистрирован во всех странах мира, кроме Албании. В самой развитой стране мира - Соединенных Штатах уже в то время один их каждых 100-200 человек инфицирован, каждые 13 секунд заражается еще один житель США и к концу 1991 года СПИД в этой стране вышел на треть место по смертности, обогнав раковые заболевания. Пока что СПИД вынуждает признать себя болезнью со смертельным исходом в 100% случаев.
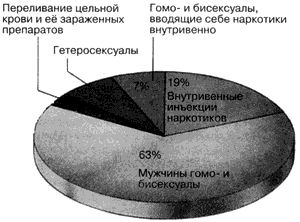
Первые заболевшие СПИДом люди выявлены в 1981 году. В течении прошедшей первой декады распространение вирус-возбудителя шло преимущественно среди определенных групп населения, которые называли группами риска. Это наркоманы, проститутки, гомосексуалисты, больные врожденной гемофилии (так как жизнь последних зависит от систематического введения препаратов из донорской крови).
Однако к концу первой декады эпидемии в ВОЗ накопился материал, свидетельствующий о том, что СПИД вышел за пределы названных групп риска. Он вышел в основную популяцию населения.
С 1992 года началась вторая декада пандемии. Ожидают, что она будет существенно тяжелее, чем первая. В Африке, например, в ближайшие 7-10 лет 25% сельскохозяйственных ферм останутся без рабочей силы по причине вымирания от одного только СПИДа.
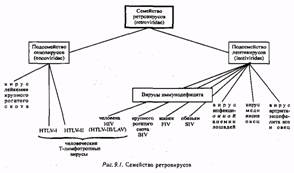
СПИД - разрушительная болезнь, вызываемая инфекционным агентом, относящимся к группе ретровирусов. Пугающе загадочная эпидемия только начиналась, но наука мгновенно отозвалась на нее. За два года, с 1982 по 1984 г., была выяснена общая картина болезни. Выделен возбудитель - вирус иммудефицита человека (HIV - от англ. Human Immunodeficiency Virus), разработан метод анализа крови, выявляющий наличие инфекции, установлены специфические мишени вируса в организме.
Хотя уже ясна общая картина синдрома приобретенного иммунодефицита и связанных с ним заболеваний, а также выявлен и исследован вирус иммунодефицита человека, его происхождение остается загадкой. Есть убедительные серологические данные в пользу того, что на западном и восточном побережьях Соединенных Штатов инфекция появилась в середине 70-х годов. При этом случаи ассоциированных со СПИДом заболеваний, известных в центральной Африке, указывают на то, что там инфекция, возможно появилась еще раньше (50-70 лет). Как бы то ни было, пока не удается удовлетворительно объяснить, откуда взялась эта инфекция. С помощью современных методов культивирования клеток было обнаружено несколько ретровирусов человека и обезьян. Как и другие РНК-содержащие вирусы, они потенциально изменчивы; поэтому у них вполне у них вполне вероятны такие перемены в спектре хозяев и вирулентности, которые могли бы объяснить появление нового патогена. Существует несколько гипотез:
1) воздействие на ранее существующий вирус неблагоприятных факторов экологических факторов;
2) бактериологическое оружие;
3) мутация вируса в следствии радиационного воздействия урановых залежей на предполагаемой родине инфекционного патогена - Замбии и Заире.
После первого всплеска исследования, хотя и несколько медленнее, но устойчиво продвигались вперед. Тем не менее в некоторых отношениях вирус перегонял науку. До сих пор по сути нет средств лечения или предупреждения СПИДа, а эпидемия тем временем продолжает распространяться. На многие вопросы, связанные с этой болезнью, ответа пока нет, но так же некоторые вопросы поддались успешному разрешению.
2. Строение и жизненный цикл вируса СПИДа
Инфекция вирусом иммунодефицита человека, вызывающим СПИД, многолика. Вначале этот вирус обычно интенсивно размножается, и свободные вирионы (вирусные частицы) появляются в жидкости. Заполняющей полости головного и спинного мозга, а так же в кровотоке. Первая волна репликации HIV может сопровождаться жаром, сыпью, явлениями, подобным симптомам гриппа, и иногда неврологическими расстройствами. Затем на несколько недель количество вируса, циркулирующего в крови и цереброспинальной жидкости, значительно уменьшается. Тем не менее вирус по-прежнему присутствует в организме. Его можно обнаружить не только в Т-4 лимфоцитах, которые в начале считались его единственной мишенью, но и в других клетках иммунной системы, в клетках нервной системы и кишечника, а так же, по всей вероятности, в некоторых клетках спинного мозга.
Здесь имеет смысл дать краткое описание той системы организма, которую он выводит из строя, то есть системы иммунитета. Она обеспечивает в нашем теле постоянство состава белков и осуществляет борьбу с инфекцией и злокачественно перерождающимися клетками организма.
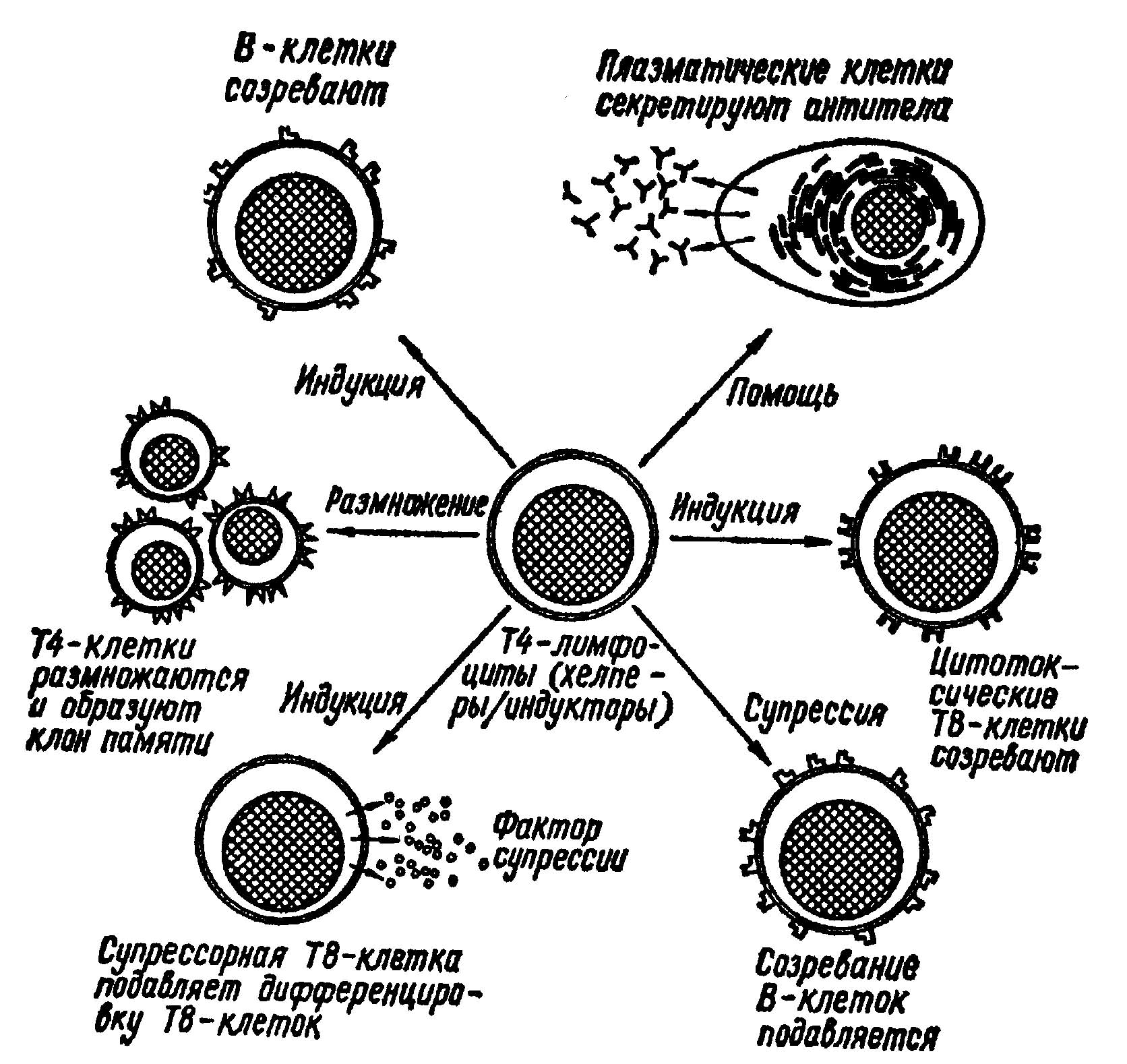
Как и всякая другая система, иммунная система имеет свои органы и клетки. Ее органы - это тимус (вилочковая железа), костный мозг, селезенка, лимфатические узлы (их иногда неправильно называют лимфатическими железами), скопление клеток в глотке, тонком кишечнике, прямой кишке. Клетками иммунной системы являются тканевые макрофаги, моноциты и лимфоциты. Последние в свою очередь, подразделяются на Т-лимфоциты (созревание их происходит в тимусе, откуда и их название) и В-лимфоциты (клетки, созревающие в костном мозге).
Макрофаги имеют многообразные функции, они, например, поглощают бактерии, вирусы и разрушенные клетки. В-лимфоциты вырабатывают иммуноглобулины - специфические антитела против бактериальных, вирусных и любых других антигенов - чужеродных высокомолекулярных соединениях. Макрофаги и В-лимфоциты обеспечивают гуморальный (от лат. humor - жидкость) иммунитет.
Так называемые клеточный иммунитет обеспечивают Т-лимфоциты. Их разновидность - Т-киллеры (от англ. killer - убийца) способны разрушать клетки, против которых вырабатывались антитела, либо убивать чужеродные клетки.
Сложные и многообразные реакции иммунитета регулируются за счет еще двух разновидностей Т-лимфоцитов: Т-хелперов (помощников), обозначаемых также Т4, и Т-супрессоров (угнетателей), иначе обозначаемых как Т8. Первые стимулируют реакции клеточного иммунитета, вторые угнетают их. В итоге обеспечивается нейтрализация и удаление чужеродных белков антителами, разрушение проникших в организм бактерий и вирусов, а также злокачественных переродившихся клеток организма, иначе говоря, происходит гармоническое развитие иммунитета.
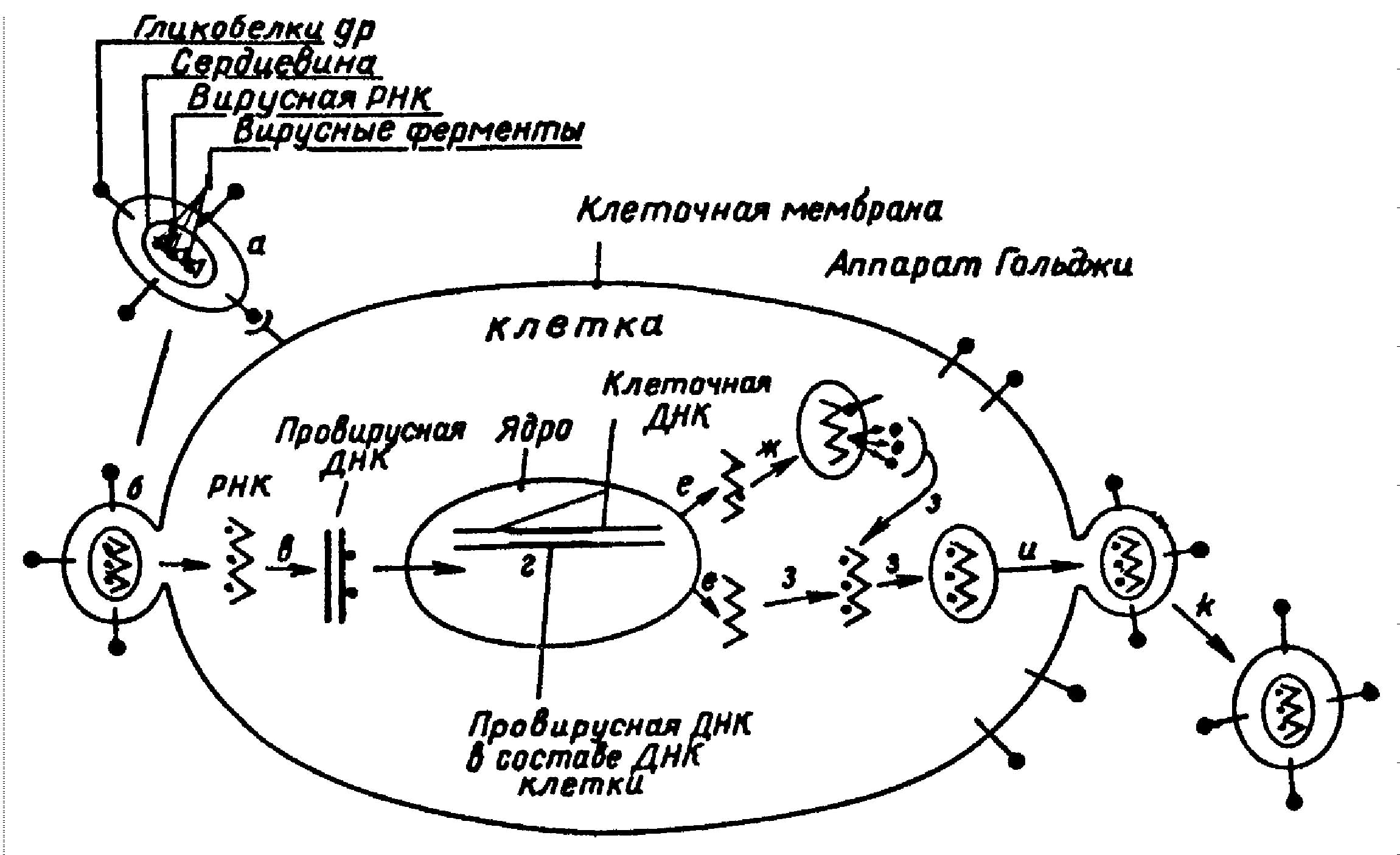
В общих чертах жизненный цикл HIV, такой же, как у других вирусов этой группы. Ретровирусы получили свое название в связи с тем, что в их развитии имеется этап, на котором перенос информации происходит в направлении обратном тому, которое считается обычным, нормальным. Генетическим материалом клеток является ДНК. В ходе экспрессии генов сначала происходит транскрипция ДНК: образуется копирующая ее мРНК, которая затем служит матрицей для синтеза белков. Генетическим материалом ретровирусов служит РНК, и, чтобы произошла экспрессия генов, должна появиться ДНК-копия вирусной РНК. Эта ДНК обычным путем обеспечивает синтез вирусных белков.
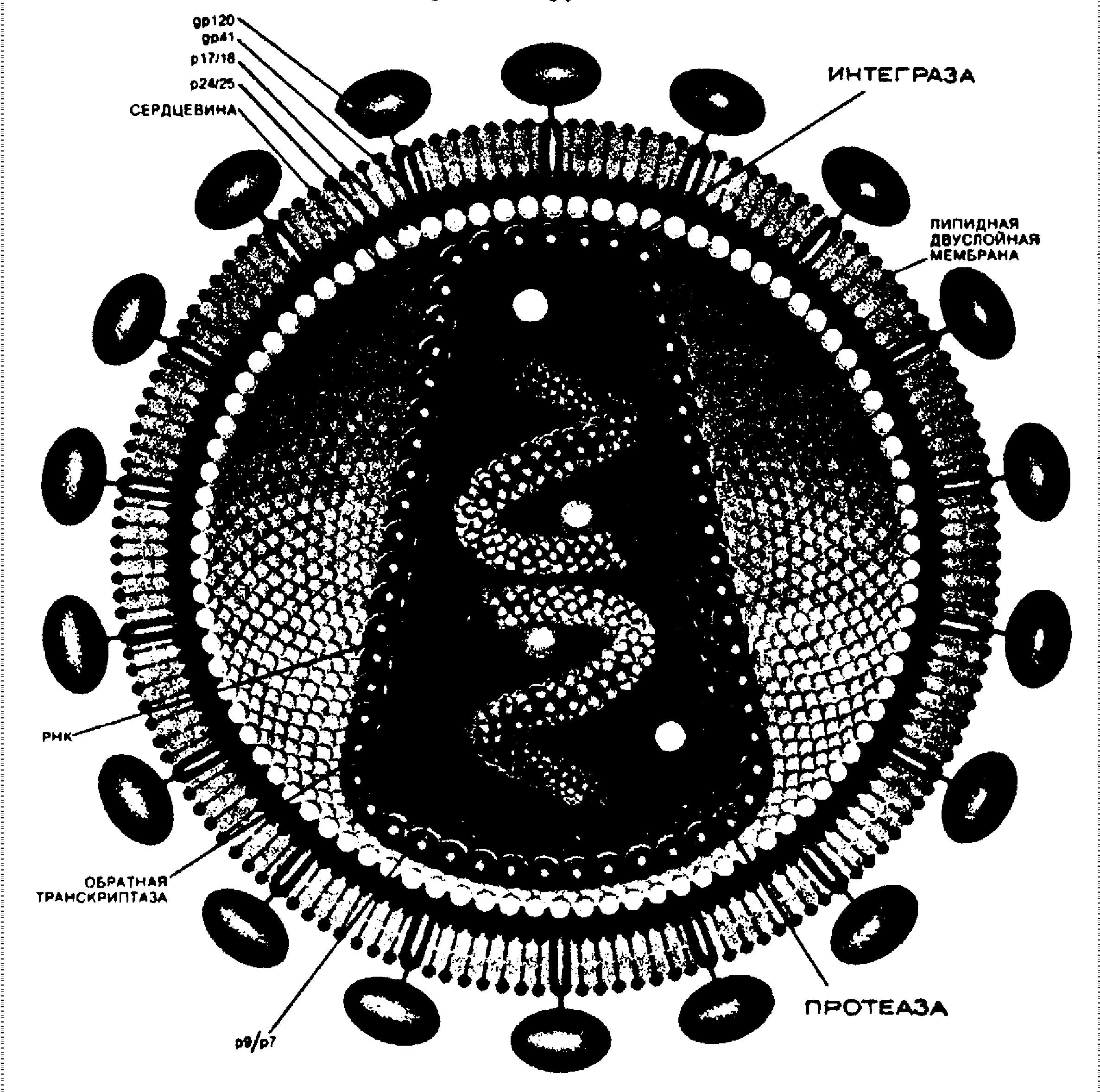
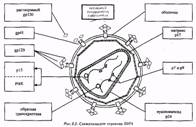
Жизненный цикл HIV начинается с того, что вирусная частица присоединяется снаружи к клетке и вводит внутрь нее свою сердцевину. Сердцевина вириона содержит две идентичные цепи РНК, а так же структурные белки и ферменты, нужные на последующих стадиях жизненного цикла. Фермент обратная транскриптаза, имеющая несколько ферментативных активностей, осуществляет этапы переноса генетической информации вируса - синтез ДНК. На первом этапе она синтезирует одноцепочечную ДНК по РНК, затем расщепляя последнюю. Затем синтезируется вторая цепь, используя первую в качестве матрицы.
Генетическая информация вируса, теперь уже в форме двухцепочечной ДНК, проникает в клеточное ядро. С помощью интегразной активности того же фермента эта ДНК встраивается в хромосомную ДНК. В таком виде вирусная ДНК, называемая провирусом, будет воспроизводиться вместе с собственными генами при делении клетки и передаваться следующим поколениям.
Вторая часть жизненного цикла HIV - производство новых вирионов - совершается спорадически и только в некоторых зараженных клетках. Она начинается, когда т.н. длинные концевые повторы (LTR, от англ. long terminal repeat; это особые нуклеотидные последовательности на концах вирусного генома) инициируют транскрипцию вирусных генов; при этом ферменты, принадлежащие клетке-хозяину синтезируют РНК - копии провируса.
Каждая вирусная частица собирается из множества копий двух различных белковых молекул, соотношение которых составляет примерно 20:1. Структура вириона довольно проста и состоит из двух оболочек: внешней - сферической, и внутренней - пулевидной. Последняя содержит в себе две цепи РНК и ферменты: обратную транскриптазу, протеиназу и интегразу. На внешней оболочке содержатся белки, молекулы которого выступают из мембраны наподобие шипов. Каждый шип образован двумя или тремя идентичными субъединицами, которые в свою очередь состоят из двух связанных компонентов, представляющих собой гликопротеины. Один компонент, обозначаемый gp120 (гликопротеин с молекулярной массой 120000), выступает над поверхностью клетки, а другой - gp41 - наподобие стержня погружен в мембрану. Эти гликопротеинные комплексы определяют способность HIV заражать новые клетки.
Хитроумно организованные генетические регуляторы определяют, начнется ли цикл репликации вируса, и какова будет интенсивность размножения. Помимо трех генов для белков сердцевины и оболочки в геноме HIV имеется по меньшей мере шесть генов. Некоторые из них, а возможно и все, регулируют производство вирусных белков: один ген обеспечивает ускорение синтеза белков в целом, другой - только определенных белков, а третий - подавление синтеза белков. Поскольку регуляторные гены сами кодируют белки, каждый из них влияет не только на структурные гены, но и на регуляторные гены, в том числе и на самого себя.
Регуляторный ген tat (от англ. trans-activator of transcription) ответственен за вспышку репликации, которая наблюдается, к примеру, в Т-4 клетках, когда они активируются при встрече с антигеном (чужеродной молекулой, вызывающей иммунный ответ). Ген tat необычен как по структуре, так и по своему действию. Он состоит из двух нуклеотидных последовательностей, расположенных довольно далеко друг от друга. В результате его транскрипции образуется РНК (первичный транскрипт), которая должна подвергнуться сплайсингу (промежуточный сегмент вырезается и кодирующие последовательности соединяются), чтобы она превратилась в мРНК и по ней синтезировался белок. влияние белка - продукта гена tat очень велико: он может повысить уровень экспрессии вирусных генов в 1000 раз по сравнению с тем, что наблюдается у мутантов HIV без этого гена. Стимулирующий эффект распространяется на все вирусные белки - как на структурные компоненту вирионов, так и на регуляторные белки, включая белок кодируемый самим геном tat. Благодаря такой положительной обратной связи, как только механизм с участием гена tat активировался, очень быстро образуется огромное количество вирусных частиц.
В то время как ген tat усиливает синтез всех вирусных белков без разбора, второй регуляторный ген, rev (от англ. regulator of virion-protein expression - регулятор экспрессии белков вириона) обладает избирательным действием, благодаря которому производятся либо регуляторные белки, либо компоненты вириона. Белок - продукт гена rev, как и в случае гена tat, кодируется разобщенными нуклеотидными последовательностями, которые соединяются в результате сплайсинга РНК. В регуляции этим белком участвуют еще две последовательности. Одна из них действует как репрессор: препятствует трансляции транскриптов, которые ее содержат. Другая последовательность взаимодействует с белком rev и снимает эффект первой последовательности.
Последовательность - репрессор, называемая CRS (от англ. cis-acting repression sequence), имеется в мРНК, по которым синтезируются белки, формирующие вирионы - сердцевинные белки, ферменты репликации и белок оболочки; мРНК регуляторных белков - продуктов генов tat и самого rev - не содержат CRS. В отсутствие белка - продукта гена rev - последовательность CRS не дает накапливаться длинным мРНК, по которым синтезируются белки для вирионов. Напротив, короткие мРНК, кодирующие регуляторные белки не имеющие CRS, стабильны и транслируются.
В присутствии белка - продукта гена rev происходит “переключение”. Этот белок действует на последовательность CAR (от англ. cis-acting rev-responsive sequence), которая тоже содержится в длинных мРНК. При этом нейтрализуется CRS и начинают накапливаться полноразмерные мРНК, и вместо регуляторных белков синтезируются белки, из которых собираются новые вирионы. Таким образом , механизм с участием гена rev может определять переход от скрытой инфекции к активному размножению вируса.
Однако в ходе репликации взаимодействие между механизмами rev и tat может сдерживать размножение вируса, нейтрализуя друг друга. Продукт гена tat усиливает синтез самого себя и белка гена rev, тогда как продукт гена rev замедляет собственный синтез и синтез белка кодируемого геном tat. В результате устанавливается своего рода гомеостаз, характеризующийся постоянными уровнями белков, кодируемых генами tat и rev, и умеренным производством вирусных частиц. Ограниченная репликация позволяет вирусу воспроизводиться годами, не убивая зараженные клетки, поэтому такой тип генетической регуляции может быть адаптивным признаком ретровирусов, хозяевами которых являются виды с долгим временем жизни, такие как человек.
Помимо активатора (tat) и избирательного регулятора (rev) у HIV есть негативный регулятор. Который замедляет транскрипцию вирусного генома. Ген негативного регуляторного фактора, обозначаемый nef (от англ. negative-regulatory factor), возможно, определяет способность HIV прекращать размножение и переходить в состояние покоя.
Последовательность, являющаяся мишенью белка - продукта гена nef, расположена в начале вирусного генома в длинном концевом повторе. Она называется негативным регуляторным элементом (NRE, от англ. negative- regulatory element). NRE подавляет транскрипцию даже сама по себе; если вирусный LTR, лишенный этой последовательности, ввести в незараженную клетку, он обеспечивает повышенный уровень транскрипции клеточных генов. Продукт гена nef усиливает эффект NRE. но каким образом он достигает этого - загадка.
Сложные механизмы регуляции размножения HIV действуют не в изоляции: они тесно связаны с метаболизмом клетки-хозяина. Начать с того, что вирус использует клеточный аппарат для транскрипции своих генов и синтеза белков. В частности, клеточные факторы явно играют роль во вспышке репликации HIV, происходящей при участии гена tat, когда зараженная Т-клетка стимулируется антигеном. Особенности молекулярного “климата” клетки-хозяина также, вероятно, как-то влияют на скорость размножения вируса, которая различна в различных типах клетки.
Возможно, для связи клеточных и вирусных процессов имеет значение связь клеточных белков с LTR в начале вирусного генома. Последовательности в LTR определяют сайт инициации транскрипции вирусных генов - стартовую точку, в которой начинается синтез мРНК. По крайней мере восемь белков, которые в норме участвуют в клеточной транскрипции, связываются с клеточной ДНК в сайте инициации транскрипции или рядом с ним. Они играют определенную роль в процессе транскрипции. Один из белков, который узнает инициаторные последовательности, играет специфическую роль в Т-клетках и других лимфоцитах. Этот белок активируется, когда лимфоцит стимулируется антигенами и начинает размножаться. Считается, что он способствует размножению клетки, усиливая транскрипцию. Как выяснилось, при стимуляции зараженных Т-клеток усиливается связывание этого белка с геномом провируса. Таким образом активация этого белка может быть одним из путей ускорения размножения HIV при стимуляции Т-клетки.
Вероятно, набор клеточных факторов, действующий на вирусный геном, варьирует в зависимости как от условий, так и от типа клетки-хозяина. Некоторые клетки, находясь в состоянии покоя. Могут просто не иметь белков, необходимых для инициализации транскрипции, так что инфекция остается скрытой. В других клетках скорость размножения вируса может быть ограничена из-за низкой концентрации инициаторных факторов или из-за избытка белков, ингибирующих синтез мРНК. Таким образом, клетка-хозяин при помощи собственных факторов транскрипции создает молекулярное окружение, влияющее на регуляторные механизмы HIV.
После того как в результате действия описанных выше механизмов началось производство вирусных частиц, в игру вступает последний ген. Этот ген, названный vif (от англ. virion infectivity factor - фактор инфекционности вириона), кодирует небольшой белок, который обнаруживается в цитоплазме зараженных клеток и вокруг них в межклеточной среде, а так же в свободных вирусных частицах. Белок - продукт гена vif каким-то образом усиливает способность отпочковавшегося вириона заражать другие клетки. У штаммов HIV с мутациями, инактивирующими vif, вирионы имеют нормальный вид, содержат полный набор РНК и ферментов, но заражают клетки намного менее эффективно.
Похожие работы
... и атрофии некоторых нервов (зрительного в первую очередь). Поражение нервной системы отмечается у трети больных СПИДом и проявляется в четырех основных клинических формах: * абсцессы мозга (прогрессирующая многоочаговая лейкоэнцефалопатия, криптококковый менингит, ...
... (По-английски AIDS – acquired immunodeficiency syndrome). Далее началось период быстрого прогресса в исследованиях СПИДа, значительные новости появлялись практически каждый год. В решение проблемы, связанных со СПИДом, были вовлечены специалисты многих разделов наук: вирусологи, иммунологи, цитологи, эпидемиологи, врачи и др. Уже в 1982 – 1983 гг. была выявлена общая картина болезни, установлено ...
... наиболее характерно отражают манифестную форму ВИЧ-инфекции, представить в едином целом схему фаз течения болезни, классифицировать состояния, наблюдаемые наиболее закономерно Разновидности ВИЧ Для вируса иммунодефицита человека характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения. Частота возникновения ошибок у ВИЧ составляет 10-3 — 10-4 ошибок / ( ...
... мер не предпринимали. Считалось, что болезнь затрагивает только гомосексуалистов, а эта проблема для советского общества не актуальна. В 1983 году французскими и американскими исследователями был выявлен вирус, получивший международное название «вирус иммунодефицита человека (ВИЧ)». Естественно, что вскоре появились первые тестсистемы для лабораторной диагностики этого заболевания. С созданием ...



0 комментариев