Навигация
Препараты, противостоящие СПИДу
4. Препараты, противостоящие СПИДу
Всякое терапевтическое средство против инфекции независимо от природы патогена - будь то вирус, бактерия, грибок или простейшее - должно либо вызывать гибель патогена, либо прекращать его размножение. При этом препарат не должен причинять существенного вреда зараженному организму. Как правило, такие лекарства выполняют свою задачу, действуя на биохимические процессы, характерные только для патогена. В случае бактерий это достигается сравнительно просто, так как по структуре и метаболизму клетки бактерий и клетки организма млекопитающего сильно различаются. Например, пенициллин нарушает синтез клеточной стенки бактерий, а на клетки млекопитающих, у которых нет такой стенки, он не действует.
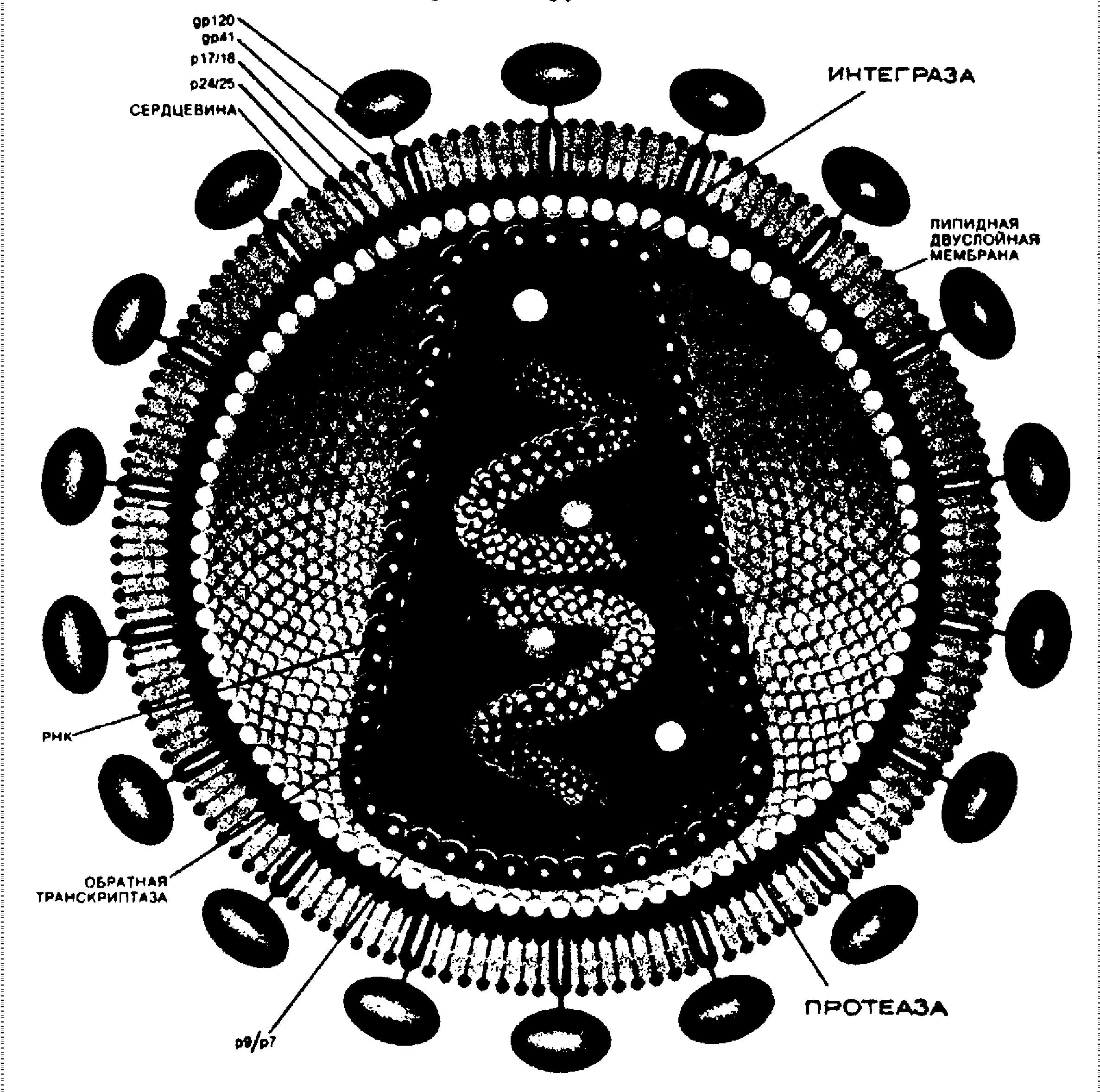
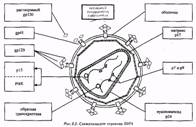
С вирусами ситуация гораздо сложнее. Вирусы представляют собой просто генетический материал, одетый в оболочку из гликопротеинов и липидов. Они не способны размножаться самостоятельно и вместо этого заражают клетки другого организма и узурпируют их аппарат биосинтеза, который и обеспечивает воспроизведение вируса. Когда происходит активная репликация вируса, часто бывает трудно различить вирусные белки, взаимодействующие с клеткой и белки самой клетки. Тесная связь многих этапов жизненного цикла вируса с метаболизмом клетки-хозяина затрудняет создание препаратов, которые избирательно подавляют репликацию вируса и в тоже время минимально воздействуют на клетку.
Существенно также, что практически любой препарат (в том числе и пенициллин) обладает в той или иной степени побочным действием и токсичностью. Поэтому всегда необходимо учитывать не только эффект воздействия на патоген, но и вред, причиняемый организму человека. Важнейшей характеристикой потенциального терапевтического препарата является его “терапевтический индекс”: отношение токсичной дозы к эффективной дозе. Однако в случае болезней , представляющих угрозу для жизни, таких как СПИД, допустимо использовать и препараты со сравнительно низкими значениями терапевтического индекса по меньшей мере, пока не созданы более совершенные.
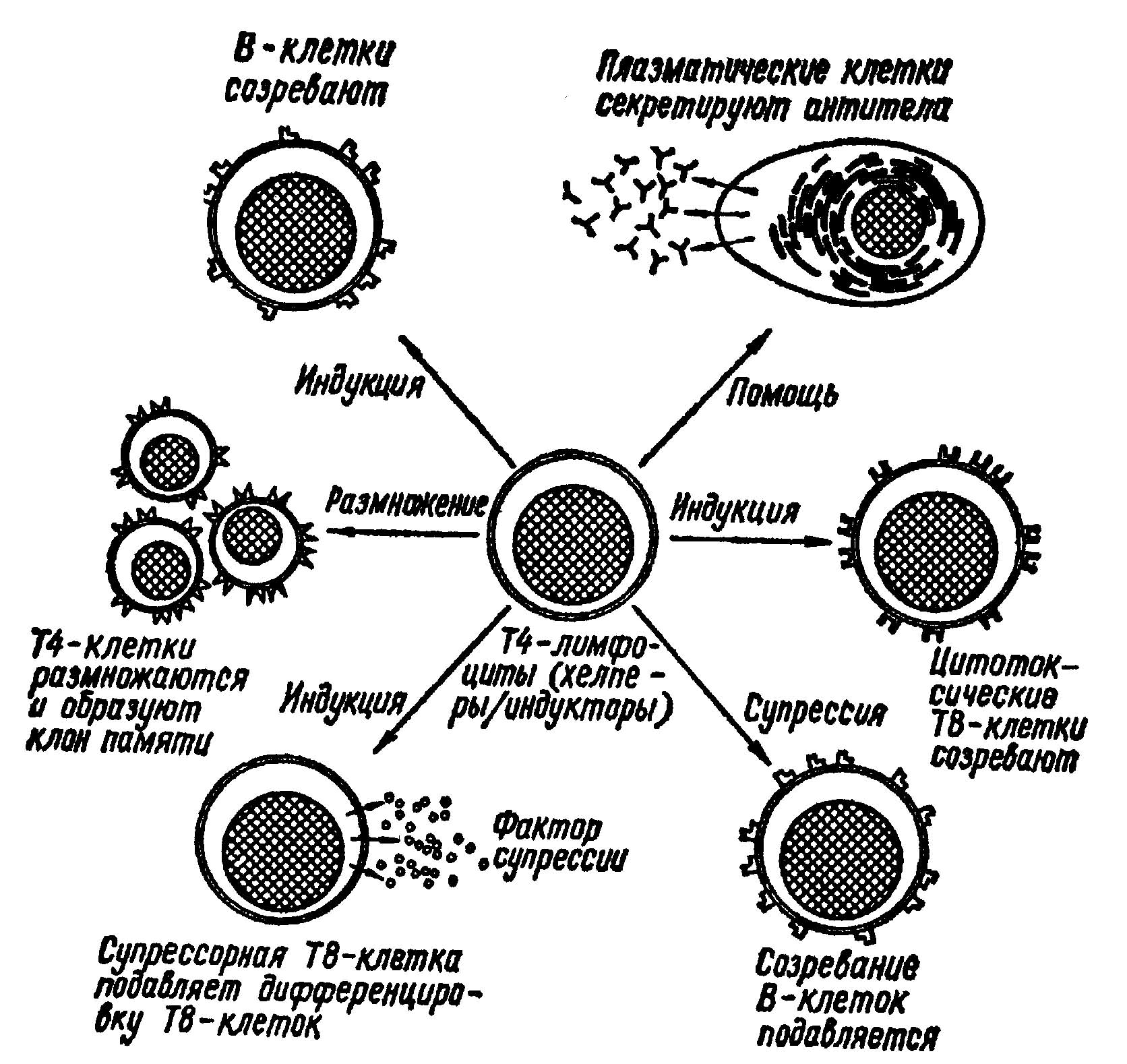
Сложный жизненный цикл позволяет HIV заражать клетки иммунной системы и ускользать от их действия. Но для борьбы с инфекцией такая сложность может быть не только бедствием, но и благом, поскольку она предоставляет много возможностей для воздействия противовирусных средств.
Первая стадия - связывание вируса с клеткой (см. выше). Существует несколько возможностей подавлять этот процесс. Можно получить антитела, которые взаимодействуют с соответствующей частью оболочки вируса и тем самым нейтрализуют способность gp120 связываться с CD4. Можно соединить такие антитела с молекулами какого-либо токсина, тогда они, связываясь с зараженными клетками, например с макрофагами, содержащими вирус и производящими его белки, будут убивать их. Можно получить и антитела к CD4, но этот подход потенциально опасен, потому что такие антитела будут атаковать и здоровые клетки иммунной системы организма. Поэтому исследования направлены главным образом на получение антител к gp120.
Получить эффективные антитела, нейтрализующие gp120, по ряду причин трудно. Не все антитела против gp120 будут блокировать ключевой участок связывания с CD4. У больных, в организме которых в процессе нормальной реакции на инфекцию HIV образуются нейтрализующие антитела (обычно лишь в малом количестве), СПИД тем не менее развивается. Определенного разрешения этой проблемы пока нет. Возможно одна из причин - высокая скорость мутирования HIV. У некоторых возникающих в организме вариантов вируса может быть изменен гликопротеин оболочки, и он не будет нейтрализовываться имеющимися антителами. Вторая возможная причина заключается в том, что молекулы сахаров. Входящие в состав гликопротеина оболочки HIV, сходны с аналогичными структурами на поверхности клеток человека, поэтому на оболочке вируса недостаточно уникальных участков, которые будут распознаваться иммунной системой как “чужие” и с которыми могли бы связываться антитела. В-третьих, в молекулах gp120 участок связывания CD4 расположен в углублении и потому мало доступен. Наконец, не исключено, что важные для связывания участки gp120 открыты только в момент связывания, а большую часть времени недоступны для иммунной системы.
Чтобы преодолеть эти трудности применяется несколько подходов. Один состоит в получении моноклональных антител. Для этого нужно идентифицировать антитела, которые действительно связываются с ключевым участком вирусного белка, клонировать производящие их лимфоциты и выращивать эти клетки in vitro.
Второй подход использует антиидиотипические антитела, т.е. “антитела против идиотипа”; в данном случае это антитела против антител к CD4. Идея заключается в том, что молекула моноклонального тела против CD4 по структуре может имитировать участок связывания CD4 в молекуле gp120, и поэтому антитело (антиидиотип) к этому участку должно связываться с gp120.
Третий подход заключается в создании растворимой, т.е. не связанной с клетками формы CD4, которая способна взаимодействовать с HIV, занимая его участки связывания и тем самым препятствуя его связыванию с CD4 на поверхности Т4-хелперов. В настоящее время растворимый CD4 был получен методами генной инженерии. Этот препарат действительно блокирует участки связывания CD4 на оболочке HIV и подавляет заражение Т-клеток. Вероятно, вирусу трудно будет измениться таким образом, чтобы потерять сродство к CD4, сохраняя при этом способность заражать другие клетки.
В будущем, возможно, удастся создать “химерные” молекулы, в которых объединятся участок молекулы CD4, взаимодействующий с HIV, и константная часть молекулы иммуноглобулина человека. Такие антитела “на заказ” должны обладать рядом преимуществ. Определенные участки тяжелых цепей иммуноглобулина способны активировать другие компоненты иммунной системы, приводя к разрушению вируса. Химерная молекула действовала бы подобно полицейскому с ищейкой: часть CD4 будет выслеживать вирус, а часть иммуноглобулина - вызывать подмогу для нападения. Кроме того, химерные молекулы могут дольше находиться в кровяном русле, чем просто растворимый CD4, потому что определенные иммуноглобулины обладают большим временем жизни в кровотоке.
В основе рассмотренных подходов лежит использование сложных биологических молекул, которые связываются с поверхностным гликопротеином вируса. Однако сходным образом могут действовать и другие молекулы. Было показано, что некоторые крупные отрицательно заряженные соединения, содержащие сульфатные группы, подавляют репликацию HIV. Прототипом может послужить декстрансульфат, молекулы которого с молекулярной массой в пределах 7000 - 8000 дальтон подавляют репликацию HIV in vitro. Один из механизмов действия декстрансульфата, вероятно, является подавление связывания вируса. Установлено также, что это соединение in vitro мешает образованию синцитиев, чего вполне можно ожидать для агента, блокирующего связывание вируса. Однако, токсичные и эффективные дозы этого препарата пока недостаточно изучены.
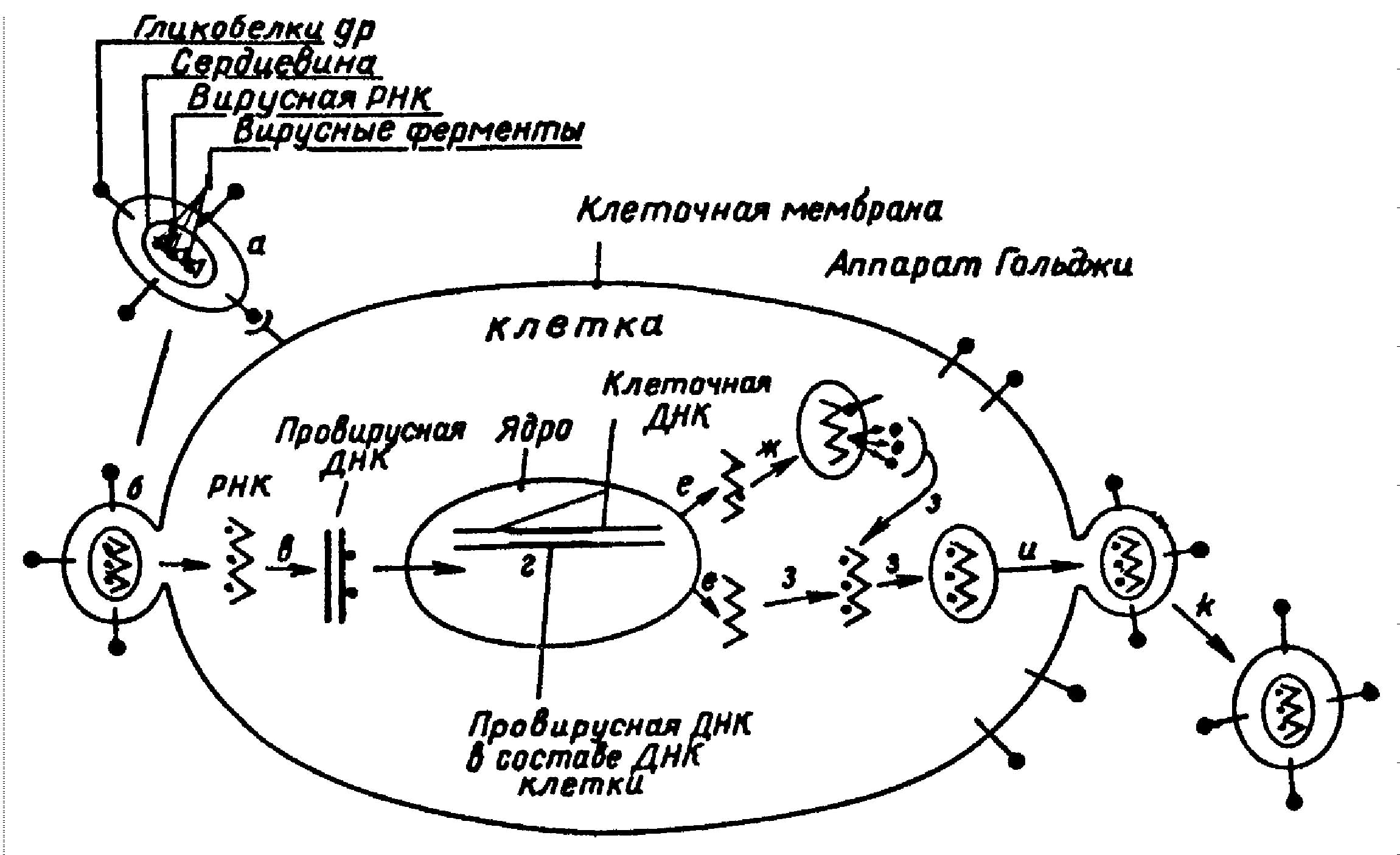
Когда HIV связался с клеткой, вирусная мембрана сливается с клеточной мембраной, и содержимое вириона попадает в цитоплазму. Здесь его сердцевинные белки частично удаляются, обнажая РНК. Антитела к gp41 могли бы предотвращать проникновение вируса в клетку. Возможны также реагента, препятствующие процессу “раздевания” РНК.
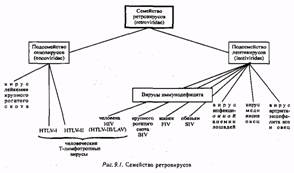
Однако в качестве мишени для воздействия на вирус наибольшее внимание привлек к себе следующий этап жизненного цикла вируса - синтез вирусной ДНК обратной транскриптазой. Здесь видятся особые преимущества, поскольку этот этап характерен только для ретро вирусов и не имеет отношения к клетке-хозяину. В поисках средств против ретровирусов с самого начала уделялось первостепенное внимание этой задаче. В частности исследовались соединения, называемые дидезоксинуклеозидами, которые являются ингибиторами обратной транскриптазы. Это аналоги нуклеозидов, т.е. по структуре они очень близки к нуклеотидам, служащим мономерами ДНК и РНК.
Одно из таких соединений - 3`-азидо-2`,3`- дидезокситимидин, или азидотимидин. Он был синтезирован в 1964 г. и первоначально предназначался в качестве противоракового препарата. В 1985 г. было обнаружено, что он является мощным ингибитором размножения HIV в культуре Т-лимфоцитов в концентрациях 1 - 5 мкМ (0,25 - 1,25 мкг/мл). При этом не наблюдалось заметной токсичности азидотимидина при концентрациях 20 - 50 мкМ или менее. Вскоре было показано, что азидотимидин эффективно действует у больных СПИДом при концентрации в организме 1 - 5 мкМ, как и предсказывалось на основании исследования в культуре Т-клеток.
Каким образом это соединение защищает клетки от HIV? Суть состоит в том, что оно близко по структуре к нуклеозиду тимидину, входящему в состав ДНК. В клетке азидотимидин подвергается ферментативному фосфорилированию: к нему присоединяется цепочка из трех фосфатных групп. Азидотимидин трифосфат и есть активная форма препарата. (Вводить в организм непосредственно азидотимидинтрифосфат нельзя, так как клетки не способны его поглощать.) Азидотимидинтрифосфат является аналогом тимидинтрифосфата - одного из мономеров ДНК. По-видимому, механизм подавления синтеза вирусной ДНК двоякий: конкурентное ингибирование и терминация синтеза цепи ДНК.
Конкурентное ингибирование состоит в том, что азидотимидинтрифосфат связывается с обратной транскриптазой в том участке, который в норме связывает обычные нуклеозидтрифосфаты. При терминации синтеза цепи ДНК обратная транскриптаза ошибочно включает азидотимидинтрифосфат в растущую цепь вирусной ДНК вместо тимидинтрифосфата, но присоединение следующего нуклеотида невозможно, потому что в молекуле азидотимидинтрифосфата нет гидроксильной группы, которая необходима для образования связи со следующим нуклеотидом. Вирус не в состоянии исправить эту ошибку и синтез дек прекращается.
Другие дидезоксинуклеозиды, обладающие активностью против HIV, действуют, по-видимому, таким же образом. Все эти соединения оказались эффективными против ряда ретровирусов (собственно всех, которые изучались на этот предмет), но только в форме трифосфатов. Поэтому их эффективность как терапевтических средств определяется тем, насколько легко они проникают в клетки и фосфорилируются клеточными ферментами, называемыми киназами. Например, фосфорилирование одних дидезоксинуклеозидов происходит лучше, чем других. Так 2`,3` - дидезокситимидин, который отличается от азидотимидина тем, что вместо азидогруппы (N3) имеется атом водорода, в клетках человека плохо фосфорилируется и поэтому менее эффективен против HIV, чем азидотимидин. Кроме того, процесс фосфорилирования этих соединений различается у разных видов, так что модели на животных могут быть неадекватными для предсказания эффективности конкретного дидезоксинуклеотида в организме человека.
Очень важно, может ли обратная транскриптаза вируса измениться в результате мутаций таким образом, что больше не будет ингибироваться азидотимидином. Это вопрос вовсе не праздный. Азидотимидин эффективен постольку, поскольку обратная транскриптаза HIV предпочитает азидотимидинтрифосфат тимидинтрифосфату, связывает его и включает в ДНК, в то время как ДНК-полимеразы клеток млекопитающих не обладают таким сродством к азидотимидинтрифосфату, синтез клеточной ДНК не нарушается и клетка продолжает успешно функционировать. Не исключено, что обратная транскриптаза могла бы утратить предпочтение к азидотимидинтрифосфату.
После того как на вирусной РНК синтезировалась цепь ДНК, начинается вторая стадия процесса обратной транскрипции - синтез второй нити ДНК, комплементарной первой. На этом этапе также возможно действие лекарственных препаратов. Например, можно попытаться нарушить работу вирусного фермента РНКазы Н, являющегося частью обратной транскриптазы; РНКаза Н, после того как синтезирована первая нить ДНК, расщепляет вирусную РНК, освобождая тем самым место для образования второй нити. Возможно, удастся блокировать и другую часть фермента - интегразу, которая, как полагают, разрезает ДНК клетки-хозяина и вставляет в разрыв ДНК вируса.
Следующее потенциально уязвимое место в цикле HIV появляется несколько позже, когда активируется клетка-хозяин. Клетка может начать синтезировать новые белки а также делиться. Тот же процесс, который активирует клетку, может инициировать транскрипцию провируса и трансляцию с образованием вирусных белков. Существует возможность нарушить этот процесс, используя “антисмысловые олигонуклеотиды”. Суть этой идеи заключается в следующем. Нужно получить олигонуклеотиды (короткие последовательности нуклеотидов), комплементарные части вирусной мРНК; мРНК - это смысловая последовательность, поскольку она непосредственно кодирует белок, а олигонуклеотиды называются антисмысловыми, потому что они комплементарны мРНК. Эти нуклеотиды способны связываться с вирусной мРНК; происходят, как говорят, молекулярная гибридизация: образуется дуплекс, т.е. двухцепочечный участок молекулы, который, вероятно, препятствует движению рибосом клетки вдоль вирусных мРНК и тем самым блокирует синтез вирусных белков. Такой механизм называется гибридизационным блоком трансляции.
В качестве лекарства олигонуклеотиды плохи тем, что многие из них могут расщепляться в клетках под действием ферментов. Правда их можно сделать устойчивыми к ферментативному расщеплению, если модифицировать определенные фосфодиэфирные связи между нуклеотидами.
В принципе возможно предотвращать образование вирусных частиц, блокируя гены или белки, которые осуществляют регуляцию репликации HIV.
Кроме того, на репликацию HIV могут влиять белки самой клетки и даже вирусы, которые случайно заразили ту же клетку. Например, было показано, что клеточный белок NF-kB, который играет роль внутриклеточного сигнала активации в некоторых лимфоцитах, способен инициировать репликацию HIV. При заражении рядом герпесвирусов в клетке образуется белок, известный под названием ICPO, который также может быть инициатором репликации HIV. Поэтому у больных, зараженных одновременно и HIV и герпесвирусом, возможно, удастся задерживать развитие СПИДа, контролируя герпесную инфекцию, например, с помощью препарата ацикловира.
В настоящее время исследователям не стоит связывать свои надежды с каким-либо одним методом лечения или лекарственным препаратом - напротив, необходимо приложить все усилия, чтобы разработать множество различных агентов, способных атаковать HIV на различных этапах его жизненного цикла. Опыт изучения азидотимидина сослужит хорошую службу при “доведении” препаратов до стадии, когда их можно будет использовать для лечения больных. С того момента, как была обнаружена активность азидотимидина против HIV до утверждения препарата для применения в медицинской практике прошло около двух лет. Несомненно, столь быстрый прогресс объясняется тщательными, научно обоснованными клиническими испытаниями.. Трудно переоценить значение метода испытаний с контрольной группой - как для успеха будущих средств лечения СПИДа, так и для изучения этого заболевания в целом, без чего немыслима победа над ним.
Литература
Уильям А. Хэзелтайн, Флосси Вонг-Стааль; Молекулярная биология вируса СПИДа.:// В мире науки , №12, 1988.
Джонатан Н. Вебер, Робин А. Вейсс; Взаимодействие вируса СПИДа с клеткой.:// В мире науки , №12, 1988.
Роберт Яркоан, Хироаки Мицуя, Самьэл Бродер; Средства лечения СПИДа.:// В мире науки , №12, 1988.
Роберт К. Галло; Вирус синдрома приобретенного иммунного дефицита.:// В мире науки , №3, 1987.
Похожие работы
... и атрофии некоторых нервов (зрительного в первую очередь). Поражение нервной системы отмечается у трети больных СПИДом и проявляется в четырех основных клинических формах: * абсцессы мозга (прогрессирующая многоочаговая лейкоэнцефалопатия, криптококковый менингит, ...
... (По-английски AIDS – acquired immunodeficiency syndrome). Далее началось период быстрого прогресса в исследованиях СПИДа, значительные новости появлялись практически каждый год. В решение проблемы, связанных со СПИДом, были вовлечены специалисты многих разделов наук: вирусологи, иммунологи, цитологи, эпидемиологи, врачи и др. Уже в 1982 – 1983 гг. была выявлена общая картина болезни, установлено ...
... наиболее характерно отражают манифестную форму ВИЧ-инфекции, представить в едином целом схему фаз течения болезни, классифицировать состояния, наблюдаемые наиболее закономерно Разновидности ВИЧ Для вируса иммунодефицита человека характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения. Частота возникновения ошибок у ВИЧ составляет 10-3 — 10-4 ошибок / ( ...
... мер не предпринимали. Считалось, что болезнь затрагивает только гомосексуалистов, а эта проблема для советского общества не актуальна. В 1983 году французскими и американскими исследователями был выявлен вирус, получивший международное название «вирус иммунодефицита человека (ВИЧ)». Естественно, что вскоре появились первые тестсистемы для лабораторной диагностики этого заболевания. С созданием ...



0 комментариев