Навигация
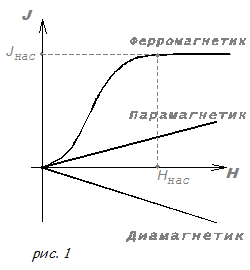
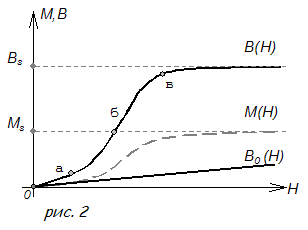
Природа ферромагнетизма
1.6 Природа ферромагнетизма
Из предыдущего параграфа следует, что элементарными носителями ферромагнетизма являются электронные спины. Однако возникает вполне законный вопрос почему же электронные спины создают ферромагнетизм не во всех веществах, а только в некоторых, причем очень немногих? Почему ферромагнитны железо, никель, почему не ферромагнитны медь и серебро? Ведь и в атомах меди электроны вращаются вокруг ядра, обладая орбитальными магнитными моментами, и в атомах меди электроны вращаются вокруг своей оси и, таким образом, обладают спиновыми магнитными моментами.
Ответ следует, очевидно, искать в специфике атомного строения ферромагнитных веществ.
В атоме с достаточно большим порядковым номером вокруг ядра вращается значительное количество электронов. При вращении вокруг ядра электроны располагаются некоторыми слоями. Максимальное число электронов в слое (оболочке) равно 2n2, где n – порядковый номер слоя. Так, например, в первом слое электронов может быть всего 2, во втором слое 2·22, или 8, а в третьем 2·32, или 18, а в четвертом 32 электрона и т.п.
При переходе от одного атома к другому в порядке увеличения его атомного номера с меньшими порядковыми номерами и лишь потом начинают заполняться более отдаленные слои. Так, в атоме водорода всего один электрон, и он будет находиться в первом электронном слое. Атом гелия (его порядковый номер два) имеет два электрона, и они оба находятся в первом слое. У химического элемента лития, имеющего порядковый номер три, - три электрона. Эти электроны не могут быть размещены в первом слое, поскольку, как указывалось выше, максимальное количество электронов, которое может быть в первом слое, равно двум. Следовательно, третий электрон в атоме лития расположен во втором слое. У следующих по порядку элементов – бериллия, бора, углерода и т.д. – будет все больше и больше заполняться второй слой. У неона, имеющего порядковый номер десять, этот слой окажется полностью заполненным. Очевидно, у следующего элемента – натрия – начинает заполняться третий слой.
В слоях следует различать подслои. Первый подслой носит название s–подслоя и находящиеся в нем электроны называются s-электронами. Второй подслой называется p-подслоем, третий – d-подслоем, четвертый – f-подслоем. Соответственно этому имеем s, p, d, или f-электроны. Согласно квантовой теории, число электронов в каждом подслое должно быть ограничено. Так, в s-подслое их будет не более двух, в p-подслое – не более 6, в d-подслое – не более 10, в f-подслое число их не может превышать 14. Максимальное число электронов в слое равно 2n2, поэтому можно подсчитать также, какое число подслоев имеет каждый слой.
Первый слой, содержит всего 2 электрона, не имеет подслоев. Второй слой, который может иметь 8 электронов, имеет два подслоя: s-подслой (с двумя электронами) и p-подслой (с шестью электронами). Для обозначения того, в каком подслое какого слоя находится электрон, обозначают номер слоя числом, за которым ставят букву, обозначающую подслой. Например, запись 2s означает, что электрон принадлежит к первому подслою второго слоя, а запись 4d означает, что электрон принадлежит к третьему подслою четвертого слоя (таблица 1).
Таблица 1 - Максимальное число электронов в подслое каждого слоя
| Первый слой | Второй слой | Третий слой | Четвертый слой |
| 1 | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f |
| 2 | 2 6 | 2 6 10 | 2 6 10 14 |
Последовательный характер заполнения слоев при переходе к химическим элементам с большими порядковыми номерами нарушается в третьем слое. Это значит, что наблюдаются случаи, когда третий слой еще не совсем заполнен, а уже начинает заполняться четвертый слой. Заметим, что у заполненных слоев и подслоев как орбитальные, так и спиновые магнитные моменты оказываются взаимно скомпенсированными, т.е. если направленные в одну сторону спины условно считать положительными, а в противоположную сторону – отрицательными, то число плюс и минус спинов окажется равным.
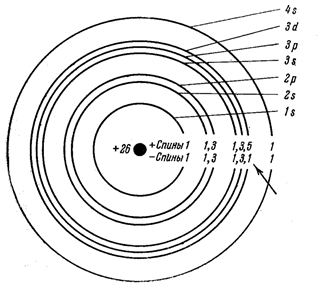
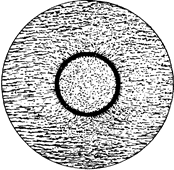
Рисунок 10 - Электронные слои и подслои в атоме железа.
На рисунке 10 схематически представлены электронные слои и подслои в атоме железа. Видно, что в атоме железа целиком заполнены первый и второй слои с одинаковым количеством + и – спинов в каждом. Одинаковое число + и – спинов находится также во внешнем, четвертом слое. Что же касается третьего слоя, то в нем целиком, с одинаковым числом + и – спинов, заполнены подслои 3s и 3p, а подслой 3d не заполнен и содержит 5 положительных спинов и 1 отрицательный.
Для других ферромагнетиков также характерно наличие внутренних незаполненных электронных слоев. Для железа, никеля и кобальта незаполненными являются 3d-подслой, для лантанидов подслой 4f.
Наличие внутренних незаполненных слоев в атоме является необходимым, но еще недостаточным условием для возникновения ферромагнетизма. В самом деле, внутренние незаполненные слои мы встречаем не только у ферромагнитных элементов. Например, незаполненные слои имеют атомы марганца, хрома, ванадия, все лантаниды, а между тем марганец, хром и ванадий не ферромагнитны, так же как и лантаниды (за исключением гадолиния, эрбия, диспрозия, тербия, тулия и гольмия).
Лантаниды - химические элементы, очень сходные по своим химическим свойствам с лантаном и имеющие в таблице Менделеева порядковые номера от 57 до 70.
Кроме того, сами атомы ферромагнитного вещества, будучи изолированными друг от друга, не проявляют никаких ферромагнитных свойств.
Ферромагнитные свойства проявляются только ниже некоторой определенной температуры, в кристаллическом состоянии. Как было показано советским физиком Я.И. Френкелем, ферромагнетизм возникает благодаря особому взаимодействию электронов незаполненных слоев между соседними атомами. Такое взаимодействие называется «обменным», ибо взаимодействующие электроны перестают быть связанными с определенными атомами, «коллективизируются». Электрон, принадлежащий первому атому, оказывается принадлежащим также и второму атому, и наоборот. Атомы как бы обмениваются электронами. Поэтому такое взаимодействие называется обменным.
Обменное воздействие характеризуется так называемым интегралом обмена, который очень сильно зависит от расстояния между атомами в кристаллической решетке. При значительных расстояниях между атомами это взаимодействие равно нулю. С уменьшением расстояния взаимодействие растет, интеграл обмена положителен. При положительном значении интеграла обмена взаимодействие приводит к параллельной ориентации спинов, что в свою очередь ведет к самопроизвольной или спонтанной намагниченности вещества – основного свойства ферромагнетизма. При дальнейшем уменьшении расстояния интеграл обмена, пройдя максимальное значение, начинает убывать и становиться отрицательным. При отрицательном значении интеграла обмена спины электронов самопроизвольно устанавливаются антипараллельно друг другу, что приводит к особому явлению, называемому антиферромагнетизмом. Как показали исследования, интеграл обмена положителен, т.е. вещество обладает ферромагнитными свойствами, если отношение диаметра атома к диаметру незаполненной оболочки больше 1,5.
Зависимость интеграла обмена от отношения диаметра атома к диаметру незаполненной оболочки представлена на рисунке 11 и таблице 2.
Таблица 2 - Зависимость магнитных свойств от отношения диаметра атома к диаметру незаполненной его оболочки
| Элемент | Диаметр атома a, А | Диаметр незаполненного слоя d, А | Отношение а/d | Примечание |
| Марганец | 2,52 | 1,71 | 1,47 | Не ферромагнитен |
| Железо | 2,50 | 1,53 | 1,63 | Ферромагнитен |
| Кобальт | 2,51 | 1,38 | 1,82 | Ферромагнитен |
| Никель | 2,50 | 1,27 | 1,97 | Ферромагнитен |
| Платина | 2,77 | 2,25 | 1,23 | Не ферромагнитна |
| Гадолиний | 3,35 | 1,08 | 3,10 | Ферромагнитен |
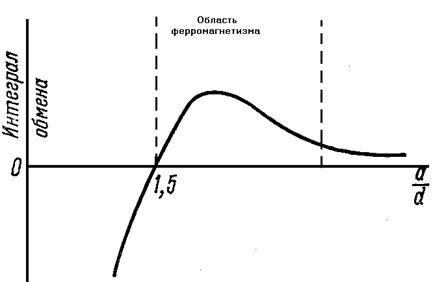
Рисунок 11 - Зависимость интеграла обмена от отношения диаметра атома к диаметру незаполненной оболочки.
Итак, можно сделать следующие выводы:
Элементарными носителями ферромагнетизма являются электронные спины.
Ферромагнетизм присущ тем элементам, в которых:
а) имеются внутренние незаполненные слои;
б) отношение диаметра атома в кристаллической решетке к диаметру незаполненного слоя больше 1,5 (интеграл обмена положителен)
Следует также отметить, что ферромагнетизм возможен лишь в кристаллическом состоянии ниже некоторой температуры, характерной для каждого ферромагнетика [7, с. 32-41].
Похожие работы
... проводимости, запрещенная валентная зона, энергия активации). 8. Температурная зависимость полупроводников. Литература, рекомендуемая к лабораторной работе: 10. Матвеев А.Н. Электричество и магнетизм.- М.: Высшая школа, 1983. 11. Калашников С.Г. Электричество. – М.: Наука, 1977. 12. Савельев И.В. Курс общей физики. Т.2, Т. 3. – М.: Наука, 1977. 13. Телеснин Р.В., Яковлев В.Ф. Курс ...
... , что элементарными носителями магнетизма в них являются спиновые магнитные моменты электронов . В современной квантово-механической теории ферромагнетизма объяснена природа самопроизвольной намагниченности ферромагнетиков и природа возникновения сильного внутреннего поля . Ферромагнитными свойствами могут обладать кристаллы веществ, атомы которых имеют не заполненные электронами внутренние ...
... беспредельной ёмкостью памяти, а спецификой механизмов, предохраняющих человеческую память от "переполнения". По быстродействию (скорости записи и воспроизведения информации) машинная память значительно превосходит память человека. Скорость срабатывания элементов, на основе которых строятся современные ЗУ, определяется в конечном счете скоростью протекания электронных процессов, в то время как ...
... включать режим I при входном напряжении частотой 50 Гц, т.е. в "сеть" ибо это действие может привести к порче оборудования. При исследовании явления магнитного гистерезиса производится расчеты напряженности магнитного поля и магнитной индукции по выше рассмотренным формулам. Исследование ферромагнитных свойств электротехнической стали. В качестве исследуемого образца был взят ...




0 комментариев