Навигация
2.3. Тиоциановая кислота
Тиоциановая кислота (роданистоводородная кислота, HNCS) представляет собой бесцветную, маслянистую, резко пахнущую жидкость ( при 5 °С). При температуре -110° является белой кристаллической массой (Кд=0,14). Она является сильной кислотой.
На организм человека тиоциановая кислота оказывает токсическое действие, раздражая слизистые оболочки. Она содержится в соке лука Allium соера и в корнях некоторых других луковичных растений. [2]
2.3.1 Некоторые характеристики тиоциановой кислоты
| Строение | H-N=C=S. |
| Температура плавления (в °C) | -110 |
| Температура разложения (в °C): | -90 |
| Показатель диссоциации | pKa (1) = 0,85 (180 C) |
| ΔH0возг,298, кДж/моль | 104,6 |
| S0298, Дж/(К*моль) | 247,36 |
| Cp,298,Дж/(К*моль) | 48,16 |
В интервале от -90 С до -85 С HNCS полимеризуется в бесцветную кристаллическую массу. При остарожном нагревании в вакууме образуется бледно-желтая, растворимая в эфирах родануровая кислота (HNCS). Если тиоциановую кислоту нагреть до комнатной температуры при обычном давлении на воздухе или в вакууме, то вещество медленно окрашивается в темно-красный цвет. При температуре около +30 С происходит быстрое превращение со значительным выделением тепла и вспенивание.
Водные растворы тиоциановой кислоты устойчивы только при концентрации до 5% (в растворе по свойствам схожа с хлористоводородной кислотой), в более концентрированных растворах она разлагается с образованием, так называемого ксантогенового водорода и других продуктов.
Восстанавливается HNCS цинком в соляной кислоте до метиламина и 1,3,5-тритиана. Окисляется тиоциановая кислота KMnO4 и H2O2 - до HCN, Br2 - до BrCN. Мягкое окисление приводит к родану (SCN)2. А сероводородом разлагается до сероуглерода и аммиака.
HSCN + 3H2O2 = HCN + H2SO4 + 2H2O
2.3.2. Получение HNCS
Тиоциановую кислоту получают из роданидов, например:
KSCN + KHSO4 = K2SO4 + HNCS
Безводную тиоциановую кислоту получают при нагревании роданида свинца (ртути) в токе сероводорода:
Pb(SCN)2 + H2S = PbS + 2HSCN
2.3.3. Применение роданистоводородной кислоты
Практическое применение находят только производные тиоциановой кислоты, например роданиды (неорганические тиоцианаты), а также сложные эфиры (органические тиоцианаты), используемые как инсектициды и фунгициды.[1]
2.4. Тиоцианаты неорганические
Тиоцианаты неорганические (неорганические роданиды (название от греческого rhodon - роза, по ярко-красной окраске тиоцианата железа Fe(SCN)3) или сульфоцианиды), соли не выделенной тиоциановой кислоты (тиоциановая кислота (роданисто-водородная кислота) HNCS - желтоватая жидкость с температурой плавления -110°С; длины связей (нм) 0,09887 (H—N), 0,21164 (N—С) и 0,15605 (С—S), угол HNC 134,98°). Кристаллические вещества растворимые в воде, спирте, эфирах и ацетоне.
2.4.1. Общие характеристики некоторых тиоцианатов
| Соединения | Тпл,0С | Ткип, 0С | Плотность, г/см3 | Растворимость в воде, г/ см3 |
| NH4NCS | 146,6 | 170* | 1,3057 | 120 (при 0 0С) |
| KNCS | 172,3 | 500* | 1,886 | 217 (при 20 0С) |
| NaNCS | 287 | 300* | 1,73 | 166 (при 25 0С) |
| CuSCN | 1084 | - | 2,85 | 5∙10-4(при 18 0С) |
| Ca(SCN)2*3H2O | разл. | - | - | 150 (при 0 0С) |
| Pb(SCN)2 | 195* | - | 3,82 | 0,05 (при 20 0С) |
* - с разложением. [7]
Тиоцианат аммония (NH4NCS) - водорастворимые бесцветные кристаллы, расплывающиеся на воздухе, на свету и на воздухе приобретают красную окраску, при нагревании разлагаются.
Тиоцианат натрия (NaNСS) – бесцветные гигроскопические кристаллы с ромбической решоткой. Ядовит.
Тиоцианат калия (KSCN) – водорастворимый белый порошок, при плавлении приобретает синеватый оттенок, а при остывании снова становится белым.
Тиоцианат одновалентной меди (CuSCN) - беловатый, сероватый или желтоватый порошок или паста не растворимый в воде.
Тиоцианат двухвалентной меди (Cu(SCN)2) - черный порошок, не растворимый в воде, легко превращается в тиоцианат одновалентной меди.
Тиоцианат кальция (Ca(SCN)2*3H2O). Бесцветные кристаллы, расплывающиеся на воздухе и растворимые в воде.[8]
Наличие в тиоцианатном ионе атомов серы и азота, находящихся в промежуточных степенях окисления, обуславливает его способность проявлять как окислительную, так и восстановительную активность в химических реакциях:
2KNCS + I2 = KI + (SCN)2 (ок-ные свойства)
KNCS + 10KOH + 8KMnO4 = KOCN + 8K2MnO4 + K2SO4 + 5H2O (вост-ные свойства)
В водных растворах все тиоцианаты окисляются О2 до сульфатов, взаимодействуют с Сl2 иBr2 с образованием циангалогенидов, восстанавливают Fe до цианидов металлов.
Получают тиоцианаты из цианатов металлов и S, обменной реакцией сульфатов или нитратов металлов с тиоцианатами Ba или Na, взаимодействием гидроксидов или карбонатов металлов с HCN. Наиболее характерны реакции - окисление, восстановление, галогенирование, а также обменные реакции с другими тиоцианатами. Например:
3NH4NCSк + 2Н2O = H2C2N2S3 + 2(NH3*H2O) + NH4CN
2NH4NCSр + I2 = 2NH4I + (SCN)2
KNCS + Fe = KCN + FeS
2KNCS + Pb(NO3)2 = Pb(SCN)2 + 2KNO3
Тиоцианаты щелочных металлов и аммония разлагаются при нагревании, например:
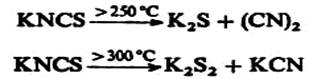
Термическая изомеризация NH4NCS положена в основу промышленного получения тиомочевины:
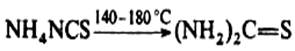
Токсичность тиоцианатов сравнительно невелика (например: KNCS раздражает кожу, при длительном воздействии угнетает щитовидную железу, поражает почки; NH4NCS вызывает явление ксантопсии, т. е. видение предметов в желтом цвете). Токсичность других тиоцианатов, например Pb(SCN)2 или Hg(SCN)2, во многом определяется физиологическим воздействием входящих в них металлов. Тиоциановая кислота содержится в соке лука Allium соера и в корнях других растений. Тиоцианаты в небольших количествах найдены в слюне и в желудочном соке животных. В слюне человека содержится в среднем 0,01% SCN-, в крови около 1,3 мг в 100 мл в виде KNCS.
Похожие работы
... вплоть до состояния sp3. Однако получить макроскопическое количество кристаллического нитрида углерода до настоящего времени таким способом не удавалось [3]. Сложность термобарического синтеза кристаллического нитрида углерода заключается в том, что неизвестна область его термодинамической стабильности. Иными словами неизвестно, насколько велики должны быть давление и температура синтеза для ...
... , а затем строят калибровочный график, с помощью которого выполняют расчеты. Спектрофотометрия в УФ- и видимой областях — один из наиболее широко используемых физико-химических методов в фармацевтическом анализе. Анализируемые ЛВ должны иметь в структуре молекулы хромофорные группы (сопряженные связи, ароматическое ядро и др.), обусловливающие различные электронные переходы в молекулах и ...
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...
... , основанной на поглощении атомами рентгеновского излучения. Ультрафиолетовая спектрофотометрия — наиболее простой и широко применяемый в фармации абсорбционный метод анализа. Его используют на всех этапах фармацевтического анализа лекарственных препаратов (испытания подлинности, чистоты, количественное определение). Разработано большое число способов качественного и количественного анализа ...

0 комментариев