Навигация
Статистическая термодинамика
Термодинамическая система, коллектив и его состояния. Метод ансамблей. Энтропия и вероятность. Канонический ансамбль Гиббса. Каноническое распределение. Фактор Гиббса. Вероятности, свободная энергия и статистическая сумма.
Система и подсистемы. Общие свойства статистических сумм. Статистическая сумма пробной частицы и коллектива.
Идеальный газ. Распределение Больцмана. Фактор Больцмана. Квантовые состояния и дискретные уровни простых молекулярных движений. Статистический вес уровня (вырожденность). Суммы по уровням и суммы по состояниям.
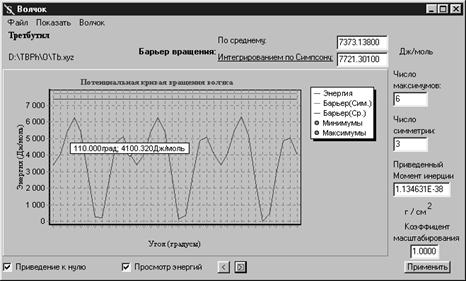
Системы локализованные и делокализованные. Трансляционная сумма состояний, неразличимость частиц, стандартный объём. Вращательная сумма по уровням двухатомной молекулы, ориентационная неразличимость и число симметрии. Статистические суммы для одной и нескольких вращательных степеней свободы. Колебательная статистическая сумма в гармоническом приближении. Коррекция статистических сумм простых движений. Нулевой уровень колебаний, шкала молекулярной энергии, и молекулярная сумма состояний.
Свободная энергия A и статистические формулы для термодинамических функций: энтропия S, давление p, внутренняя энергия U, энтальпия H, энергия Гиббса G, химический потенциал m. Химическая реакция и константа равновесия Kp в системе идеальных газов.
1. Введение. Краткое напоминание основных сведений из термодинамики.
…Удобно термодинамические аргументы и определённые с их помощью функции состояния представить в виде единого массива взаимосвязанных переменных. Этот способ был предложен Гиббсом. Так, скажем, энтропия, которая по определению есть функция состояния, перемещается в разряд одной из двух естественных калорических переменных, дополняя в этом своём качестве температуру. И если в любых калорических процессах температура выглядит как интенсивная (силовая) переменная, то энтропия обретает статус экстенсивной переменной – тепловой координаты.
Этот массив всегда можно дополнить новыми функциями состояния или по необходимости уравнениями состояния, связывающими между собою аргументы. Число аргументов, минимально необходимое для исчерпывающего термодинамического описания системы, называется числом степеней свободы. Оно определяется из фундаментальных соображений термодинамики и может быть уменьшено благодаря различным уравнениям связи.
В таком едином массиве можно менять ролями аргументы и функции состояния. Этот приём широко используется в математике при построении обратных и неявных функций. Цель подобных логических и математических приёмов (достаточно тонких) одна – достижение максимальной компактности и стройности теоретической схемы.
2. Характеристические функции. Дифференциальные уравнения Массье.
Массив переменных p, V, T удобно дополнить функцией состояния S. Между ними имеется два уравнения связи. Одно из них выражено в виде постулируемой взаимозависимости переменных f(p,V,T) =0. Говоря об "уравнении состояния", чаще всего именно эту зависимость имеют в виду. Однако любой функции состояния отвечает новое уравнение состояния. Энтропия по определению есть функция состояния, т.е. S=S(p,V,T). Стало быть, между четырьмя переменными существует две связи, и в качестве независимых термодинамических аргументов можно выделить всего два, т.е. для исчерпывающего термодинамического описания системы достаточно лишь двух степеней свободы. Если этот массив переменных дополнить новой функцией состояния, то наряду с новой переменной появляется и ещё одно уравнение связи, и, стало быть, число степеней свободы не увеличится.
Исторически первой из функций состояния была внутренняя энергия. Поэтому с её участием можно сформировать исходный массив переменных:
p, V, T, S, U
Массив уравнений связи в таком случае содержит функции вида
f(p,V,T) =0, 2) U=U(p,V,T), 3) S=S(p,V,T).
Эти величины можно менять ролями или формировать из них новые функции состояния, но в любом случае суть дела не изменится, и останутся две независимые переменные. Теоретическая схема не выйдет за пределы двух степеней свободы до тех пор, пока не встанет необходимость учесть новые физические эффекты и связанные с ними новые превращения энергии, и их окажется невозможно охарактеризовать без расширения круга аргументов и числа функций состояния. Тогда может измениться и число степеней свободы.

![]()
 (2.1)
(2.1)
3. Свободная энергия (энергия Гельмгольца) и её роль.
Состояние изотермической системы с неизменным объёмом целесообразно описывать посредством свободной энергии (функции Гельмгольца). В этих условиях она является характеристической функцией и изохорно-изотермическим потенциалом системы.
Посредством частного дифференцирования из неё далее можно извлечь прочие необходимые термодинамические характеристики, а именно:
![]() (3.1)
(3.1)
Построить явный вид функции свободной энергии для некоторых относительно простых систем можно методом статистической термодинамики.
Похожие работы
... значения энтропии при различных температурах рассчитаны без учета вклада на смешение конформеров. Для сравнения в табл. 2.11 приведены значения энтропии 2,2,4-триметилпентана, рекомендованные [1]. Ошибка расчета по методу статистической термодинамики возрастает с увеличением температуры от 298 до 600 К с -0,04 до -0,14 % отн. Зависимость от температуры для состояния идеального газа представлена ...
... 1292/(2.016´256)] 3/2´ [43.12/(4.597´7430)] ´(2´2/12) =0.031´18.136´4=183.1´0.0544´4=39.84. Колебательные статистические суммы [q0(HI)] –2 @ 1. [q0(H2)] @1. [q0(I2)] =2.80. Электронный сомножитель: exp(-DU0o/RT) = exp(1.676) = 5.348 Константа равновесия равна: K=5.348´39.84/2.80=76.1. Резюме: Простота приближений и пренебрежение ...
... большой материал, предусмотренный программой. Преимущество такого подхода к рассмотрению отдельных, или группы, вопросов, как показали наши наблюдения, не вызывает сомнений как с точки зрения корректности математических выражений, так и логичности и взаимосвязи явлений термодинамики. СОСТАВЛЕНИЕ ДЕТЕРМИНАНТОВ ЯКОБИ И ТАБЛИЦЫ ТЕРМОДИНАМИЧЕСКИХ КОЭФФИЦИЕНТОВ ДЛЯ СИСТЕМ, ОПИСЫВАЕМЫХ БОЛЬШИМ ...
... впервые получены следующие результаты: · Разработана обобщенная координационно-кластерная модель для описания взаимодействий и расчета термодинамических характеристик раствора неметалла в расплаве из трех металлических компонентов. · Установлена связь между термодинамическими свойствами (коэффициентами термодинамической активности и параметрами взаимодействия компонентов первого порядка) и ...
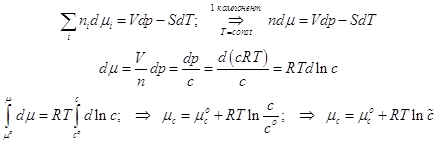
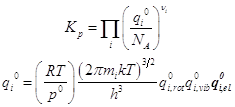
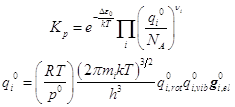
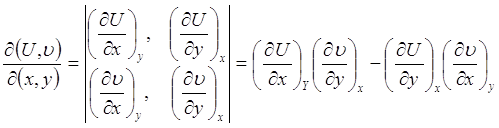
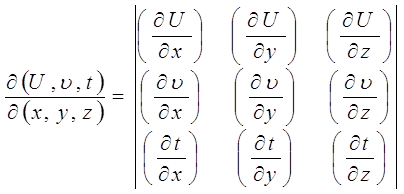
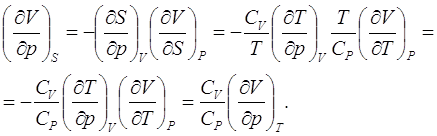
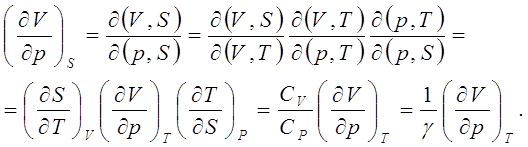
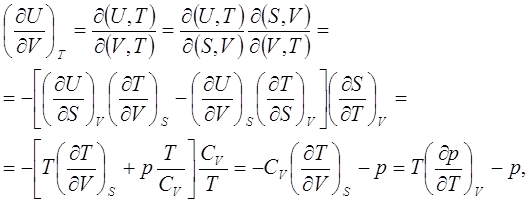



0 комментариев