Навигация
Произведение растворимости
2.7 Произведение растворимости.
При растворении твердого тела в воде растворение прекращается, когда получается насыщенный раствор, т. е. когда между растворяемым веществом и находящимися в растворе молекулами того же вещества установится равновесие. При растворении электролита, например, соли, в раствор переходят не молекулы, а ионы; следовательно, и равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами. Например, в насыщенном растворе сульфата кальция устанавливается равновесие твердая ионы в соль растворе
CaSO4 ↔Са2+ + SO42-
Константа равновесия для этого процесса выразится уравнением:
К = [Са2+] [SO42-]
[CaSO4]
Знаменатель дроби — концентрация твердой соли — представляет собою постоянную величину, которую можно ввести в константу.
Тогда, обозначая
К = [CaSO4] = К’
получим
[Са2+] [SO42-] = К’
Таким образом, в насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Эта величина количественно характеризует способность электролита растворяться; ее называют произведением растворимости электролита и обозначают буквами ПР.
Заменив величину К’ на ПРCaSO4, получим:
ПРCaSO4 = [Са2+] [SO42-]
Численное значение произведения растворимости электролита нетрудно найти, зная его растворимость. Например, растворимость сульфата кальция при 20°С равна 1,5∙10-2 моль/л. Это значит, что в насыщенном растворе концентрация каждого из ионов Са2+ и SO42- равна 1,5∙10-2 моль/л.
Следовательно, произведение растворимости этой соли
ПРCaSO4 = [Са2+] [SO42-] = (1,5∙10-2)2 = 2,25∙10-4
В тех случаях, когда электролит содержит два или несколько одинаковых ионов, концентрации этих ионов при вычислении произведения растворимости должны быть возведены в соответствующие степени. Например:
ПРРbCl2 = [Pb2+] [I-]2
Знание произведения растворимости позволяет решать вопросы, связанные с образованием или растворением осадков при химических реакциях, что особенно важно для аналитической химии. Надо, однако, иметь в виду, что произведение растворимости, вычисленное без учета коэффициентов активности, является постоянной величиной только для малорастворимых электролитов и при условии, что концентрации других находящихся в растворе ионов невелики. Это объясняется тем, что коэффициенты активности близки к единице только в очень разбавленных растворах. Для хорошо растворимых электролитов значение произведения концентраций ионов в насыщенном растворе может сильно изменяться в присутствии других веществ. Это происходит вследствие изменения коэффициентов активности ионов. Поэтому расчеты, производимые по произведению растворимости без учета коэффициентов активности, приводят в этих случаях к неверным результатам.
В табл.3 приведены величины произведения растворимости некоторых малорастворимых соединений в воде.
Таблица 3.
Произведение растворимости некоторых веществ при 25°С
| Соединение | Произведение растворимости | Соединение | Произведение растворимости |
| AgCl AgBr AgI Cu(OH)2 Zn(OH)2 BaSO4 CaSO4 | 1,8∙10-10 6∙10-13 1∙10-16 2,2∙10-20 1∙10-17 1,1∙10-10 1,3∙10-4 | CaCO3 CuS Cu2S FeS HgS MnS ZnS | 5∙10-9 6∙10-36 1∙10-48 5∙10-18 10-52 2,5∙10-10 10-23 |
2.8.Диссоциация воды. Водородный показатель
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электропроводностью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы:
Н2О ↔ Н+ + ОН-
По величине электропроводности чистой воды можно вычислить концентрацию ионов водорода и гидроксид-ионов в воде. При 25°С она равна 10-7моль/л.
Напишем выражение для константы диссоциации воды:
К = [Н+] [ОН-]
[Н2О]
Перепишем это уравнение следующим образом:
[Н+] [ОН-] = [Н2О] К
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул Н2О в воде практически равна общей концентрации воды, т. е. 55,55 моль/л (1 л содержит 1000 г, воды, т. е.
100:18,02 = 55,55 молей). В разбавленных водных растворах концентрацию воды можно считать такой же. Поэтому, заменив в последнем уравнении произведение [Н2О] К новой константой КН2О, будем иметь:
[Н+] [ОН-] = КН2О
Полученное уравнение показывает, что для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Эта постоянная величина называется ионным произведением воды. Численное значение ее нетрудно получить, подставив в последнее уравнение концентрации ионов водорода и гидроксид-ионов. В чистой воде при 25°С [Н+] [ОН-] = 1∙10-7моль/л. Поэтому для указанной температуры:
КН2О = 10-7∙10-7 = 10-14
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. При 25 °С, как уже сказано, в нейтральных растворах концентрация как ионов водорода, так и гидроксид-ионов равна10-7 моль/л. В кислых растворах больше концентрация ионов водорода, в щелочных— концентрация гидроксид-ионов. Но какова бы ни была реакция раствора, произведение концентраций ионов водорода и гидроксид-ионов остается постоянным.
Если например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода повысилась до 10-3 моль/л, то концентрация гидроксид-ионов понизится так, что произведение [Н+] [ОН-] останется равным 10-14. Следовательно, в этом растворе концентрация гидроксид-ионов будет:
[ОН-] = 10-14/10-3 = 10-11моль/л
Наоборот, если добавить к воде щелочи и тем повысить концентрацию гидроксид-ионов, например, до 10-5моль/л, то концентрация ионов водорода составит:
[Н+] = 10-14/10-5 = 10-9моль/л
Эти примеры показывают, что если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому как степень кислотности, так и степень щелочности раствора можно количественно охарактеризовать концентрацией ионов водорода:
Нейтральный раствор [Н+] = 10-7моль/л
Кислый [Н+] > 10-7моль/л
Щелочной [Н+] <10-7моль/л
Кислотность или щелочность раствора можно выразить другим, более удобным способом: вместо концентрации ионов водорода указывают ее десятичный логарифм, взятый с обратным знаком. Последняя величина называется водородным показателем и обозначается через рН:
рН = -lg[Н+]
Например, если [Н+]= 10-5моль/л, то рН = 5; если [Н+]= 10-9моль/л, то рН = 9 и т. д. Отсюда ясно, что в нейтральном растворе ([Н+]= 10-7моль/л) рН = 7. В кислых растворах рН < 7, и тем меньше, чем кислее раствор. Наоборот, в щелочных растворах рН >7, и тем больше, чем больше щелочность раствора.
Для измерения рН существуют различные методы. Приближенно реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространенные индикаторы — метиловый оранжевый, метиловый красный, фенолфталеин. В табл.4 дана характеристика некоторых индикаторов.
Таблица 4. Важнейшие индикаторы
| Название индикатора | Цвет индикатора в различных средах | ||
| в кислой | в нейтральной | в щелочной | |
| Метиловый оранжевый Метиловый красный Фенолфталеин Лакмус | Красный (рН < 3,1) Красный (рН < 4,2) Бесцветный (рН < 8,0) Красный (рН < 5) | Оранжевый (3,1 < рН < 4,4) Оранжевый (4,2 < рН < 6,3) Бледно-малинов. (8,0 < рН < 9,8) Фиолетовый (5 < рН < 8) | Желтый (рН > 4,4) Желтый (рН > 6,3) Малинов. (рН > 9,8) Синий (рН > 8) |
Для многих процессов величина рН имеет большое значение. Так, рН крови человека и животных имеет строго постоянное значение. Растения могут нормально произрастать лишь при значениях рН почвенного раствора, лежащих в определенном интервале, характерном для данного вида растения. Свойства природных вод, в частности их коррозионная активность, сильно зависят от их рН.
Похожие работы
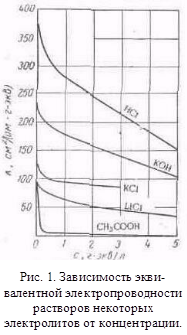
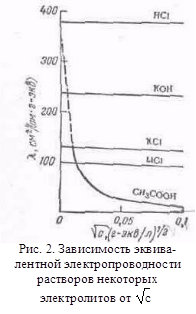
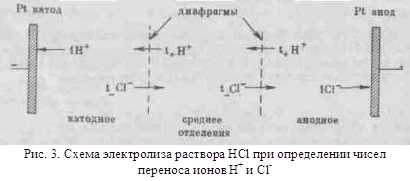
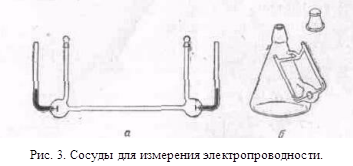
... с другими растворителями рассмотренные закономерности сохраняются, но имеются и отступления от них, например на кривых λ-с часто наблюдается минимум (аномальная электропроводность). 2. Подвижность ионов Свяжем электропроводность электролита со скоростью движения его ионов в электрическом поле. Для вычисления электропроводности достаточно подсчитать число ионов, ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... при изучении синтеза новых материалов и процессов ионного транспорта в них. В чистом виде такие закономерности наиболее четко прослеживаются при исследовании монокристаллических твердых электролитов. В то же время при использовании твердых электролитов в качестве рабочих сред функциональных элементов необходимо учитывать, что нужны материалы заданного вида и формы, например в виде плотной керамики ...
... 17-25 кг/т алюминия, что на ~ 10-15 кг/т выше по сравнению с результатами для песчаного глинозёма. В глинозёме, используемом для производства алюминия, должно содержаться минимальное количество соединений железа, кремния, тяжелых металлов с меньшим потенциалом выделения на катоде, чем алюминий, т.к. они легко восстанавливаются и переходят в катодный алюминий. Нежелательно также присутствие в ...





0 комментариев