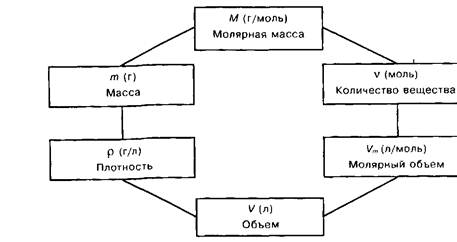
Навигация
Номенклатура кристаллогидратов
1.3 Номенклатура кристаллогидратов
Для кристаллогидратов как и для всех химических соединений существуют правила названий. Название кристаллогидрата строится из систематического названия соли и указывается количество молекул кристаллизационной воды входящих в формальную единицу. Рассмотрим конкретные примеры.
CuSO4· 5H2O – пентагидрат сульфата меди;
Na2CO3· 10H2O – декагидрат карбоната натрия;
AlCl3· 6H2O – гексагидрат хлорида алюминия.
Следует отметить, что содержание воды в кристаллогидратах формально может иметь и нецелочисленное значение, поэтому в таких случаях поступают следующим образом: CdSO4 · 2,67 H2O - 2,67- гидрат сульфата кадмия, SO2 ·n H2O – полигидрат диоксида серы. Однако рассмотренный способ названия кристаллогидратов довольно упрощенный. Если нам известна структура образуемого соединения, то мы можем его назвать более конкретно, при этом указав в какой форме вода находится в данном соединении и с какими ионами она связанна. Исследование строения кристаллов CuSO4· 5H2O показало, что в его формульной единице четыре молекулы воды связаны с атомом меди, а пятая – с сульфатными ионами. Таким образом, формула этого вещества – [Cu(H2O)4]SO4· H2O, имеет называние моногидрат сульфата тетрааквамеди (II).
Аналогичное строение имеет соединение [Fe(H2O)6]SO4· H2O – моногидрат сульфата гексаакважелеза(II).
Другие примеры:
[Ca(H2O)6]Cl2 – хлорид гексааквакальция;
[Mg(H2O)6]Cl2 – хлорид гексааквамагния.
Однако часто нам не нужно применять систематическую номенклатуру, а можно воспользоваться тривиальными названиями веществ. Так CuSO4 · 5H2O – медный купорос, Na2CO3· 10H2O – «кристаллическая» сода и т.д. [2], [26].
1.4 Классификация
Классификацию кристаллогидратов можно вести по различным критериям:
1. По наличию связи структуры безводного вещества и кристаллогидрата
· фазы определенного состава - вид кристаллогидратов, у которых при удалении кристаллизационной воды происходит сжатие кристаллической решетки, поэтому структура безводного вещества и кристаллогидрата не связанны между собой. К данному классу относятся кристаллогидраты многоосновных кислот, оснований и клатратов.
· неопределенного состава – вид кристаллогидратов, у которых процесс удаления воды может быть осуществлен без существенных изменений в кристалле. Это возможно при наличии в кристалле достаточного количества свободных промежутков, каналов (чтобы уместились молекулы воды). У веществ этого класса может происходить обратимая гидратация и дегидратация. Примерами таких веществ являются цеолиты [32].
2. По количеству молекул воды входящих в формульную единицу кристаллогидрата
· Существует кристаллогидраты, в которых на одну молекулу или частицу гидратированного вещества приходится 1,2,3,4,5,6,7,8,9,10,12 молекул воды.
· Но наиболее распространенными являются кристаллогидраты с 1,2,4,6,8 молекулами воды.
· Для многих веществ известны кристаллогидраты различного состава.
- MgCl2∙ nH2O где n= 2,4,6,8,12.
- CaCl2∙ nH2O где n= 1,2,4,6,8.
- NaOH∙ nH2O где n=1,2,3,4,6,8.
- H2SO4∙ nH2O где n= 1,2,4,6,8.
3. По природе соединения участвующего в образовании кристаллогидратов
![]() Органическое
Органическое
![]() Неорганическое
Неорганическое
3. По агрегатному состоянию гидратообразователя при н.у.
![]() Твердое (соли)
Твердое (соли)
![]() Газ (предельные у/в, С12, Н2 S, Аг, Хе, SО2)
Газ (предельные у/в, С12, Н2 S, Аг, Хе, SО2)
![]() Жидкость (серная кислота, этиловый спирт)
Жидкость (серная кислота, этиловый спирт)
5. Класс соединений
![]() Кислоты (H2SO4.H2O)
Кислоты (H2SO4.H2O)
![]() Основания (NaOH.H2O)
Основания (NaOH.H2O)
![]() Соли (ZnSO4·7H2O,MnSO4·7H2O)
Соли (ZnSO4·7H2O,MnSO4·7H2O)
6. Температурная устойчивость
· Если кристаллизационная вода удерживается Ван-дер-Ваальсовыми силами, то такие вещества стабильны при температурах ниже нуля (клатраты)
· Если кристаллизационная вода удерживается в кристаллогидрате слабыми межмолекулярными связями, то она легко удаляется при нагревании:
Na2CO3· 10H2O = Na2CO3 + 10H2O (при 120 ° С);
K2SO3· 2H2O = K2SO3 + 2H2O (при 200 ° С);
· Если же в кристаллогидрате связи между молекулами воды и другими частицами близки к химическим, то такой кристаллогидрат или дегидратируется (теряет воду) при более высокой температуре, например:
Al2(SO4)3 ·18H2O = Al2(SO4)3 + 18H2O (при 420 ° С);
СoSO4 ·7H2O = CoSO4 + 7H2O (при 250 ° С);
или при нагревании разлагается с образованием других химических веществ, например:
2{FeCl3· 6H2O} = Fe2O3 + 6HCl + 9H2O (выше 250 ° С);
2{AlCl3· 6H2O} = Al2O3 + 6HCl + 9H2O (200 – 450 ° С) [14].
Похожие работы
... ходом процесса. Через 3 минуты внесите в одну из пробирок раствор хлорида натрия. Что вы наблюдаете? Проведите анализ опытов а) и б). Глава 2. Методика изучения растворов. Теория растворов – одна из ведущих теорий курса химии. Причины важности темы кроется не только в том, что она имеет большое практическое значение, но и прежде всего ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
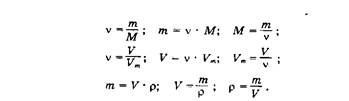






0 комментариев