Навигация
По состоянию воды в гидратах
7. По состоянию воды в гидратах
· Псевдогидраты - это соединения, в которых часть молекул кристаллизационной воды образуют гидроксид ионы или ионы гидроксония (HClO4·H2O = H3O·ClO4 , Sr(BO2)2·4H2O = Sr[B(OH)4]2) Воду, входящую в состав псевдогидратов называют конституционной [39].
![]() молекулы воды изолированы друг от друга. Атомы кислорода в воде координируются вокруг центрального иона: CuCl2∙ 2H2O, CoCl2∙2H2O (Приложение 2, Рис 3).
молекулы воды изолированы друг от друга. Атомы кислорода в воде координируются вокруг центрального иона: CuCl2∙ 2H2O, CoCl2∙2H2O (Приложение 2, Рис 3).
![]() Внутрисферные кристаллогидраты – молекулы кристаллизационной воды удерживаются благодаря ковалентной связи с катионом [Al(H2O)6 ]Cl3, [Mg(H2O)6]Cl2 (Приложение 2, Рис 1).
Внутрисферные кристаллогидраты – молекулы кристаллизационной воды удерживаются благодаря ковалентной связи с катионом [Al(H2O)6 ]Cl3, [Mg(H2O)6]Cl2 (Приложение 2, Рис 1).
![]() Смешанные кристаллогидраты – кристаллизационная вода удерживается за счет образования водородных связей и донорноакцепторного взаимодействия. К данной группе можно отнести купоросы (CuSO4·5H2O или [Cu(H2O)4]SO4·H2O), пятая молекула воды связывается именно водородными связями (Приложение2, Рис 2) [2].
Смешанные кристаллогидраты – кристаллизационная вода удерживается за счет образования водородных связей и донорноакцепторного взаимодействия. К данной группе можно отнести купоросы (CuSO4·5H2O или [Cu(H2O)4]SO4·H2O), пятая молекула воды связывается именно водородными связями (Приложение2, Рис 2) [2].
![]() молекулы воды образуют цепи. В ряде случаев молекулы воды связывают два катиона Zn(OH)H2O и BaCl2∙ H2O. Образуются бесконечные цепи.
молекулы воды образуют цепи. В ряде случаев молекулы воды связывают два катиона Zn(OH)H2O и BaCl2∙ H2O. Образуются бесконечные цепи.
![]() Молекулы воды образует слои, объединяемые ионами соли (CaSO4·2H2O). В соединении Mg2(OH)2(H2O)3CO3 в каналах структуры.
Молекулы воды образует слои, объединяемые ионами соли (CaSO4·2H2O). В соединении Mg2(OH)2(H2O)3CO3 в каналах структуры.
![]() Своеобразными упорядоченными твердыми растворами внедрения типа соль — лед являются некоторые кристаллогидраты с большим числом молекул воды, например Na2SO4·10Н2О, Na2СO3·10Н2О (тектогидраты). Они имеют структуру льда, которая стабилизируется за счет стягивающего действия электростатически взаимодействующих ионов противоположного знака. Вследствие этого температура плавления тектогидратов намного превышает температуру плавления льда [2].
Своеобразными упорядоченными твердыми растворами внедрения типа соль — лед являются некоторые кристаллогидраты с большим числом молекул воды, например Na2SO4·10Н2О, Na2СO3·10Н2О (тектогидраты). Они имеют структуру льда, которая стабилизируется за счет стягивающего действия электростатически взаимодействующих ионов противоположного знака. Вследствие этого температура плавления тектогидратов намного превышает температуру плавления льда [2].
1.5 Значение кристаллогидратов
Образование и разрушение газовых клатратов используются, для разделения газов опреснения морской воды. Клатраты в природе часто играют роль естественного хранилища газов. Кристаллогидраты занимают важное место в строительстве в процессах схватывания и твердения вяжущих. В растительных клетках часто встречаются кристаллы оксалата кальция. Кристаллы представлены в основном моно(CaC2O4∙H2O) и дигидратами (CaC2O4∙2H2O). Первые кристаллизуются в клиноромбической системе, вторые в гексагональной. Они откладываются только в вакуолях. Форма кристаллов оксалата кальция довольно разнообразна и часто специфична для определенных групп растений. Это могут быть одиночные кристаллы ромбоэдрической, октаэдрической или удлиненной формы (клетки наружных отмерших чешуи луковиц лука), друзы (чешек, druza — группа) — шаровидные образования, состоящие из многих мелких сросшихся кристаллов (клетки корневищ, коры, корки, черешков и эпидермы листьев многих растений), рафиды (греч. рафис — швейная игла) — мелкие игольчатые кристаллы, соединенные в пучки (стебель и листья винограда), и кристаллический песок — скопления множества мелких одиночных кристаллов (паренхимные клетки многих пасленовых бузины). Наиболее часто встречающаяся форма кристаллов — друзы.
Выводы: с момента первоначального изучения кристаллогидратов до настоящего времени в науке накопилось большое количество сведений о таком классе химических соединений, как кристаллогидраты. Школьное химическое образование не должно отставать от достижений, происходящих в научном мире, поэтому целью данной главы является проведение анализа химической литературы и выяснение того, как рассматривается тема кристаллогидраты на современном этапе развития химии. Анализ показал, что по данной теме появилось достаточно много новой информации. Данная тема имеет очень важное значение, как в общенаучном плане, так и прикладном плане. Это дает нам возможность проанализировать содержание данной темы в курсе химии средней школы.
Глава 2. МЕТОДИКА ИЗУЧЕНИЯ КРИСТАЛЛОГИДРАТОВ В КУРСЕ ХИМИИ СРЕДНЕЙ ШКОЛЫ
2.1 Тема «Кристаллогидраты» в стандарте школьного образования
Стандарт среднего (полного) общего образования по химии определяет собой обязательных минимум, который должен изучаться в школе и предусматривает следующее содержание. В отношении кристаллогидратов это может проявиться в рамках:
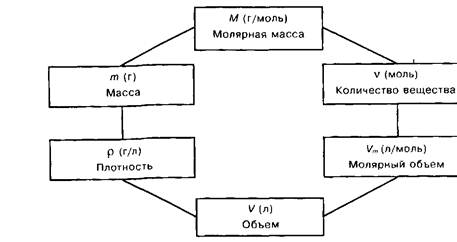
Методы познания веществ и химических явлений: расчеты на массовую долю вещества находящуюся в растворе.
Экспериментальные основы химии: получение кристаллов солей, приготовление растворов.
Химия и жизнь: цемент и другие вяжущие.
Явления проходящих при растворении веществ в воде: разрушение кристаллической решетки, диффузия, диссоциация, гидратация [7].
Похожие работы
... ходом процесса. Через 3 минуты внесите в одну из пробирок раствор хлорида натрия. Что вы наблюдаете? Проведите анализ опытов а) и б). Глава 2. Методика изучения растворов. Теория растворов – одна из ведущих теорий курса химии. Причины важности темы кроется не только в том, что она имеет большое практическое значение, но и прежде всего ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
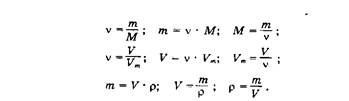






0 комментариев