Навигация
1. Организация класса.
2. Актуализация знаний.
Проверка домашнего задания: решение задачи на определение теплоты гидратации. Спрашиваем учащихся, как называются образующиеся в водном растворе продукты гидратации? Что можно сказать об их устойчивости?
Но как мы уже знаем, существуют так же и продукты гидратации, которые способны сохранять устойчивость при удалении растворителя. Как они называются? Давайте запишем тему урока – кристаллогидраты.
II. Изучение нового материала.
Дайте определение кристаллогидратам?
Как называется вода, содержащаяся в кристаллогидратах (кристаллизационная)?
Дайте классификацию кристаллогидратов по типу кристаллизационной воды (внутрисферные и внешнесферные)? Приведите примеры.
Допишите уравнения реакций и назовите образующиеся продукты:
CuSO4 + 5H2O = ?
CoSO4 + 7H2O = ?
NiSO4 + 7H2O = ?
Как, одним словом можно назвать данные кристаллогидраты?
Как вы думаете, процесс дегидратации любого кристаллогидрата происходит при одинаковой температуре? Давайте рассмотрим конкретные примеры:
1) Кристаллизационная вода удерживается в кристаллогидрате слабыми межмолекулярными связями, то она легко удаляется при нагревании:
Na2CO3· 10H2O = Na2CO3 + 10H2O (при 120 ° С)(частично процесс идет при комнатной температуре);
K2SO3· 2H2O = K2SO3 + 2H2O (при 200 ° С);
CaCl2· 6H2O = CaCl2 + 6H2O (при 250 ° С).
2) Если же в кристаллогидрате связи между молекулами воды и другими частицами близки к химическим, то такой кристаллогидрат или дегидратируется (теряет воду) при более высокой температуре, например:
Al2(SO4)3 ·18H2O = Al2(SO4)3 + 18H2O (при 420 ° С);
3) Существуют кристаллогидраты, из которых удалить воду вообще невозможно без разрушения структуры, например:
2{FeCl3· 6H2O} = Fe2O3 + 6HCl + 9H2O (выше 250 ° С);
2{AlCl3· 6H2O} = Al2O3 + 6HCl + 9H2O (200 – 450 ° С) [2], [6], [14], [39].
Внеклассное мероприятие «Своя игра»
Цели химической викторины:
Образовательная: Еще раз обобщить и проверить знания учащихся по теме кристаллогидраты. Способствовать развитию химической речи и химической грамотности.
Воспитательная: способствовать воспитанию "чувства локтя" и дружбы среди учащихся, воспитывать отношение к химии как к учебному предмету.
Развивающая: продолжать развивать познавательный интерес к предмету химии, способствовать побуждению каждого учащегося к творческому поиску и размышлениям, раскрытию своего творческого потенциала, способствовать развитию кругозора учащихся.
Форма проведения: игра.
Планируемые результаты: после проведения у учащихся должно сформироваться приятное ощущение от игры, так же они должны привести свои знания в систему. Вспомнить основные вопросы, касающиеся состава, строения и свойств кристаллогидратов разных типов.
Правила игры:
В игре принимают участие 3 команды по 5 человек. Задача каждой команды набрать как можно большее количество баллов. Для этого необходимо правильно ответить на вопросы отборочного тура и финальной игры не только правильно ответить, но и сделать большую ставку на свой ответ.
В отборочных турах каждый вопрос имеет свою стоимость, на обдумывание дается одна минута, отвечает та команда, которая быстрее поднимет руку. Если команда ответила правильно, то она выбирает следующий вопрос. На вопрос – аукцион право ответа имеет та команда, которая назначит большую сумму, если на счету игроков сумма, меньшая чем стоимость вопроса, то они могут предложить только номинал (стоимость вопроса). На вопрос кот в мешке отвечает та команда, которой отдает это право команда, выбравшая вопрос.
За каждой командой закреплены по 2 консультанта, они ведут подсчет баллов, если команда отвечает правильно – баллы прибавляются, если неправильно – вычитаются.
Каждый тур – представлен таблицей с 25 вопросами (Приложение 2,Таблица 3).
После того как все вопросы закончатся, то наступает финал. Финал состоит из четырех вопросов. Учащиеся по очереди убирают по одному вопросу. А затем отвечают уже на оставшийся.
Выигрывает та команда, которая набирает больше всего очков.
Ход проведения:
1. Учащимся предлагается разбиться на 3 команды и назвать себя.
2. Далее им предлагается ответить на вопросы отборочного тура, две команды, которые наберут большее число очков, выходят в финал.
3. После ответа на вопрос финала мы определяем победителя по наибольшему числу очков.
1. Что такое кристаллогидраты.
2. Что такое гидраты.
3. Что такое купоросы.
4. Объясните происхождение слова купоросы.
5. Почему серную кислоту раньше называли купоросным маслом.
6. Назовите вещество MgCl2∙6H2O.
7. Назовите области применения вещества состава CaSO4∙0.5H2O.
8. Расскажите, на каких процессах основано «застывание» цемента.
9. Приведите формулы веществ использующихся в качестве вяжущих.
10.Назовите обрасти применения медного купороса.
11.Объясните, почему медный купорос нельзя хранить в железном ведре.
12.Назовите области применения железного купороса.
13.Приведите примеры внешнесферных кристаллогидратов.
14.Что такое кристаллизационная вода.
15.Закончите уравнение реакции и назовите продукты CuSO4 + 5H2O=?
16.Объясните появление окраски, при растворении веществ в воде.
17.Перечислите виды химических связей между атомами в соединении CuSO4∙5H2O.
18.Назовите соединение: [Fe(H2O)6]SO4∙H2O.
19.Приведите примеры образования кристаллогидратов в живых организмах.
20.Что такое цеолиты.
21.Назовите обрасти применения цеолитов.
22.Дайте определение внутрисферным кристаллогидратам.
23.Дайте название веществу состава: Na2CO3∙10H2O.
24.Какое значение имеет образование кристаллогидратов в клетках растений?
25.Назовите области применения кристаллической соды.
Данная игра проводится при помощи проектора или, в крайнем случае, компьютера, вопросы выводятся на экран и учащиеся на них отвечают.
Заключение
1. Нами изучены современные представления о химии кристаллогидратов. Рассмотрена их структура, классификация, свойства. Особое место уделили применению данного класса химических соединений на практике.
2. Проанализировали содержание темы в наиболее распространенных программах и соответствующих учебниках, используемых в нашей области, и в контрольно-измерительные материалы ЕГЭ.
3. Разработки изучения темы в школьном курсе химии мы проводили в следующих направлениях:
- обновление (модернизация) содержания;
- оптимального размещения в курсе;
- рациональной методики на каждом этапе;
- применение кристаллогидратов, изучение их строения и свойств;
4. Предложили конкретные методические рекомендации к изучению данной темы в соответствии с модернизированным содержанием.
5. Проделанная работа была апробирована в период педагогической практики и были получены первичные данные о эффективности разработанной методики.
Библиография
1. Алексинский В.Н. Занимательные опыты по химии. Пособие для учителей. – М.: Просвещение, 1980 г. – 127с., ил.
2. Ахметов Н.С. Общая и неорганическая химия. Учеб. Для вузов. – 4-е изд., испр. – М.: Высш. шк.; 2002. – 743 с. ил.
3. Ахметов Н.С. Химия. Учеб. Для 10-11 кл. общеобразовательных учебных заведений. – М.: Просвещение, 1998. – 256с.: ил.
4. Ахметов Н.С. химия: Учеб. Для 8 класса, Общеобразоват. Учережд. 4-е изд. – М.: Просвещение, 2001. – 192 с.
5. Ахметов Н.С. химия: Учеб. Для 9 класса, Общеобразоват. Учережд. 2-е изд. C испр. – М.: Просвещение, 1999. – 175 с. :ил.
6. Васильев А.Е., Воронин Н.С., Елинеевский А.Г., и др. Морфология и анатомия растений. – 2-е изд. прераб. – М.: Просвещение, 1998. – 480с.ил.
7. Вестник образования под ред. А.В. Киселева 125 с. Ил. – 2004г.
8. Волков В.А., Волконский Е.В., и др. Выдающиеся химики мира: Библиографический справочник. Под ред. В.И. Кузнецова. – М.: Высшая школа., 1991. – 656с., ил
9. Габриелян О.С. Химия 8 класс. Учеб. Для общеобразоват. Учебн. Заведений. – 5-е изд., испр. – М.: Дрофа, 2001. – 208с. :ил.
10. Габриелян О.С. Химия 9 класс. Учеб. Для общеобразоват. Учебн. Заведений. – 10-е изд., перераб. И доп. – М.: Дрофа, 2005. – 267,с. :ил.
11. Габриелян О.С., Лысова Г.Г. Химия. 11 класс: Учеб. Для общеобразоват. Учережд. – М.: Дрофа, 2001. – 368с.: ил
12. Габриелян О.С., Маскаев Ф.Н., Пономарев С.Ю., и др. Химия. 10 класс: Учебник для общеобразоват. Учережд. Под ред. В.И.Теренина, 2-е изд., перераб. и доп. – М.: Дрофа, 2001. – 304с.: ил
13. Гарбусева Н.И., Суматохин С.В. Программы для общеобразовательных учреждений: Химия. 8-11 класс. / Сост. 2-е изд., доп.- М.: Дрофа, 2001. – 288с.
14. Глинка Н.Е. Общая химия: Учебное пособие для вузов/Под ред. А.И. Ермакова. – изд. 30-е исправленное – М.: Интеграл-Пресс, 2004. – 728 с.
15. Гузей Л.С., Суровцева Р.П. 10 класс: Учеб.для. общеобразоват. Учеб. Заведений. – 2-е изд. – М.: Дрофа, 1999. – 240с.: ил:
16. Гузей Л.С., Суровцева Р.П., Лысова Г.Г. Химия 11 класс: Учеб.для. общеобразоват. Учеб. Заведений / . – 3-е изд., стереотипн.. – М.: Дрофа, 2001. – 240с.: ил:
17. Гузей Л.С., Сорокин В.В, Суровцева Р.П. 9 класс: Учеб.для. общеобразоват. Учеб. Заведений / . – 5-е изд., стереотипн.. – М.: Дрофа, 2001. – 288с.: ил:
18. Гузей Л.С., Сорокин В.В., Суровцева Р.П. 8 класс: Учеб.для. общеобразоват. Учеб. Заведений – 4-е изд., испр. – М.: Дрофа, 1999. – 304 с.: ил
19. Единый Государственный экзамен 2001г: тестовые задания; химия/ М.Г.Минин, Н.С. Михайлова, и др.; М-во образования РФ.-2-е изд.-М.: Просвещение. 2002. 47с.:ил
20. Единый Государственный экзамен 2003г: Контрольно-измерительны материалы: Химия/ Каверина А.А., Добротин Д.Ю., Журин А.А. – М.: Интеллект центр, 2003. – 144с.
21. Единый Государственный экзамен 2005-2006г: Контрольно- измерительные материалы: Химия: А.А. Кавериной; М-во образования и науки Российской федерации, Федеральная служба по надзору в сфере образования и науки. – М.: Просвещ., 2006. 93с.:
22. Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: Учебник для 8 класса общеобразовательных учреждений/ 2-е изд., перераб. – М.: Вентанта – Граф, 2005. – 224.: ил.
23. Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: Учебник для 9 класса общеобразовательных учреждений/ 2-е изд., перераб. – М.: Вентанта – Граф, 2005. – 224.: ил
24. Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: Учебник для 11 класса (профильный уровень), часть I. Под редакцией Н.Е. Кузнецовой. – М.: Вентанта – Граф, 2005. – 240с.: ил
25. Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: Учебник для 11 класса (профильный уровень), часть II. Под редакцией Н.Е. Кузнецовой. – М.: Вентанта – Граф, 2005. – 240с.: ил
26. Лидин Р.А. Справочник по общей и неорганической химии. – М.: Просвещение: Учеб. лит. , 1997. – 256с.: ил.
27. Машковский М.Д. Лекарственные средства, т. 2. М., Новая Волна, 2000
28. Меиловский А.В. Минералогия и петрография. 1973г.
29. Орестов И.Л. Электролитическая диссоциация, 1965г.
30. Палищуюк Н.В. Химия в школе 1982г, №2. Из опыта изучения кристаллогидратов.
31. Полосин В.С., Прокопенко В.Г. Практикум по методике обучения химии: Учеб. пособие для пед. институтов по специальности «№2122 химия».-6-е изд., перераб. – М.: Просвещение, 1989. – 244с.:ил
32. Рипан Р., Четяну И. Неорганическая химия, т. 2. М., Мир, 1972
33. Российский химический журнал т. XLVII, №3 (2003г). Газовые гидраты: исторический экскурс, современное состояние, перспективы исследований. Истомин В.А., Кузнецов Ф.А., Родионова Т.В. (с. 24)
34. Российский химический журнал т. XLVII, №3 (2003г). Природные газовые гидраты: распространение, модели образования, ресурсы. Макагон Ю.Ф. (с. 40)
35. Российский химический журнал т. XLVII, №4 (2003г). Гипсовые вяжущие и их применение в строительстве. Коровяков В.Ф. (с 18)
36. Российский химический журнал т. XLVII, №4 (2003г). Разработка многокомпонентных вяжущих веществ. Тарасов С.А., Чистов Ю.Д. (с 12)
37. Степин Б.Д., Аликберова Л.Ю. Занимательные опыты по химии. – М.: дрофа, 2002. – 432с. ил
38. Третьяков Ю.Д., Тамм М.Е. Неорганическая химия Т1. –М.: Изд-ий центр «Академия»; 2004. – 240с.:ил.
39. Химическая энциклопедия. - Т.1 Под ред. – И.Л. Кнунянц., – М.: Советская энциклопедия, 1988 г.
40. Чернобельская Г.М. Методика обучения химии в средней школе: Учеб. для студ. высш. учеб. заведений. – М.: Гуманит. изд. центр ВЛАДОС, 2000. – 336с.
Похожие работы
... ходом процесса. Через 3 минуты внесите в одну из пробирок раствор хлорида натрия. Что вы наблюдаете? Проведите анализ опытов а) и б). Глава 2. Методика изучения растворов. Теория растворов – одна из ведущих теорий курса химии. Причины важности темы кроется не только в том, что она имеет большое практическое значение, но и прежде всего ...
... групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание [1]. 1.1 Межпредметные связи при решении расчетных задач К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
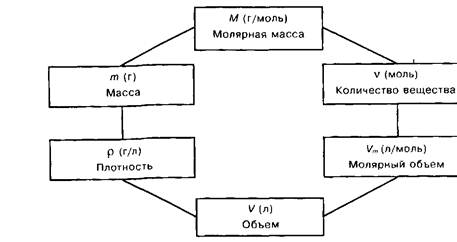
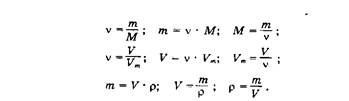






0 комментариев