Навигация
Приготовление питательных сред
2.6 Приготовление питательных сред
Посуда для приготовления сред не должна содержать посторонних веществ, например щелочей, выделяемых некоторыми сортами стекла. Перед употреблением посуду тщательно мыли, полоскали и высушивали. Среды варили в стеклянных колбах объемом 250 мл. Каждой среды готовили объемом по 100 мл, рассчитанной на 5 культур исследуемых штаммов. После варки среды стерилизовали в автоклаве при 0,5 атм и 120 ○С в течение 20 минут. После стерилизации и добавления соответствующих источников углеродного питания среды разливали в стерильные чашки Петри по 20 мл. Предварительно в чашки вносят по 1 капле молочной кислоты для подкисления среды, которое необходимо, чтобы убить бактерии.
2.7 Определение способности плесневых грибов использовать соединения углерода
Микромицеты характеризуются неодинаковой способностью использовать различные соединения углерода для конструктивного и энергетического метаболизма. Чтобы выяснить возможность роста гриба за счет тех или иных углеродсодержащих веществ, их высевают на синтетические среды, содержащие в качестве единственного источника углерода различные моно-, ди- и полисахариды, многоатомные спирты, органические кислоты, углеводороды.
В качестве единственного источника углерода были выбраны природные растительные материалы: растительный опад, камыш, опилки, кора, сено. Источники углерода добавляли в среду в мелко нарезанном виде. Все источники углерода добавлялись в среды количеством 30 г./л.
В данной работе определение особенностей роста грибов на различных источниках углеродного питания проводилось путем поверхностного посева исследуемых штаммов на среду Чапека с различными источниками углерода. Посев культур осуществляли уколом в центр чашки Петри. Время культивирования составляло 14 суток, температура культивирования – 25 ○С. Значение применяемых питательных сред для процессов роста грибов оценивалось методом измерения радиальной скорости роста путем периодического замера диаметра колоний грибов (через каждые 48 часов), растущих на чашках Петри.
Для определения способности микромицетов использовать различные источники углерода применяют и другие методики.
Например, многие микромицеты могут использовать в качестве единственного источника углерода органические кислоты. Для определения способности расти на средах с органическими кислотами рекомендуется плотная среда состава (г/л): (NH4)2HPO4 – 0,5; MgSO4*7H2O – 0,2; NaCl – 0,1; агар – 15,0; органическая кислота в виде соли Na или К – 2,0; pH 6,8. До стерилизации к среде добавляют 20 мл 0,04% водного раствора индикатора метилрот, который в интервале pH 6,8 – 8,4 изменяет окраску от желтой к красной. Среду разливают в пробирки и стерилизуют при 1 атм. Посев проводят уколом. Продолжительность культивирования от 2 до 14 суток в зависимости от скорости роста микроорганизмов. О потреблении органических кислот свидетельствует рост по уколу и изменение кислотности среды в щелочную сторону, что отчетливо заметно по цвету индикатора.
Некоторые грибы способны использовать и такие химически устойчивые соединения, как углеводороды. Выявить способность микроорганизма окислять жидкие нелетучие углеводороды можно на плотной среде состава (г/л): KNO3 – 4,0; KH2PO4 – 0,6; Na2HPO4*12H2O – 1,4; MgSO4*7H2O – 0,8; выщелоченный агар – 2,0; pH 7,2. Среду стерилизуют в колбах при 1 атм. и разливают в чашки Петри толстым слоем. После того как среда застынет, в центре агаровой пластинки вырезают лунку. Для этой цели можно воспользоваться пробочным сверлом (диаметр 8–10 мм), которое предварительно стерилизуют в пламени горелки. Микромицеты высевают радиальными штрихами от лунки к периферии чашки. В лунку вносят 2–3 капли исследуемого углеводорода (стерилизуют фильтрованием). Чашки помещают в термостат строго горизонтально, не переворачивая. Через 7–10 суток отмечают наличие или отсутствие роста по штриху в сравнении с контролем – ростом на среде без углеводорода (Нетрусов, 2005).
2.8 Определение радиальной скорости роста
Определение радиальной скорости роста грибов проводили на плотной питательной среде за определенный промежуток времени. После 48 часов инкубации при 25 ○С измеряют диаметр выросших на чашках колоний при помощи линейки. Эту операцию повторяют через каждые двое суток в течение двух недель.
За диаметр отдельной колонии в данный момент времени принимают среднее арифметическое измерение. Вычисление радиальной скорости проводят по формуле:
Kr= (r – ro) / (t – to),
где k – радиальная скорость роста;
ro – радиус колоний в начальной момент времени to;
r – радиус колоний в момент времени t (Паников, 1991).
2.9 Обработка полученных данных
В процессе культивирования измеряли диаметр колоний каждые 48 ч и определяли радиальную скорость роста, амплитуду ее изменчивости, характер биоритмов.
На основании полученных данных составляли графики зависимости радиальной скорости роста исследуемых штаммов от времени, определяли способность исследуемых штаммов использовать в качестве единственного источника углерода природные растительные материалы (камыш, сено, растительный опад, опилки, кора).
3. Исследование роста микромицетов на различных источниках углеродного питания
Объектами исследования явились коллекционные штаммы микроскоскопических родов Aspergillus flavus, A. fumigatus, Alternaria sp., Penicillium sp., Cladosporium sp., Trichoderma sp., Verticillium sp. В качестве источника углерода использовали природные растительные материалы: камыш, кору, растительный опад, опилки, сено.
В результате посева исследуемых микроскопических грибов на среду Чапека с различными источниками углерода было установлено, что изменение трофических условий оказывает существенное влияние на развитие микромицетов. Оценка возможности потребления различных источников углерода показала, что они способны утилизировать многие источники углеродного питания, но большинство из исследуемых видов не использовали опилки в качестве единственного источника углерода. Динамика роста видов на разных средах при одинаковых условиях инкубации, не одинакова.
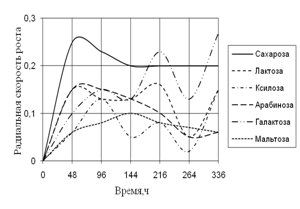
В таблице приложения и на рисунках 1–7 приведены зависимости радиальной скорости роста от времени у изученных грибов на различных источниках углерода.
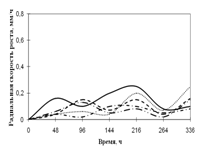
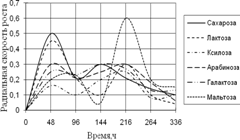
A. fumigatus развивается на всех источниках углерода с высокой скоростью роста, за исключением среды с опилками, на которой совсем не проявляет признаков роста. До 96 ч. экспозиции радиальная скорость роста на всех средах была примерно одинакова, затем на среде с листьями наблюдается скачок роста (в 4 раза по сравнению с другими средами) в интервале 144 – 192 ч. На остальных средах A. fumigatus растет примерно с одинаковой скоростью, но различались ритмичностью биоритмов. На среде с камышом имеет четкие 2-суточные ритмы. Биоритмы большей продолжительности (4-суточные) отмечены на средах с корой и сеном. Однако на среде с корой A. fumigatus обладает несколько большей скоростью роста. К 288 ч. культивирования скорость радиального роста становятся примерно одинаковой на всех средах.
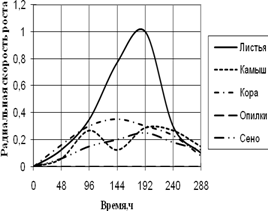
Рис. 1. Радиальная скорость роста A. fumigatus, мм/ч
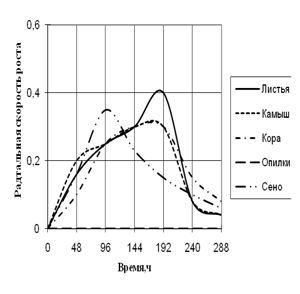
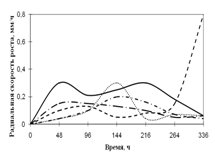
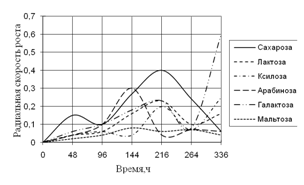
Рис. 2. Радиальная скорость роста A. flavus, мм/ч
Радиальная скорость роста A. flavus на протяжении всей экспозиции значительно не изменялась. Максимальная скорость роста на среде с сеном приходится на 96 ч., на средах с листьями, камышом и корой – на 192 ч. времени культивирования. Также как и A. fumigatus, A. flavus не использует опилки в качестве единственного источника углерода. На средах с листьями и сеном вид растет с 2-суточной периодичностью. Биоритмы большей продолжительности (3,5–4-х суток) наблюдаются на средах с камышом и корой.
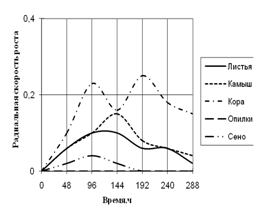
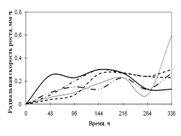
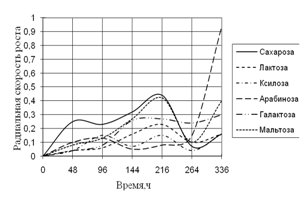
Рис. 3. Радиальная скорость роста Alternaria sp., мм/ч
По данным графика видно, что Alternaria на среде, где в качестве единственного источника углерода присутствует кора, проявляет наибольшую скорость роста с биоритмами 2-ое суток. На среде с сеном Alternaria развивается с очень низкой скоростью и уже к 192 ч. экспозиции прекращает рост. На средах с листьями и камышом растет с одинаковой радиальной скоростью роста до 96 ч. культивирования, затем на среде с камышом происходит скачок примерно в 1,5 раза. На этих средах Alternaria проявляет замедленную ритмичность (более 2-х суток).
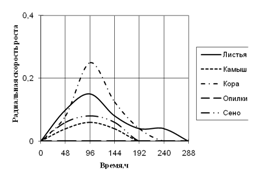
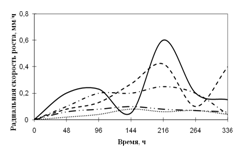
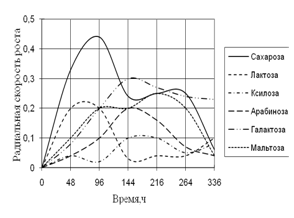
Рис. 4. Радиальная скорость роста Cladosporium sp., мм/ч
Исходя из данных графика 4 видно, что Cladosporium растет на среде с корой с наибольшей скоростью роста и с периодичностью 2-ое суток. К 10-ти суткам культивирования рост на этой среде прекращается. На среде с листьями микромицет растет с меньшей ритмичностью (более 2-суточные биоритмы). С наименьшей радиальной скоростью роста Cladosporium развивается на средах с камышом и сеном с биоритмами четверо суток и прекращает расти к 192 ч. экспозиции. На всех средах рост прекращается еще до 14 дней культивирования.
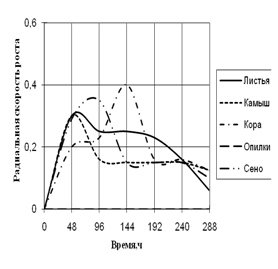
Рис. 5. Радиальная скорость роста Verticillium sp., мм/ч
По данным графика 5 видно, что Verticillium на средах с листьями и камышом в начале культивирования растет с одинаковой скорость роста с 2-суточными биоритмами. С 96 ч. до 192 ч. экспозиции на этих средах происходит задержка роста. На среде с корой микромицет растет с наибольшей скоростью роста с периодичностью в 2-ое суток. Примерно с такой же радиальной скоростью роста Verticillium растет на среде с сеном, но с ритмичностью (более 2-х суток).
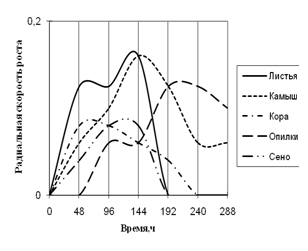
Рис. 6. Радиальная скорость роста Penicillium sp., мм/ч
Из данных графика видно, что Penicillium – единственный из исследуемых штаммов, использующий опилки в качестве единственного источника углерода. Рост начинается с 48 суток культивирования, и развивается на этой среде с более 2-суточной периодичностью. На средах с листьями и камышом микромицет растет с наибольшей радиальной скоростью роста и с 2-суточными биоритмами. К 192 ч. экспозиции на среде с листьями рост прекращается, также как и на среде с сеном. Penicillium с наименьшей скоростью роста растет на средах с корой и сеном с ритмичностью в 2-ое суток.
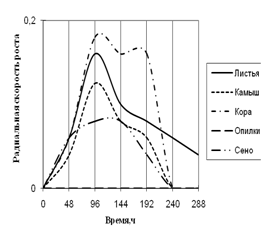
Рис. 7. Радиальная скорость роста Trichoderma sp., мм/ч
Уже на первые сутки культивирования Trichoderma хорошо развивается на всех средах, кроме среды с опилками. На средах с листьями, корой и камышом микромицет растет с 2-суточной периодичностью. С очень низкой скоростью роста и с замедленной ритмичностью (более 2-суточная) Trichoderma растет на среде с сеном. К 240 ч. культивирования рост на всех средах прекращается, за исключением среды с листьями.
Анализируя полученные данные, можно отметить предпочтения исследуемых штаммов к тому или иному источнику углерода. Вид A. fumigatus предпочитает среду с листьями, A. flavus – среды с листьями и сеном, Alternaria, Cladosporium и Trichoderma – среду с корой, Penicillium – среды с листьями, камышом и опилками.
Большинство изученных штаммов обладали 2-суточными биоритмами. Необходимо отметить, что штаммы с наибольшей продолжительностью биоритмов (более чем 2-ое суток) растут с невысокой скоростью роста.
Выводы
1) При определении способности штаммов использовать природные растительные материалы в качестве единственного источника углерода, обнаружено, что наибольшая скорость роста A. fumigatus и A. flavus наблюдается на среде с листьями, Alternaria sp., Cladosporium sp., Verticillium sp. – на среде с корой, Penicillium sp. – на средах с листьями и камышом, Trichoderma sp. – на средах с листьями и корой. Опилки как единственный источник углерода использовал только Penicillium sp. Видимо это объясняется тем, что исследуемые микромицеты были выделены из различных местообитаний.
Список литературы
1) Андреюк, Е.И. Микробная коррозия и ее возбудители [Текст] / Е.И. Андреюк, В.И. Билай, Э.З. Коваль, И.А. Козлова. – Киев: Наук. думка, 1980. – 286 с.; 22 см. – Библиогр.: с. 156. – 200 экз.
2) Бабьева, Е.Н. Сравнительно-экологические исследования микромицетов из почв отдаленных географических районов [Текст] / Е.Н. Бабьева // Микология и фитопатология. Сер. 17. – 1983. – №2. – С. 452–453. – Библиогр.: с. 452–453.
3) Бабьева, И.П. Биология почв [Текст] / И.П. Бабьева, Г.М. Зенова. – Москва: Изд-во московского ун-та, 1989. – 336 с.; 25 см. – Библиогр.: с. 178–179. – 700 экз.
4) Богомолова, Е.В. Морфологические особенности микроколониальных грибов, изолированных с поверхности камня [Текст] / Е.В. Богомолова, М.С. Зеленская, Д.Ю. Власов // Микология и фитопатология. Сер. 35. – 2001. – №3. – С. 6–13. – Библиогр.: с. 17.
5) Билай, В.И. Аспергиллы. Определитель [Текст]: учеб. пособие для вузов / В.И. Билай, Э.З. Коваль: Под ред. В.И. Билай. – Киев: Наукова Думка, 1988. – 203 с.; – Библиогр.: с. 113–117. – 2700 экз.
6) Биоповреждения [Текст] / Под ред. В.Д. Ильичева. – М.: Изд-во Моск. ун-та, 1987. – 352 с.; 24 см. – Библиогр.: с. 207–208. – 200 экз. – ISBN 5–02634–675–3.
7) Градова, И.Б. Лабораторный практикум по общей микробиологии [Текст] / И.Б. Градова. – Москва: Дели принт, 2001. – 237 с.; 25 см. – Библиогр.: с. 145.
8) Долгова, А.В. Рост колоний Penicillium chrysogenum Thom. при постоянных и переменных температурах [Текст] / А.В. Долгова, В.В. Зданович // Микология и фитопатология. Сер. 31. – 1997. – №1. – С. 52–56. – Библиогр.: с. 55.
9) Коваль, Э.З. Микодеструкторы промышленных материалов [Текст] / Э.З. Коваль, Л.П. Сидоренко. – Киев: Наук. думка, 1989. – 192 с.; 22 см. – Библиогр.: с. 135–136. – 300 экз. – ISBN 5–015–02369–7.
10) Лилли, В. Физиология грибов [Текст] / В. Лилли, Г. Барнетт. – Москва: Изд-во иностр. литературы, 1957. – 532 с.; 25 см. – Библиогр.: с. 152, 174–184. – 2000 экз. – ISBN 5–248–00487–4.
11) Марьиновская, Ю.В. Микробиологическая деструкция целлюлозосодержащих отходов [Текст] / Ю.В. Марьиновская, Н.Н. Севастьянова // Микробиология. – 2006. – №3. – С. 75 – 81. – Библиогр.: с. 78.
12) Методическое пособие: «Идентификация плесневых грибов. Гифомицеты»; сост. Еремеева С.В. – Астрахань, 2007. – 76 с.; – Библиогр.: с. 6. –
13) Мирчинк, Т.Г. Почвенная микология [Текст]: учебник / Т.Г. Мирчинк: – М.: Изд-во МГУ, 1988. – 220 с.; 22 см. – Библиогр.: с. 154 -165. – 2940 экз. – ISBN 5–211–00157–5.
14) Мюллер, Э. Микология [Текст] / Э. Мюллер, В. Леффлер; перевод с немецкого канд. биол. наук К.Л. Тарасова. – М.: Мир, 1993. – 535 с.; 25 см. – Библиогр.: с. 90–94. – 2000 экз. – ISBN 5–214–01254–7.
15) Паников, Н.С. Кинетика роста микроорганизмов [Текст] / Н.С. Паников. – М.: Наука, 1991. – 309 с.; 22 см. – Библиогр.: с. 245. – 1500 экз. – ISBN 3–271–00356–5.
16) Практикум по микробиологии [Текст] / Под ред. А.И. Нетрусова. – М.: Академия, 2005. – 608 с.; 28 см. – Библиогр.: с. 239–240. – 5100 экз. – ISBN 5–7695–1809-X.
17) Саттон, Д. Определитель патогенных и условно патогенных грибов: Пер. с англ. [Текст]: учеб. пособие для вузов / О. Саттон, А. Фотергилл, М. Ринальди; под общ. ред. Д.Г. Звягинцев. – М.: Мир, 2001. – 487 с.; 38 см. – Библиогр.: с. 482–486. – 350 экз. – ISBN 5–58974–358–1.
18) Сычугова, О.В. Рост и развитие микромицетов на сополимере этилена и винилацетата с добавками крахмала [Текст] / О.В. Сычугова, Н.Н. Колесникова // Вестн. Моск. ун-та. Сер. 16. Биология. – 2003. – №4. – С. 27–31. – Библиогр.: с. 28.
19) Пидопличко, Н.М. Грибная флора грубых кормов [Текст] / Н.М. Пидопличко. – Киев: Наук. думка, 1953. – 482 с.; 21 см. – Библиогр.: с. 246. – 700 экз.
20) Фомин, В.А. Биоразлагаемые полимеры: состояние и перспективы использования [Текст] / В.А. Фомин, В.В. Гузеев // Пластические массы. – 2001. – №2. – С. 42–46. – Библиогр.: с. 42–43.
21) Шевцова, В.М. Программы развития и возможный принцип их генетического контроля у микромицетов рода Verticillium [Текст] / В.М. Шевцова // Микология и фитопатология. – 1987. – №21. – С. 73–81. – Библиогр.: с. 76.
22) Booth, C. The genus Fusarium [Text] / Commonwealth mycological institute, – Kew. Surrey. – 1971. – P. 237.
23) Caputto, R. The enzymatic transformation of galactose into glucose derivatives [Text] / R. Capputo, L.F. Leloir, R.E. Trucco. – New York: Academic Press, 1949. – P. 497 – 498. – Bibliogr.: p. 498.
24) Ellis, M.B. Dematiaceous hyphomycetes. Commonwealth. Kew [Text] / M.B. Ellis. – New York: Academic Press, 1971. – 608 p.; 25 cm. – Bib.: p. 246. – 3000 copy.
25) Klich, M. A laboratoty quide to common Aspergillus species and their telemorphs [Text]. New South Wales. Australia. Commenwealth Scientific and industrial research organization, 1992. – P. 116.
26) Margolin, A.S. The effect of various carbohydrates upon the growth of some fungi. [Text] / A.S. Margolin. – West Virginia University, 1942.
27) Nord, F.F. Resent progress in the biochemistry of Fusaria [Text] / F.F. Nord, R.P. Mull. – New York: Advances in Enzymol., 1945. – P. 165 – 205.
Похожие работы
... просмотренных. Наблюдение проводят на 1, 2, 3, 7, 15-е сутки. Стекла микроскопировали, учитывая прорастание спор (%), длину проростков (в мкм) (Кураков, 2001). ГЛАВА 3. ИССЛЕДОВАНИЕ РОСТА МИКРОМИЦЕТОВ НА РАЗЛИЧНЫХ СУБСТРАТАХ Объектами исследования явились 10 штаммов коллекционных микроскоскопических грибов родов Aspergillus: A. niger, A. ustus, A. terreus, A. flavus, A. fumigatus, а также ...
... 5 видов разлагали хитин, 8 – выделяли тирозиназу и лакказу (Parton, 1988). Отмечают высокую целюлозолитическую активность у штаммов видов Trichoderma, Aspergillus niger и Penicillium miszynsky, выделенных из водных местообитаний (Hopper, 1995). Микроскопические грибы могут прямо или косвенно влиять на активность и развитие других гидробионтов. Пути воздействия могут быть различными – от прямого ...
... города Чернигова мною было собрано 13 видов дереворазрушающих грибов. Эти грибы были собраны в 3 – х географических пунктах окрестностей города, а именно Массаны, Яцево, район р. Десна. Распространение трутовиковых грибов в природных условиях определяется рядом факторов, важнейшим из которых служит субстрат, т.е. соответствующая древесина. Способность некоторых видов развиваться только на живых ...
... к ассимиляции ЭДТА и глюкозы в процессе длительного культивирования с добавлением субстрата В предыдущем разделе было показано, что ассимиляция глюкозы бактериальным штаммом LPM-4 индуцируется в процессе деградации ЭДТА, а кометаболизм ЭДТА и глюкозы у штамма LPM-4 не оказывает влияния на деградацию ЭДТА. В данном разделе целью работы было исследование: 1) сохраняется ли способность клеток ...
0 комментариев