Навигация
Активность АПФ при введении лей-энкефалин-арг у крыс на фоне острого ЭБС
3.5.3. Активность АПФ при введении лей-энкефалин-арг у крыс на фоне острого ЭБС.
Полученные данные об изменение активности АПФ при введении лей-энкефалин-арг стрессированным животным представлены в таблице 7 (приложение) и на рис. 9.
Результаты исследования показывают, что при предварительном введение проэнкефалина статистически достоверные отличия от группы интактных животных обнаружены только в гипофизе. Показатели активности АПФ при этом выше таковых у интактных животных через 24 часа на 36%, p<0,05 (рис.9).
При сравнении изменений активности АПФ при совместном действии лей-энкефалин-арг и острого ЭБС с соответствующими показателями стрессированных животных статистически достоверные отклонения обнаружены в гипофизе через 24 часа и в стриатуме через 4 часа (рис.9). Активность АПФ при предварительном введении лей-энкефалин-арг перед стрессом была выше показателей активности стрессированных животных на 36% (p<0,001) и 40% (p<0,05), соответственно. В другие исследованные промежутки времени статистически достоверных изменений не обнаружено.
В семенниках через 0,5 часа после введения лей-энкефалин-арг активность АПФ была ниже соответствующих показателей животных подверженных воздействию острого ЭБС на 20% (p<0,05). Однако, уже через 4 часа отмечено повышение активности АПФ по сравнению с группой стрессированных животных на 30% (p<0,01). В другие исследованные промежутки времени активность фермента сохранялась на достаточно высоком уровне и превышала показатели активности АПФ стрессированных животных через 24 часа на 23% (p<0,01) , а через 72 часа на 41% (p<0,01).
Таким образом если ЭБС в исследуемых отделах мозга практически не вызывал изменения активности АПФ, то введение лей-энкефалин-арг на фоне острого ЭБС вызывает некоторые изменения в активности АПФ в этих отделах, особенно ярко эта тенденция прослеживается в гипофизе через 24 часа, а также в стриатуме через 4 часа. Стойкая динамика увеличения активности АПФ показана также в семенниках.
Сравнение активности АПФ после введения лей-энк-арг стрессированным животным с введением этого пропептида интактным крысам показывает, что более выраженное влияние на активность фермента предшественник лей-энкефалина оказывает при введении его животным, не подвергающимся стресс-воздействию.
Таким образом, введение лей-энкефалин-арг перед началом острого ЭБС вызывает повышение активности КПН по сравнению с соответствующими показателями активности стрессированных и интактных животных в стриатуме - отделе мозга, связанном преиму-щественно с синтезом регуляторных пептидов стресспротективного действия. Предварительное введение предшественника лей-энкефалина предотвращало повышение активности КПН в гипофизе – отделе, где синтезируются стресс-пептиды.
Введение лей-энкефалин-арг перед острым ЭБС вызывало повышение активности ФМСФ-ингибируемой КП через 0,5 часа, по сравнению с соответствующими показателями стрессированных животных и предотвращало повышение активности ФМСФ-ингибируемой КП через 72 часа. Особенно ярко такая тенденция прослеживается в тех отделах мозга и тканях, где осуществляется синтез биологически активных пептидов, проявляющих выраженную антистрессорную активность. Активность ФМСФ-ингибируемой КП при этом была близка к норме.
Аргинизированный лей-энкефалин влиял на активность АПФ головного мозга, надпочечников и семенников стрессированных животных в гораздо меньшей степени, чем на активность КПН и ФМСФ-ингибируемой КП. Наибольшее влияние пептида обнаружено в семенниках.
Обнаружено, что введение лей-энкефалин-арг интактным и стрессированным животным вызывает различные по степени выражен-ности и направленности изменения активности изучаемых ферментов. Наиболее значительные изменения активности КПН, ФМСФ-ингибируемой КП и АПФ обнаружены у животных, не подвергавшихся воздействию стресса.
ГЛАВА 4. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ.
В настоящее время одной из наиболее актуальных проблем биохимии, физиологии и медицины является изучение молекулярных механизмов возникновения и развития стресса. Особую значимость при этом приобретает изучение острого стресс-воздействия на организм, поскольку именно кратковременное импульсное стрессирование приводит к экстренному повышению адаптивных способностей. Менее всего изучено влияние острого эмоционально-болевого стресса (ЭБС). Важную роль в устранении и/или ограничении стрессорных нарушений играет система эндогенных опиоидов [8, 14, 102, 106, 135, 236, 242]. Синтез природных опиоидных пептидов и их синтетических аналогов открыл перспективы для их использования при разного рода стресс-повреждениях организма [123]. Было показано, что выраженным антистрессорным действием обладают лей- и мет-энкефалины, лей-энкефалин-арг, синтетический аналог лей-энкефалина – даларгин [69, 105]. Несмотря на короткую продолжительность жизни экзогенных опиоидных пептидов в организме, проявляемые ими эффекты сохраняются на протяжении достаточно длительных промежутков времени [10, 11, 13, 119]. Одним из малоизученных вопросов в понимании механизмов длительного последействия экзогенных опиоидных пептидов является выяснение путей образования и инактивации других регуляторных пептидов, синтезируемых в ответ на введение опиоидов. Поскольку известно, что уровень большинства биологически активных пептидов и, следовательно, степень реализации адаптационных реакций при стресс-повреждениях организма, в значительной степени определяется активностью пептидгидролаз, то особый интерес вызывает изучение механизмов регуляции активности ферментов обмена нейропептидов при стресс-воздействии.
Исходя из вышеизложенного, интересным представляется изучение влияния экзогенного предшественника лей-энкефалина – лей5-энкефалин-арг6 на активность некоторых ферментов обмена нейропептидов – КПН, ФМСФ-ингибируемой КП и АПФ в норме и при воздействии острого ЭБС.
Поскольку КПН и АПФ участвуют в формировании стрессовой реакции организма, а дополнительное экзогенное введение жидкости влечет за собой возникновение стресса, то введение пропептида осуществлялось способом, который согласно данным [1, 24, 119] менее всего травмирует животное, обеспечивает более полное проникновение экзогенного вещества в мозг и позволяет использовать меньшие концентрации веществ – инстилляцией на конъюнктиву глаза.
Существенную роль в проявлении специфической активности изучаемых ферментов по отношению к регуляторным пептидам играют особенности их тканевой локализации. В связи с этим, представляется необходимым более детальное изучение регионального и тканевого распределения активности КПН, ФМСФ - ингибируемой КП и АПФ.
Максимальная активность КПН у интактных животных показана в гипофизе – отделе, где синтезируются стресс-пептиды и многие нейропептиды стресс-протективного действия (табл.1). Высокий уровень активности фермента обнаружен также в гипоталамусе, четверохолмии, стриатуме - отделах лимбической системы, богатых опиоидными и другими нейропептидами [156, 168, 169, 221, 247]. Надпочечники и семенники характеризуются низкими показателями активности КПН. Полученные данные о региональном и тканевом распределении активности КПН, хорошо согласуются с литературными [37, 187, 248]. Таким образом, полученные нами сведения о высоком уровне активности этого фермента в отделах мозга и тканях, связанных с образованием и секрецией многих регуляторных пептидов [235] подтверждают участие КПН в процессинге нейропептидов в этих регионах.
Биологическая роль ФМСФ-ингибируемой КП в организме к настоящему моменту остается неясной. Сведения о тканевом и региональном распределении ФМСФ-ингибируемой КП носят фрагментарный характер. У исследованных нами групп животных высокая активность ФМСФ-ингибируемой КП обнаружена в надпочечниках и гипофизе (табл.1). Регионы мозга характеризуются более низкими показателями, при этом активность ФМСФ-ингибируемой КП распределена достаточно равномерно. Полученные нами данные о распределении активности ФМСФ-ингибируемой КП согласуются с уровнем нейропептидов в этих структурах, что подтверждает ранее выдвигаемые предположения [49, 53, 119, 149]о вовлечении этого фермента в обмен регуляторных пептидов. Однако более конкретное определение роли этого фермента в обменных процессах остается на данном этапе открытым вопросом. В связи с вышесказанным, представляется необходимым более детальное изучение некоторых характеристик этого фермента: сравнение уровня его активности с активностью КПН – фермента, биологическая роль которого определена, а также исследование распределения активности ФМСФ-ингибируемой КП в отделах мозга и органах при различных функциональных и патологических состояниях организма.
Интересно отметить, что в гипофизе – отделе, в котором синтези-руются многие нейропептиды и гормоны пептидной природы [232], активность КПН существенно не отличается от таковой для ФМСФ-ингибируемой КП, в то время как в надпочечниках - отделе, где синтезируются преимущественно энкефалины [33, 34], активность ФМСФ-ингибируемой КП существенно выше активности КПН. Как показывают данные некоторых исследований, пептидные гормоны, синтезирующиеся в гипофизе, содержат в неактивной форме перед остатком основной аминокислоты остатки аминокислот - аланина и глицина [62]. Образующиеся в надпочечниках энкефалины содержат в качестве предпоследних остатки гидрофобных аминокислот (лейцина и метионина) [62]. Принимая во внимание, также, особенности регионального распределения КПН и ФМСФ-ингибируемой КП можно высказать предположение об участии этих ферментов в процессинге предшественников нейропептидов, различных по своему качественному составу. Возможно, что ФМСФ-ингибируемая КП участвует в процессинге проформ, содержащих в качестве предшествующей основным аминокислотам - аргинину и лизину, гидрофобной аминокислоты. Что же касается КПН, то она, вероятно, участвует в процессах модификации проформы с предшествующей аминокислотой, содержащей короткий алифатический радикал (аланин и глицин).
Достаточно высокий уровень активности ФМСФ-ингибируемой КП, по сравнению с КПН, обнаружен в семенниках. Поскольку известно, что семенники, наряду с образованием некоторых регуляторных пептидов, характеризуются и достаточно высоким уровнем катаболизма белков, а свойства ФМСФ-ингибируемой КП во многом схожи с таковыми у лизосомальной КПА (Кф 3.4.16.1), которая вовлекается в интенсивный катаболизм белка, то показанная высокая активность ФМСФ-ингиби-руемой КП может являться свидетельством вовлечения ее в процессы инактивации регуляторных пептидов в периферических тканях. В связи с этим, можно выдвинуть предположение о существовании различных форм фермента, по-разному проявляющих свою активность в мозге и периферических тканях.
Распределение активности АПФ хорошо изучено во внемозговых образованиях, что же касается исследования активности этого фермента в различных регионах мозга, то данному вопросу, до недавнего времени уделялось недостаточное внимание. Известно, что АПФ участвует в процессинге ангиотензина I, инактивации брадикинина, в последова-тельном гидролизе энкефалиновой молекулы [66, 180, 182, 196, 209, 234].
Изучение активности АПФ у интактной группы животных показало, что наибольшая активность фермента обнаруживается в гипофизе и семенниках (табл.1), где синтезируются многие биологически активные пептиды. Достаточно высокие показатели активности отмечены, также, в стриатуме - отделе, характеризующимся высоким содержанием нейропептидов [62, 221]. Данные ряда исследований свидетельствуют о том, что закономерности, описывающие роль периферической ренин-ангиотензиновой системы не могут быть перенесены на системы центральной регуляции, ввиду существования определенной автономии и биохимической специфичности АПФ в мозге и на периферии [66, 196, 222]. В связи с этим, присутствие высокой активности АПФ как в отделах мозга, так и в семенниках может быть признано как свидетельство участия этого фермента в обмене различных по своему функциональному составу нейропептидов, содержащихся в мозге и периферических тканях. Не исключена также возможность участия АПФ в обмене нейропептидов, одинаковых по своему функциональному составу, хотя этот процесс, вероятно, по-разному протекает в мозге и тканях, что может свидетельствовать в пользу существования изофермента [66].
Таким образом, полученные нами сведения о региональном и органном распределении АПФ хорошо согласуются с литературными данными по локализации нейропептидов в структурах мозга и тканях [156, 196, 221], что подтверждает участие АПФ в обмене регуляторных пептидов [182, 183].
Основой для более детального представления о биологической роли изучаемых ферментов в мозге и периферических тканях могут послужить исследования по изучению их активности при экстремальных воздействиях.
Известно, что при воздействии стресс-факторов осуществляется мобилизация важнейших физиологических систем организма, направленная на поддержание его гомеостаза и адаптации к неблагоприятным условиям среды [144]. Развитие адаптационных реакций является следствием активации стресс-лимитирующих систем, таких как ГАМК-эргическая, серотонинэргическая, энкефалинэргическая [5, 116], что в первую очередь выражается в усилении синтеза их основных компонентов. Известно, что одним из видов воздействия, приводящим к генерализованной мобилизации стресс-лимитирующих и стресс-реализующих систем организма является острый ЭБС [37, 70, 121, 141, 145, 155]. Однако многие аспекты возникновения и развития стресс-реакции при воздействии ЭБС изучены недостаточно. Менее всего исследованы ферментативные механизмы, обеспечивающие функцио-нирование физиологических систем при остром ЭБС.
Изучение активности КПН, ФМСФ-ингибируемой КП и АПФ у крыс при воздействии острого ЭБС показало изменение их активности в изучаемых отделах мозга и периферических тканях (табл. 2, рис.1-3).
Наиболее выраженное повышение активности КПН при остром ЭБС отмечено в гипофизе. Активность фермента была выше показателей интактных животных (табл.2, рис.1), что согласуется с изменениями его активности при других видах стресса [42, 64]. Повышение активности КПН в ранний период после стресса в гипофизе - отделе, где синтези-руются стресс-пептиды [142, 232, 243], по-видимому, связано с увеличением их синтеза и секреции. Поскольку известно, что КПН in vivo вовлекается в образование АКТГ [189], являющегося важным компонентом стресс-реализующих систем, то повышение активности КПН через 0,5 и 4 часа после воздействия является специфичным ответом организма на стресс и способствует увеличению размаха стресс-реакции в организме. Достаточно длительное повышение активности КПН отражает длительный характер ответной реакции организма на воздействие стресс-фактора. Известно, что после однократного ЭБС вслед за катаболической стадией, развивается более длительная – анаболическая, которая характе-ризуется генерализованной активацией синтеза различных физиологически активных веществ, способствующих адаптации организма к стрессовой ситуации [121, 122]. Поскольку гипофиз обладает повышенным содержанием энкефалинов [221], вещества Р [241], то, вероятно, повышение в нем активности КПН через 24 и 72 часа связано с участием фермента в процессинге этих регуляторных пептидов. Необходимость в дополнительном синтезе пептидов стресс-протективного действия обусловлена интенсивной секрецией их в начальном периоде развития стресс-реакции и, следовательно, истощением их запаса. Таким образом, полученные результаты согласуются с литературными данными об участии КПН не только в развитии стресса, но и в ограничении интенсивности стресс-реакции [37, 142, 232, 243].
Установлено, что при воздействии стресса в мозге увеличивается содержание опиоидов, вещества Р, и др. [35, 138, 139, 236]. Обнаруженное на поздней стадии развития стресса повышение активности КПН в стриатуме и больших полушариях свидетельствует о вовлечении фермента в процессинг этих биологически активных пептидов, что приводит к увеличению их содержания в названных структурах мозга при остром ЭБС и способствует угасанию стресс-реакции.
Содержание стресс-протективных пептидов - энкефалинов, вещества Р - в среднем мозге и гиппокампе при стрессе также увеличивается [56]. Однако в этих структурах мозга через 4 часа после воздействия активность фермента была ниже показателей интактной группы. Сходная тенденция к снижению активности КПН отмечена и в надпочечниках. Известно, что КПН локализована преимущественно в везикулах секреторных клеток [195]. В результате их опустошения после воздействия стресса высвобождаются как пептиды, так и локализованные в них молекулы КПН. Следовательно, обнаруженное снижение активности КПН может быть обусловлено уменьшением числа активных молекул фермента в секреторных везикулах.
Таким образом, показанное после острого воздействия ЭБС, изменение активности КПН в отделах мозга, гипофизе и надпочечниках вызвано изменениями в метаболических процессах, которые связаны, прежде всего, с мобилизацией стресс-лимитирующих и стресс-реализующих систем.
В отличие от КПН, выраженное повышение активности ФМСФ-ингибируемой КП во всех отделах мозга и надпочечниках наблюдалось через 72 часа после воздействия (табл.2, рис.2). Наиболее существенные изменения отмечены в больших полушариях и надпочечниках.
Известно, что при остром ЭБС обнаруживается значительное увеличение активности лизосомальных ферментов, которые вовлекаются в деградацию избытка нейропептидов, синтезированных в ответ на стресс [121]. При этом отмечено, что активность лизосомальных ферментов остается повышенной даже через 5 суток после завершения стресс-воздействия [121]. Поскольку ФМСФ-ингибируемая КП, предположительно, является изоферментом лизосомальной КПА [53], то увеличение активности фермента через 72 часа после острого ЭБС может являться свидетельством участия ФМСФ-ингибируемой КП в деградации избытка регуляторных пептидов, синтезируемых в ответ на стресс. Повышение активности ФМСФ-ингибируемой КП в надпочечниках – органе, содержание энкефалинов в котором при воздействии стресса увеличивается [34] и больших полушариях, характеризующихся высоким уровнем катаболизма [17, 22], подтверждает выдвинутое предположение.
В отличие от ФМСФ-ингибируемой КП, активность которой существенно повышалась в надпочечниках, наиболее выраженные изменения активности КПН наблюдались в гипофизе. Поскольку известно, что в надпочечниках синтезируются преимущественно энкефалины, а в гипофизе – гормоны пептидной природы, то полученные данные могут свидетельствовать об участии этих ферментов в обмене разных биологически активных пептидов.
Сходная с КПН тенденция к повышению активности ФМСФ-ингибируемой КП в ранние периоды после стресса отмечена в семенниках, где активность фермента была выше нормы только через 0,5 часа. Не исключено, что в семенниках данный фермент может вовлекаться и в процессинг регуляторных пептидов при стрессе.
Таким образом, в ответ на воздействие острого ЭБС вовлекается как КПН, так и ФМСФ-ингибируемая КП. Различная динамика изменений активности этих ферментов в мозге и периферических тканях позволяет выдвинуть предположение о включении этих ферментов на разных этапах обмена нейропептидов. При этом, обе КП участвуют в обмене регуляторных пептидов в тех отделах мозга и органах, которые предохраняют стресс-систему организма от истощения.
Одним из важных звеньев в механизмах функционального взаимодейтсвия энкефалинэргической, ренин-ангиотензиновой и гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) является АПФ [209]. В связи с этим, исследование активности АПФ после воздействия острого ЭБС рассматривается как значимое звено в цепи изучаемых реакций организма, так как изменения в активности АПФ в отделах мозга и периферических тканях могут отражать региональную функцию ангиотензин-образующей системы в условиях стресса.
Полученные нами данные показали снижение активности АПФ в стриатуме и гипофизе через 4 часа после воздействия ЭБС (табл.2, рис.3). При воздействии стресса наблюдается нарушение проницаемости мембран и повышение содержания ионов Na+, что может вызвать торможение синтеза АПФ [64], чем, вероятно, и объясняется наблюдаемое снижение активности АПФ.
До настоящего времени функциональная роль АПФ в половых органах млекопитающих остается не до конца изученной. Известно, что функции семенников модулируются опиоидными пептидами [197], образование которых при воздействии острого ЭБС увеличивается. Структура энкефалинов такова, что АПФ может расщеплять их до ди- и три-пептидов [180]. В связи с этим, повышение активности АПФ в семенниках через 0,5 часа после острого ЭБС может быть охарактеризовано как ответная реакция организма на повышение уровня опиоидных пептидов, что направлено на стабилизацию вызванного стрессом повышенного баланса опиоидных пептидов. Возможно, что снижение активности АПФ в семенниках в последующие промежутки времени является следствием замедления процесса инактивации синтезированных в ответ на стресс-воздействие нейропептидов.
Таким образом, обнаруженные при воздействии острого ЭБС изменения активности КПН, ФМСФ-ингибируемой КП и АПФ являются, вероятно, следствием их участия в процессах синтеза и/или деградации компонентов стресс-лимитирующих и стресс-реализующих систем.
Наблюдаемое после стресс-воздействия увеличение синтеза и секреции многих биологически активных пептидов, приводит не только к развитию адаптационных реакций, но и к истощению нейрогуморальных систем [4, 145]. Интенсивное исследование системы эндогенных опиоидных пептидов показало их участие в механизмах физиолого-биохимической регуляции процессов, возникающих при стресс-повреждении организма [100, 101, 102, 125, 134]. Особое практическое значение, в связи с этим, имеет использование опиоидных пептидов и их синтетических аналогов в качестве агентов, компенсирующих изменения в метаболизме мозга и органов животных при стрессе. Повышенное стресс-протективное свойство аргининсодержащего гексапептидного аналога лей-энкефалина – даларгина объясняется, прежде всего, наличием в его молекуле концевого аргининового компонента [105, 146]. В связи с этим, не исключено, что в регуляцию метаболических процессов в мозге и органах может вовлекаться и аргинизированный предшественник лей-энкефалина (лей5-энкефалин-арг6). Установлено, что при периферическом введении повышенной проницаемостью ГЭБ, а, следовательно, и более выраженным воздействием на функциональные системы, характеризуются не сами биологически активные вещества, а их ближайшие предшественники [82]. Это обусловило использование в наших исследованиях лей5-энкефалин-арг6. Поскольку известно, что модулирующее действие экзогенных веществ зависит от исходного состояния физиологических систем и может по-разному проявляется при оптимальном и различных функциональных состояниях организма [107], то представляется необходимым исследование влияния лей5-энкефалин-арг6 на активность КПН, ФМСФ-ингибируемой КП и АПФ у интактных животных.
Введение предшественника лей-энкефалина в дозе 20 мкг/кг массы крысы вызывало существенное повышение активности КПН, ФМСФ-ингибируемой КП и АПФ во всех исследованных отделах мозга и тканях по сравнению с контролем (табл.3, рис.4-6). Полученные данные свидетельствуют о вовлечении изучаемых ферментов в ответ организма на введение лей5-энкефалин-арг6.
Максимальное изменение активности ферментов в отделах мозга и периферических тканях обнаружено через 0,5 часа после инстилляции. Наиболее выраженное повышение активности КПН показано в гипофизе, ФМСФ-ингибируемой КП - в надпочечниках, АПФ – в семенниках.
Полученные нами данные (рис.4-6) указывают на наличие достаточно длительного влияния лей-энкефалин-арг на активность данных ферментов, что согласуется с уже проведенными исследованиями [59, 107, 113, 119] о пролонгированном действии многих регуляторных пептидов. Одним из механизмов, способствующих проявлению такого рода длительных эффектов является их связывание с белками-переносчиками [78], которые способны защищать пептид от достаточно быстрого действия протеаз. Постепенная диссоциация образующегося комплекса “пептид-носитель” приводит к поддержанию концентрации пептида на уровне, необходимом для реализации физиологических эффектов в течение достаточно длительных промежутков времени. Проявление длительных эффектов экзогенно вводимых веществ объясняют, также, на основе теории о функциональной непрерывности [59, 113]. Существенной особенностью которой является способность каждого регуляторного пептида индуцировать или ингибировать образование или деградацию других пептидов. Вследствие развивающихся при этом каскадов биохимических реакций, эффект экзогенного пептида будет проявляться и тогда, когда исходное вещество уже полностью разрушено. Однако эти сведения представлены только для активных пептидов. В нашей же работе пролонгированное действие наблюдалось и при введении предшественника лей-энкефалина - лей-энкефалин-арг. Не исключено что изучаемые ферменты - КПН, ФМСФ-ингибируемая КП и АПФ участвуют в биогенезе биологически активных пептидов, синтезируемых в ответ на введение лей-энкефалин-арг, выступающего в роли индуктора.
Длительное повышение активности КПН после введения лей-энкефалин-арг отмечено в гипофизе, стриатуме и гипоталамусе (табл.3, рис.4), где осуществляется синтез многих регуляторных пептидов [156, 221]. Наиболее существенное повышение активности КПН обнаружено в гипофизе. Вероятно, что экзогенно введенный лей-энкефалин-арг инициировал ряд последовательных реакций синтеза других регуляторных пептидов, в процессинге которых участвует КПН, что и вызывало длительное повышение активности изучаемого фермента.
Значительное увеличение активности ФМСФ-ингибируемой КП наблюдалось в надпочечниках, гипофизе, гипоталамусе и среднем мозге (табл.3), характеризующихся высоким содержанием нейропептидов. Следовательно, можно выдвинуть предположение о вовлечении исследуемого фермента в процессинг регуляторных пептидов в этих регионах при введении лей-энкефалин-арг. Не исключено, что возрастание активности фермента в первые 0,5 часа после начала эксперимента может быть связано с вовлечением его в процессы преобразования в активную форму введенного пропептида (индуктора). Дальнейшее же увеличение активности, вероятно, является следствием участия ФМСФ-ингибируемой КП в процессинге регуляторных пептидов, которые образуются в ответ на введение индуктора в исследованных регионах мозга и надпочечниках.
Известно, что АПФ участвует как в процессинге, так и в инактивации нейропептидов, проявляя при этом дипептидилкарбоксипептидазную и эндопептидазную активности [182, 183, 209, 223, 241]. Поскольку предполагается, что экзогенный лей-энкефалин-арг инициирует процессы образования активных форм некоторых нейропептидов, то, не исключено, что АПФ может играть роль регулирующего фактора в этих реакциях, контролируя уровень введенного пропептида. Достаточно высокая активность АПФ после введения предшественника лей-энкефалина обнаружена в гипофизе и стриатуме (рис.6). Причем, следует подчеркнуть, что статистически достоверное повышение активности в этих отделах зарегистрировано только через 0,5 часа (рис.2). Возможно, что столь кратковременное повышение активности АПФ в исследуемых регионах мозга связано с его участием в инактивации введенного проэнкефалина или в деструкции избытка синтезируемых регуляторных пептидов. Существенное и длительное повышение активности АПФ при введении лей-энкефалин-арг отмечено в семенниках. Вероятно, что АПФ участвует в процессинге ряда биологически активных веществ, синтезируемых в этом органе в ответ на введение лей-энкефалин-арг. Известно также, что в семенниках высок уровень процессов катаболизма. Следовательно, не исключена возможность участия АПФ и в процессах инактивации избытка синтезируемых нейропептидов.
Таким образом, обнаруженное после введения лей-энкефалин-арг повышение активности исследуемых ферментов в тех отделах мозга и тканях, где синтезируется большое количество нейропептидов, является свидетельством изменения метаболической активности головного мозга и периферических тканей. Вероятно, что КПН, ФМСФ-ингибируемая КП и АПФ участвуют в процессах синтеза и/или инактивации ряда биологически активных пептидов, синтезируемых в ответ на введение лей5-энкефалин-арг6. В связи с этим, не исключено, что цепные реакции образования или деградации регуляторных пептидов в ответ на введение индуктора “запускаются” посредством изменения активности данных пептидгидролаз.
Следовательно, представляется интересным вопрос о механизме регуляции активности КПН, ФМСФ-ингибируемой КП и АПФ под влиянием лей-энкефалин-арг. Обнаружено, что in vitro активность КПН и АПФ ингибируется пропептидом, что согласуется с литературными данными [160, 207]. На активность ФМСФ-ингибируемой КП предшественник лей-энкефалина не оказывал влияния (табл.4).
Показанный эффект ингибирования активности КПН может быть обусловлен конкуренцией двух субстратов (дансил-фен-ала-арг – субстрат для определения активности фермента и экзогенно введенный лей-энкефалин-арг) за связывание с ферментом [38]. Однако известно, что КПН локализована в секреторных везикулах, проникновение в которые экзогенного пропептида представляется маловероятным [187, 195]. Известно также, что энкефалины влияют на уровень экспрессии мРНК ряда нейропептидов [231, 246]. Уровень мРНК КПН и многих нейропептидов координированно регулируется секретогенами. Поэтому представляется более вероятным, что экзогенно введенный лей-энкефалин-арг, влияет на уровень экспрессии мРНК КПН, что приводит к изменению активности фермента. Активация АПФ, вероятно, объясняется действием экзогенного лей-энкефалин-арг на активность эндогенных ингибиторов АПФ [73, 85]. Таким образом, показанное несоответствие во влиянии лей-энкефалин-арг на активность КПН, ФМСФ-ингибируемой КП и АПФ in vivo и in vitro свидетельствует о существовании in vivo механизмов, опосредующих действие экзогенного предшественника лей-энкефалина.
Известно, что экзогенное введение опиоидных пептидов способствует стимуляции образования и выброса эндогенных опиоидов, что является одним из факторов естественной профилактики истощения стресс-лимитирующих систем и направлено на адаптацию организма к стрессу [69, 116, 198]. Выдвинутое ранее предположение о инициации процессов синтеза и деградации некоторых биологически активных пептидов при введении лей-энкефалин-арг, послужило основанием для использования этого вещества в качестве агента, повышающего активность эндогенной энкефалинэргической системы.
При введении лей-энкефалин-арг непосредственно перед моделированием острого ЭБС активность всех изучаемых протео-литических ферментов изменялась по сравнению с соответствующими показателями у животных, подверженных стрессу, введению пропептида и интактных животных.
При совместном влиянии острого ЭБС и лей-энкефалин-арг активность КПН во всех исследуемых отделах мозга и периферических тканях крыс достоверно отличалась от соответствующих показателей стрессированных животных (табл.5, рис.7). Полученные данные свидетельствуют о вовлечении КПН в реализацию биохимических процессов, индуцированных введением пропептида. Наиболее существенное повышение активности фермента отмечено в отделах мозга, характеризующихся высоким содержанием стресс-протективных веществ. Не исключено, что предшественник лей-энкефалина, предварительно введенный в организм животного, способствовал “запуску” каскада биохимических реакций синтеза веществ, участвующих в адаптации организма к стресс-факторам [116, 132, 241, 242].
Согласно полученным данным, введение лей-энкефалин-арг перед началом стресс-воздействия предотвращало повышение активности КПН в гипофизе (табл.5, рис.7), отмеченное при остром ЭБС. Известно, что при любой форме стресса общим и наиболее существенным моментом является активация ГГНС, характеризующаяся избыточным образованием и секрецией гормонов стресса [21, 128, 134, 143, 144, 150]. Показано также, что введение энкефалинов блокирует активность ГГНС [74, 124, 134], приостанавливая процессы синтеза гормонов пептидной природы, в частности АКТГ. Поскольку, КПН участвует в биосинтезе АКТГ в гипофизе, то показанное после введения лей-энкефалин-арг снижение активности КПН по сравнению с группой стрессированных животных позволяет выдвинуть предположение о способности лей-энкефалин-арг проявлять эффекты сходные с таковыми активных форм энкефалинов. Ранее мы предположили, что повышение активности карбоксипептидазы Н в гипофизе на поздних этапах исследования (24 и 72 часа) после воздействия острого ЭБС показывает ее участие в активизирующихся при стрессе процессах синтеза стресс-протективных пептидов. Полученные в данной серии эксперимента результаты об увеличении активности КПН через 24 и 72 часа в гипофизе по сравнению с интактной группой, могут являться свидетельством того, что при введении пропептида стрессированным животным фермент также включается в процессы синтеза пептидов, способствующих адаптации организма к стресс-воздействию.
Таким образом, снижение активности КПН в гипофизе при совместном действии лей-энкефалин-арг и стресса через 0,5 и 4 часа может способствовать уменьшению выработки и секреции стресс-пептидов, а повышение активности через 24 и 72 часа – активизации процессов синтеза стресс-протективных веществ и, следовательно, адаптации к стрессу.
Существенное повышение активности КПН отмечено в стриатуме – отделе, где синтезируются нейропептиды, обладающие выраженным антистрессорным действием [221] (табл.5, рис.7). В ранние промежутки времени (0,5 и 4 часа) активность КПН была выше по сравнению с активностью у стрессированных и интактных животных. Напротив, при воздействии острого ЭБС активность фермента в стриатуме повышалась (табл.2, рис.1) на более поздних этапах исследования (через 24 и 72 часа). Известно, что предварительное введение компонентов стресс-лимитирующих систем вызывает ограничение катаболической и удлинение анаболической стадии, которая характеризуется активацией синтеза веществ, играющих важную роль в развитии адаптационных реакций [121]. На основании полученных нами данных о повышении активности КПН в стриатуме на ранних стадиях после совместного воздействия двух факторов, можно предположить, что при инстилляции предшественника лей-энкефалина при ЭБС происходит активация синтеза многих стресс-протективных веществ (вещество Р, энкефалины и др), что способствует уменьшению размаха стресс-реакции.
Обнаруженное увеличение активности исследуемого фермента через 4 часа после введения лей-энкефалин-арг на фоне стресса (относительно группы стрессированных животных, не получавших пропептид) в гиппокампе, больших полушариях, гипоталамусе и надпочечниках - характеризующимися высоким содержанием нейропептидов [156] (табл.5, рис.7) свидетельствует, вероятно, о включении КПН в процессинг регуляторных пептидов в этих структурах.
Таким образом, предварительное введение стрессированным животным предшественника лей-энкефалина вызывает изменения активности КПН в регионах мозга и периферических тканях, способствующие адаптации к стрессу. Поскольку проникновение экзогенного пропептида в секреторные везикулы, где локализован фермент [38, 189] представляется маловероятным, следовательно, лей-энкефалин-арг при стрессе опосредовано влияет на активность КПН, вероятно, через изменение уровня экспресии гена фермента.
При совместном воздействии лей-энкефалин-арг и острого ЭБС обнаружены разнонаправленные изменения активности ФМСФ-ингибируемой КП в отделах головного мозга и периферических тканях крыс.
Предварительное введение лей-энкефалин-арг стрессированным животным предотвращает повышение активности фермента через 72 часа, отмеченное при воздействии острого ЭБС. В более ранние промежутки времени активность ФМСФ-ингибируемой КП была выше (табл.6, рис.8). Наиболее выраженные изменения обнаружены в гипофизе, среднем мозге, гипоталамусе и надпочечниках (рис.8) - структурах, богатых нейропептидами, синтез которых, по нашему предположению, усиливается под воздействием введенного пропептида.
Известно, что при совместном действии опиоидных пептидов и стресса обмен веществ, по прошествии более одного часа после воздействия, ускоряется, однако смещения его в сторону катаболизма, как это отмечается при стрессе, не происходит [18, 22, 121, 138]. ФМСФ-ингибируемая КП, предположительно, является изоферментом лизосомальной КПА, участвующей в деградации биологически активных веществ [49, 53, 233]. Следовательно, отмеченное через 72 часа после введения лей-энкефалин-арг стрессированным животным снижение активности фермента в гипофизе, среднем мозге, гипоталамусе, больших полушариях по сравнению с показателями стрессированных животных свидетельствует о снижении уровня катаболических процессов в исследуемых отделах. Активность фермента при этом практически не отличается от соответствующих показателей нормы (рис.8).
Иная динамика изменения активности ФМСФ-ингибируемой КП обнаружена в стриатуме и гиппокампе – отделах лимбической системы, характеризующихся высоким содержанием нейропептидов, участвующих в регуляции эмоционального статуса организма [145, 221]. Повышение активности фермента наблюдалось только через 0,5 часа после совместного воздействия двух факторов. Снижения активности через 72 часа не обнаружено. У стрессированных животных активность ФМСФ-ингибируемой КП в стриатуме и гиппокампе через 72 часа повышалась незначительно (рис.2). На основании полученных экспериментальных данных можно предположить, что ФМСФ-ингибируемая КП стриатума и гиппокампа не вовлекается в деградацию избытка синтезированных в ответ на оказанное воздействие нейропептидов. Не исключено, что существенное повышение активности ФМСФ-ингибируемой КП в стриатуме и гиппокампе может быть связано с участием фермента в процессинге биологически активных пептидов в этих отделах.
Принципиально отличная динамика изменения активности ФМСФ-ингибируемой КП отмечена в семенниках (рис.8). Активность изучаемого фермента в них через 4, 24 и 72 часа существенно повышена, по сравнению с показателями активности как интактных, так и стрессированных животных. Известно, что в семенниках синтезируются многие биологически активные пептиды, кроме того, в них достаточно высок уровень катаболизма. Поскольку активность ФМСФ-ингибируемой КП при стрессе повышалась только через 0,5 часа, а процесс деградации является достаточно длительным процессом, то мы предположили, что исследуемый фермент не вовлекается в процессы катаболизма в семенниках. Известно также, что функции семенников модулируются опиоидными пептидами [197]. В связи с вышесказанным, существенное повышение активности ФМСФ-ингибируемой КП в семенниках при совместном воздействии стресса и лей-энкефалин-арг может быть связано с включением фермента в процессинг биологически активных пептидов в этом органе.
Таким образом, в исследуемых отделах мозга и периферических тканях отмечены различные, как по степени выраженности, так и по направленности, изменения в активности ФМСФ-ингибируемой КП. Показанные отличия могут быть связаны с присутствием в исследуемых тканях разных форм фермента с близкими физико-химическими свойствами, но, отличающимися при этом своей биологической ролью.
По нашему предположению, лей-энкефалин-арг принимает участие в инициации синтеза многих нейропептидов, в том числе и опиоидных. Известно, что эндогенные опиоидные пептиды оказывают стимулирующее действие на стресс-лимитирующую – ГАМК-эргическую систему, способны ограничивать активацию стресс-реализующей адренергической и симпатоадреналовой системы [5, 74, 121, 240], следствием чего является ограничение стресс-реакции. Таким образом, можно заключить, что показанные изменения активности ФМСФ-ингибируемой КП в исследованных регионах мозга и органах свидетельствуют о вовлечении этого фермента в реализацию адаптационных реакций, индуцированных введением лей-энкефалин-арг.
При совместном воздействии на организм животного острого ЭБС и лей-энкефалин-арг обнаружено, что активность АПФ изменялась. Наиболее выраженное и продолжительное повышение активности фермента по сравнению со стрессированными животными обнаружено в семенниках (рис. 9, табл. 7). Однако, по сравнению с нормой, статистически достоверных отличий не обнаружено. Известно, что АПФ принимает участие в инактивации энкефалинов и субстанции Р [180, 209]. Установлено, также, что клетки семенников связывают вещество Р, а их функции регулируются опиоиднами пептидами [197, 260]. В связи с этим, показанное в семенниках - органе, характеризующимся довольно высоким уровнем катаболизма белка, первоначальное (через 0,5 часа) снижение и существенное (через 4, 24 и 72 часа) повышение активности АПФ по сравнению с группой стрессированных животных (рис.9), свидетельствует, вероятно, об участии исследуемого фермента в инактивации избытка регуляторных пептидов, синтезированных в ответ на воздействие.
В гипофизе и стриатуме – регионах, где синтезируются многие нейропептиды, обладающие антистрессорным действием [156, 201, 221], активность АПФ повышалась по сравнению со стрессированными животными (рис.9). Известно, что введение даларгина вызывает повышение активности АПФ и содержания ангиотензина II в мозге [87] и способствует ограничению активации ГГНС - важной составляющей стресс-реализующих систем [87, 125, 134, 150]. Активация ГГНС характеризуется, прежде всего, повышением синтеза стресс-гормонов в гипофизе [150]. На основании полученных нами данных, можно предположить, что предшественник лей-энкефалина, при введении которого в гипофизе и стриатуме отмечено повышение активности исследуемого фермента (рис.9), также принимает участие в регуляции функций ГГНС, вероятно, блокируя ее активность. Подтверждением этого является отмеченное ранее снижение активности КПН - фермента, который участвует в синтезе АКТГ в гипофизе. Поскольку, КПН включается также в процессинг ряда стресс-протективных веществ в отделах мозга, а АПФ - в образовании ангиотензина II - регуляторного пептида, обладающего противоположным действием, то показанное более существенное и продолжительное повышение активности КПН в мозге при совместном влиянии двух факторов может свидетельствовать о превалирующем содержании в нем компонентов стресс-лимитирующих систем. Выдвинутое предположение подтверждается экспериментальными данными о снижении роли ангиотензинового звена при увеличении активности энкефалинобразующей системы [87].
Полученные данные об изменении активности АПФ при совместном воздействии лей-энкефалин-арг и острого ЭБС, свидетельствуют о вовлечении фермента, наряду с КПН и ФМСФ-ингибируемой КП, в реализацию адаптивных эффектов лей-энкефалин-арг.
Таким образом, инстилляция предшественника лей-энкефалина на конъюнктиву глаза крыс перед острым ЭБС вызывает изменения КПН, ФМСФ-ингибируемой КП и АПФ и способствует адаптации к стрессу. Полученные данные позволяют выдвинуть предположение, что одним из механизмов регулирующего действия лей-энкефалин-арг при стрессе может быть его влияние на активность изучаемых ферментов.
При сравнении полученных данных по влиянию предшественника лей-энкефалина на активность КПН, ФМСФ-ингибируемой КП и АПФ головного мозга и периферических тканей интактных крыс и крыс, подвергавшихся воздействию острого ЭБС, выявлены некоторые различия (рис. 4-6 и 7-9). При введении лей-энкефалин-арг интактным крысам наблюдалось более выраженное увеличение активности всех изучаемых ферментов. Известно, что важным фактором, определяющим проникновение в мозг экзогенно введенных веществ, является уровень обменных процессов в ЦНС [108]. В связи с этим, обнаруженное несоответствие во влиянии экзогенного пропептида на активность изучаемых ферментов при оптимальном функционировании физиологических систем и при патологических изменениях, вызванных стрессом, вероятно, объясняется снижением проницаемости ГЭБ для экзогенных веществ при воздействии острого ЭБС.
Таким образом, результаты проведенных исследований показали, что в ответ на воздействие острого ЭБС вовлекаются все изучаемые ферменты. Изменения в активности КПН, ФМСФ-ингибируемой КП и АПФ в различные сроки после воздействия острого ЭБС, по нашему предположению, связаны с их участием в инициирующихся при стрессе процессах синтеза и/или деградации регуляторных пептидов в отделах мозга и периферических тканях. Различия в динамике изменения активности КПН и ФМСФ-ингибируемой КП при воздействии острых стресс-факторов позволили предположить, что данные ферменты включаются в обмен регуляторных пептидов на разных этапах. Вероятно, что ФМСФ-ингибируемая КП участвует в процессах деградации избытка нейропептидов, синтезированных в ответ на стресс.
Изучение влияния предшественника лей-энкефалина на активность КПН, АПФ и ФМСФ-ингибируемой КП в норме и при действии острого эмоционально-болевого стресса, показало, что все исследуемые ферменты вовлекаются в ответ на введение пропептида. Однако обнаруженные изменения активности при введении лей-энкефалин-арг интактным животным несколько отличались от таковых при совместном воздействии стресса и пропептида и по степени выраженности и по направленности. Наиболее значительные изменения активности КПН, ФМСФ-ингибируемой КП и АПФ при введении предшественника лей-энкефалина обнаружены в отделах мозга и периферических тканях животных, не подвергавшихся воздействию стресса.
Введение лей-энкефалин-арг перед острым ЭБС предотвращало повышение активности ферментов в отделах мозга, связанных с синтезом и секрецией стресс-пептидов. Активность ферментов при этом практически не отличалась от нормы. В отделах мозга и периферических органах, где осуществляется синтез стресс-протективных веществ, активность ферментов повышалась в начальный период после введения лей-энкефалин-арг. Таким образом, инстилляция предшественника лей-энкефалина на конъюнктиву глаза вызывает изменения активности ферментов, способствующие адаптации к стрессу. Принимая во внимание данные ряда исследователей о способности экзогенных нейропептидов стимулировать синтез и выброс других биологически активных пептидов в организме [12, 13, 78, 113, 119, 132,], а также полученные в нашей работе результаты, мы предположили, что экзогенный лей-энкефалин-арг инициирует процессы синтеза регуляторных пептидов стресс-протективного действия. Образующиеся в результате каталитических реакций биологически активные пептиды способны в свою очередь модулировать деятельность различных функциональных систем организма [78]. Обнаруженные отличия в динамике изменения активности КПН, ФМСФ-ингибируемой КП и АПФ между стрессированными животными и животными, получавшими перед стрессом лей-энкефалин-арг, могут свидетельствовать об участии изучаемых ферментов в каталитических реакциях синтеза и/или деградации регуляторных пептидов, индуцированных введением предшественника лей-энкефалина.
Реализация показанных эффектов лей-энкефалин-арг в норме и при действии острого ЭБС, вероятно, осуществляется посредством влияния его на активность эндогенных активаторов и ингибиторов и/или уровень экспрессии генов изучаемых ферментов. Поскольку, в настоящее время эндогенные ингибиторы обнаружены только для АПФ [73, 85], то изменения активности данного фермента, вероятно, объясняются инициированием лей-энкефалин-арг механизмов действия этих эндогенных регуляторов. Изменения в активности КПН не могут быть следствием прямого действия экзогенного лей-энкефалин-арг на фермент, так как проникновение пропептида в секреторные везикулы, где локализована КПН представляется маловероятным. Мы предположили, что действие экзогенного лей-энкефалин-арг на активности КПН опосредовано через изменение уровня экспрессии гена фермента. ФМСФ-ингибируемая КП на данный момент является малоизученным ферментом. Возможно, что in vivo существуют сходные с КПН и/или АПФ механизмы, опосредующие влияние экзогенного предшественника лей-энкефалина на активность ФМСФ-ингибируемой КП.
Таким образом, полученные в нашей работе данные свидетельствуют о вовлечении протеолитических ферментов - КПН, ФМСФ-ингибируемой КП и АПФ в процессы адаптации организма к действию острых стресс-факторов, которые усиливаются при введении лей-энкефалин-арг. Одним из механизмов адаптогенного действия лей-энкефалин-арг при стрессе может быть влияние на активность изучаемых ферментов обмена нейропептидов.
ЛИТЕРАТУРА
1. Авроров В.Н. ГОБ, его значение в норме и при патологии глаза и пути регуляции с целью получения терапевтического эффекта. - Воронеж.-1982.-10с.
2. Азарян А.В. Пептидгидролазы нервной системы и их биологическая функция //Ереван.- Айастан.- 1989. - 208с.
3. Акопян Т.Н. Протеолитические превращения нейропептидов и пути их регуляции в центральной нервной системе // диссертац. на соискан. степени доктор биол.наук.- М.- 1989
4. Алешин Б.В., Бондаренко Л.А. Стресс, адаптация и функциональные нарушения. - Кишинев: Штиинца. - 1984.- С.11-12
5. Андреев Б.В., Игнатов Ю.Д., Никитина З.С., Сытинский И.А. Антистрессорная роль ГАМК-эргической системы мозга // Журн. высш. нервн. деят. - 1982.-т.32, №3.- С.511-519.
6. Аргинтаев Э.С. Взаимоотношение между паращитовидной железой и системой опиоидных пептидов в физиологических условиях и в динамике стресс-реакции // диссертац. на соиск. степени канд.мед.наук. - Томск.- 1989
7. Арушанян Э.Б. Участие эпифиза в антистрессорной защите мозга // Усп. Физиол.наук.- 1996.-т.27.-№3.-С.31-50
8. Ашмарин И.П. Малые пептиды в норме и при патологии // Патологическая физиология и экспериментальная терапия. - 1982.- №4.- С.13-27
9. Ашмарин И.П. Перспективы практического применения и некоторые фундаментальные исследования малых регуляторных пептидов // Вопр. мед. химии. - 1984.- №3.- С.2-7
10.Ашмарин И.П. Регуляторные пептиды сильного и быстрого действия // Патологическая физиология и экспериментальная терапия. - 1988. - №3.- С.3.
11.Ашмарин И.П., Каменская М.А. Нейропептиды в синаптической передаче // Итоги наук. и техн.- ВИНИТИ.- Физиология человека и животных. - 1988.-т. 34.-С.184-192
12.Ашмарин И.П. Каразеева Е.П. Нейропептиды // в кн.”Нейрохимия” под ред. Ашмарина И.П., Стукалова П.В.- М.: Издательство института биомедицинской химии РАМН.-1996.- С.296-333
13.Ашмарин И.П., Обухова М.Ф. Регуляторные пептиды. Функционально-непрерывная совокупность // Биохимия.-1986.-т.51, №4.- С.531-542
14.Ашмарин И.П., Обухова М.Ф. Содержание опиоидных пептидов в коре головного мозга и их центральная активность // Журн. высш. нервн. деят.- 1985.- т.36. - вып.2.-С.211-222.
15.Бабичев В.Н., Миронов С.Ф. Нейропептиды мозга и их нейроэндокринные эффекты // Проблемы эндокринологии. - 1981.- №3.-С.78-85.
16.Бахарев В.Д. Клиническая нейрофизиология регуляторных пептидов. - Свердловск: Издательство Уральского университета.- 1989.- 133с.
17.Белик Я.В., Гриренко А.Г. Распад белков в морфологически и функционально разных макро-и микроструктурных образованиях головного мозга.// Вопросы биохимии нервной и мышечной систем. - Тбилиси: Мецниереба. - 1979.- т.3.-С.105-113
18.Белоконь Л.Е. Особенности обмена нейропептидов гипоталамуса и гормонов гипофиза при стрессе и некрозе миокарда // дис. на соиск.степени канд.биол.наук. – Днепропетровск. - 1991
19.Беляев Н.А., Генгин М.Т., Годына С.В., Калихевич В.Н., Панченко Л.Ф. Активность энкефалинконвертазы в отделах мозга крыс при алкогольной интоксикации // Вопр. мед.химии.- 1988.-34, № 4.- С.118-122.
20.Беляев Н.А., Колесанова Е.Ф. и др. К вопросу о роли аминопептидаз в катаболизме энкефалинов: сравнение исследования регионального распределения аминопептидаз и энкефалиназы А в головном мозге крыс // Биохимия.- 1990.- 55, №10.-С.1778-1785.
21.Белякова Е.И. Взаимодействие симпато-адреналовой и гипоталамо-гипофизарно-надпочечниковой системы в инициальном периоде стресса // дис. на соиск.степени канд.биол.наук.- Ростов Н/Д.- 1984
22.Блехман Г.И. Синтез и распад макромолекул в условиях стресса // Усп.совр.биол. – 1992.-вып.2.- С.281-297.
23.Бобков А.И., Семавин И.Е., Виноградов В.А. и др. О значении лей-энкефалина в механизмах стрессорной реакции. // Тез. докл. Всесоюзн. Конфер. ’’Нейропептиды: их роль в физиологии и патологии’’.- Томск.- 1985.-С.161-162.
24.Боброва И.И. К вопросу о проницаемости гемато-офтальмического барьера при экспериментальном воспалении сосудистого тракта глаза // в кн. “Физиология и патология гисто-гематических барьеров”.- М.- Наука.-1968.- С.256-259
25.Богданов А.И., Филаретова Л.П., Филаретов А.А. Градуальность реакции гипофизарно-адренокортикальной системы на активирующий и тормозной сигналы // Физиол.журн. - 1982.- №6.- С. 804-808.
26.Бондаренко Т.И., Метаболизм гомокарнозина в мозгу животных разного возраста в экстремальных условиях среды // дис. на соискан. степени доктор биол.наук.- Ростов Н/Д. – 1990
27.Бондаренко Т.И., Кричевская А.А., Шейкина И.В., Кирюхина Е.В. Влияние ПДС на содержание адреналина в тканях крыс в норме и при действии холодового стресса // Укр. биохим.журн. - 1990.- т.62.- №5.- С.34-37.
28.Бондаренко Т.И., Милютина Н.П.., Михалева Н.И., Носкова Н.В. Мембраностабилизирующий эффект ?-сон индуцирующего пептида при стрессе // Бюл. Экспер.биол. и мед.- 1990. - № 9.- С.325-327.
29.Брагин Е.О. Нейрохимические механизмы регуляции болевой чувствительности // М.- Издательство университета дружбы народов.- 1991.- 248с.
30.Бредбери М. Концепция ГЭБ // М.- Медицина.- 1983.- 478с.
31.Булаев В.М, Раевский К.С. Взаимодействие опиатов и опиоидных пептидов с медиаторными системами мозга // Успехи физиол. наук.-1982.- т.13.-№2.-С.65-92.
32.Буров Ю.В., Ведерникрва Н.Н. Нейрохимия и фармакология алкоголизма // М.- Медицина.- 1985.-23с
33.Вакулина О.П. Содержание опиоидных пептидов в различных тканях животных при экстремальных воздействиях // дис. на соиск. степени канд.биол.наук.- М.-1984
34.Вальдман А.В., Арефолов В.А., Дмитриев А.Д. Изменение содержания опиоидных пептидов в надпочечниках крыс при иммобилизационном стрессе // Бюл.Экспер.Биол.и Мед. - 1985.- т.99.-№4.- С.404-406.
35.Вальдман А.В., Медведев О.С., Рожанская Н.И. Анализ роли эндогенных опиоидных пептидов при экспериментальной гипертензии // Физиол. журн.- 1982.- №8.-С.1091-1095.
36.Ведерников Н.Н., Майский А.И. Опиаты и эндогенные морфиноподобные пептиды // Усп.совр.биол. – 1981. – т.91.– С.380-392.
37.Вернигора А.Н. Карбоксипептидаза Н мозга животных в норме и при действии стресс-факторов // дис. на соиск. степени канд.биол.наук. – Днепропетровск. – 1991.
38.Вернигора А.Н, Генгин М.Т. Механизмы регуляции активности и биологическая роль карбоксипептидазы Н – фермента процессинга нейропептидов // Биохимия. – 1995. – т.60. - №12.- С.1491-1497.
39.Вернигора А.Н, Генгин М.Т. Протеолитические ферменты: субклеточная локализация, свойства и роль в обмене нейропептидов // Биохимия. – 1996. – т.61. - №5. – С.771-785.
40.Вернигора А.Н., Генгин М.Т. Свойства основных, отщепляющих остатки аргинина и лизина карбоксипептидаз и их роль в функционировании биологически активных пептидов // Укр. биохим. журн.- 1993.-т.65.-№1.-С.3-12.
41.Вернигора А.Н, Генгин М.Т. Эффект этанола на активность растворимой и мембраносвязанной КПН в областях головного мозга крыс в течение иммобилизационного стресса // Вопр. мед.химии. – 1994. – т.40. - №1.- С.54-56.
42.Вернигора А.Н, Генгин М.Т., Макарова В.В. Влияние стрессовых факторов на активность КПН в отделах головного мозга крыс // Укр. биохим.журн. – 1992. – т.64. - №2. – С.45-49.
43.Вернигора А.Н., Генгин М.Т., Никишин Н.Н. Об участии некоторых ферментов нейропептидов в механизмах эмоционального стресса // Физиол. журн.-1995.- т.81.- №5.- С.1025-1028
44.Вернигора А.Н., Генгин М.Т., Никишин Н.Н., Щетинина Н.В. Активность карбоксипептидазы N и ангиотензипревращающего фермента в сыворотке крови крыс с различной устойчивостью к эмоциональному стрессу //Физиол.журн.-1994.-№4.- С.23-25
45.Вернигора А.Н., Генгин М.Т., Никишин Н.Н., Щетинина Н.В. Активность растворимой и мембраносвязанной форм КПН в отделах головного мозга крыс при эмоциональном стрессе // Укр.биохим.журн.-1994.-т.66.-№4.-С.130-134
46.Вернигора А.Н, Никишин Н.Н, Генгин М.Т. Влияние внутрибрюшинного введения физиологического раствора на поведение крыс в тесте “открытое поле” и активность ферментов участвующих в обменен нейропептидов // Физиол. журн. - 1995.-т.81.-№12.-С.23-26
47.Вернигора А.Н., Никишин Н.Н., Генгин М.Т. Влияние глюкокортикоидов на активность растворимой и мембраносвязанной форм карбоксипептидазы Н in vivo // Укр.биохим.журн.-1995.-т.67.-№6.-С99-104
48.Вернигора А.Н, Никишин Н.Н, Генгин М.Т. Протеолитические ферменты и регуляция уровня активности нейропептидов // Биохимия. – 1995. – т.60. - №10. – С.1575-1579.
49.Вернигора А.Н, Никишин Н.Н, Генгин М.Т. Частичная характеристика основной ФМСФ-ингибируемой карбоксипептидазы из головного мозга кошки // Биохимия. – 1995. – т.60. - №11. – С.1423-1427.
50.Вернигора А.Н., Щетинина Н.В., Генгин М.Т. Исследование активности основных (отщепляющих остатки аргинина и лизина) карбоксипептидаз у крыс разного возраста // Биохимия. - 1997.- т.62.- вып.3.- С.1848-1856.
51.Власова Т.И., Каменский А.А., Ашмарин Н.П. Влияние энкефалинов на двигательную активность и поведение крыс в условиях “открытого поля” // Журн.высш.нервн.деят. – 1983. – т. 33. – вып.6. – С.1079-1084.
52.Воронцов Е.Я. Нарушение растяжимости и сократимости функций миокарда при ЭБС, их предупреждение и устранение // дис. на соиск. степени канд.биол.наук.- М. - 1985
53.Генгин М.Т. Новая КП нервной ткани. Региональное распределение и некоторые физико-химические свойства // Нервная система. – Л. – ЛГУ. – 1991.- С. 29-30
54.Генгин М.Т., Вернигора А.Н. Влияние этанола на активность карбоксипептидазы Н в мозге крыс. // Укр.биохим.журн. - 1993. – т.65. - №1. – С.100-103.
55.Генгин М.Т., Вернигора А.Н. Ферменты процессинга опиоидных пептидов и методы определения их активности // Укр.биохим.журн. – 1994. – т.66. - №2. – С.3-17.
56.Генгин М.Т., Вернигора А.Н., Никишин Н.Н. Влияние эмоционально-болевого стресса на активность КПН - фермента процессинга нейропептидов головного мозга крыс // Физиол. журн. - 1994.-80.-№3.- С.23-27.
57.Генгин М.Т., Вернигора А.Н., Никишин Н.Н., Керимов В.Ю. Эффект эмоционального стресса на активность карбоксипептидазы Н в отделах головного мозга крыс с различной к нему устойчивостью // Вопр.мед.химии.-1995.-т.41, №4.- С.8-9
58.Генгин М.Т., Вернигора А.Н., Никишин Н.Н., Макеева Н.В. Влияние каптоприла и резерпина на активность некоторых ферментов обмена нейропептидов. // Вопр.мед.химии. – 1995. – т.41. - №5. – С.37-39.
59.Герштейн Л.М., Доведова Е.Л., Узбеков М.Г., Галикова Т.Л., Сергубина А.В., Ашмарин И.П. Пролонгированное действие татрапептидамина, особенности обмена белков и медиаторов в отдельных микроструктурах мозга // Нейрохимия.- 1984.- т. 3.-№3.-С.236-243
60.Годына С.В. Протеолитические ферменты головного мозга при алкогольной интоксикации // дис. на соиск. степени канд.биол.наук.- Днепропетровск.- 1988
61.Голова И.Д. Влияние этанола на механизмы эмоционального стресса // Алкоголизм.- М.- 1989.- С.53-54
62.Гомазков О.А. Мозг и нейропептиды // Справочно-информационное издание.- М.-1997
63.Гомазков О.А. Роль ферментных систем в регуляции “триггерной” функции физиологически активных пептидов // Вопр.мед.химии. - 1988.- №1.- С.12-18.
64.Гомазков О.А. Функциональная биохимия регуляторных пептидов. - М.- Наука.- 1993.- 159с.
65.Гомазков О.А., Григорьянц О.О. Регуляция биосинтеза энкефалинов: биохимические и физиологические аспекты // Усп.совр.биол. – 1989. – т.108. - №1. – С.109-124.
66.Гомазков О.А., Калинина Е.В. Ангиотензинпревращающий фермент: бинарная активность. Ингибиторы и функциональная роль кининового звена // Усп. совр. биол.- 1997.-117.-№2.-С.172-183.
67.Гомазков О.А., Панфилов А.Д., Ростовцев А.П., Комиссарова Н.В., Фомин В.В., Григорьянц О.О. Региональная активность энкефалин-и-ангиотензин ІІ образующих пептидаз мозга у крыс с различным влечением к этанолу // Вопр.мед.химии. – 1991. – т.37. - №4. – С.33-37.
68.Григорьянц О.О. Гомазков О.А. Энкефалинобразующие ферменты // Вопр.мед.химии.- 1986.- №3.- С.15-20
69.Дворцин Г.Ф., Шаталов В.Н. Антистрессорный эффект даларгина при иммобилизационном стрессе у крыс // Бюл.Экспер.Биол.и Мед. - 1991.-111.-№6.- С.617-619.
70.Девяткина Т.А. Антиоксидантная система при стрессе и изыскание новых антистрессорных средств // дис. на соиск. степени док.мед.наук.- Киев.- 1990
71.Дмитриев А.Д. Биосинтез нейропептидов // Итоги наук. и техн. ВИНИТИ.-Физиология человека и животных.- 1982.-13.-С.7-49.
72.Дмитриев А.Д., Чиркова С.К., Дмитриева О.Ф., Теннов А.В., Шурин М.Р., Чирков А.М. Уменьшение содержания иммунореактивных ?- и ?-эндорфинов в крови и подавление их гиперсекреции под влиянием дексаметазона при эмоциональном стрессе у обезьян // Бюл. Экспер. Биол. и Мед.-1989.-57.-№5.-С.572-574
73.Елисеева Ю.Е., Барсукова И.С., Орехович В.Н. Обнаружение ингибиторов карбоксикатепсина (ангиотензин-I-превращающего фермента) в лейкоцитах человека // Докл. АН СССР.-1988.- 302.- С.992-994
74.Ельский В.Н., Сергеева Л.А., Самсоненко Р.А. Роль опиоидных пептидов в осуществлении функций гипоталамо-гипофизарно-надпочечниковой системы в норме и при шоке. // Тез.докл.всесоюзн.конференции “Нейропептиды: их роль в физиологии и патологии”. – Томск. – 1985. – С.53-54.
75.Енин Л.Д., Акоев Г.Н., Лебедев В.П., Потехина И.П. Воздействие опиоидных пептидов мозга на сенсорные окончания кожи как один из механизмов анальгетического эффекта. // В сб. докл. научн. конфер.”Физиологическое и клиническое значение регуляторных пептидов”. – Пущино. – 1990. – С.55-63.
76.Еремина С.А., Белякова Е.И., Кондрух Т.В. Роль катехоламинов различных классов в центральной регуляции гипоталамо-гипофизарно-адреналовой системы // Физиол. жур. им. Сеченова. - 1988.-№9.- С.1316-1320.
77.Еропкин М.Ю. Роль протеолиза в процессинге и инактивации нейропептидов: его возможная роль в некоторых функциях мозга // Усп.совр.биолог. - 1983.- 95.-№1.- С.65-67.
78.Ерошенко Т.М., Титов С.А., Лукьянова Л.Л. Каскадные эффекты регуляторных пептидов // Итоги наук. и техн. ВИНИТИ.-Физиология человека и животных .- 1991.- 46.- 203с.
79.Захарова О.Ю О модулирующем влиянии энкефалинов на реакции системы крови при иммобилизационном стрессе // дис. на соиск. степени канд.мед.наук. - Томск.- 1988
80.Иванова Т.М., Скоцеляс Ю.Г., Болякин В.И., Анохина И.П., Белова Т.И., Юматов Е.А., Судаков К.В. Устойчивость сердечно-сосудистой функции у крыс разных генетических линий в условиях эмоционального стресса // Жур.высш.нервн.деят.- 1979.-29.-№5.- С.1052 –1060
81.Игнатов Ю.Д. Гетерогенность опиоидных рецепторов мозга и свойства их лигандов. // В сб. ”Нейрофармакология. Регуляция болевой чувствительности”. – Л. – 1984. – С.9-93.
82.Ильюченок Р.Ю. Центральные эфекты фармакологических веществ и ГЭБ. // в кн. “Физиология и патология гисто-гематических барьеров”. – М. –Наука. – 1968. – С.179-186.
83.Исмайлова Х.Ю., Гасанов Г.Г и др. Исследовательское поведение в открытом поле и норковой камере крыс с различной предрасположенностью к стрессу // Бюл.Экспер. Биол.и Мед. - 1992.-114.-№8.-С.130-132.
84.Йохансон О., Хекфельд Т., Эльде Р.П., Шульценберг М., Террениус Л. Иммуногистохимическое распределение энкефалиновых нейронов // в кн. “Эндорфины” под ред. Коста Э., Трабука М.- М.- 1981.-С.61-79
85.Калинина Е.В., Позднев В.Ф., Комиссарова Н.В., Гомазков О.А. Влияние новых пептидных ингибиторов на соотношение ангиотензин I конвертирующей и кининдеградирующей активностей дипептидилкарбоксипептидазы (АПФ) // Биохимия. - 1997.- 62.- 3.- С.440-444.
86.Калюжный Л.В. Физиологические механизмы регуляции болевой чувствительности / М.- Медицина.- 1984.- 215с.
87.Каменская Л.Н., Кононенко В.А. Взаимодействие ренин-ангиотензиновой и энкефалинэргической систем мозга и гипофиза крыс в норме и при экспериментальной патологии гипоталамо-гипофизарно-надпочечниковой комплекса // Физиол.журн.- 1996.-82.-№4.- С.60-64.
88.Кассиль Г.Н. Некоторые аспекты современных представлений о ГЭБ. // в кн. “Физиология и патология гисто-гематических барьеров”. – М. – 1968. – С.170-178.
89.Клуша В.Е. Пептиды - регуляторы функций мозга .- Рига. - 1984.- с.
90.Кокс Т. Стресс // М.- Мир.- 1980.- 180с.
91.Кольдиц М. Участие ангиотензина ІІ в осуществлении отрицательных эмоциональных реакций. // Жур.высш нервн. деят. - 1985.-т.35.- С.280-287.
92.Коплик Е.В., Ведяев Д.Ф., Михалева И.И. Пептид дельта-сна как фактор вызывающий устойчивость животных к эмоциональному стрессу // тез. Докл. АН СССР.- 1982.-267.-№1.-С.230-234.
93.Корнева Е.А. Регуляторные пептиды как модуляторы защитных функций организма // Физиол.журн. –1989.-75, №5.- С. 656-665
94.Коробов Н.В. Даларгин – опиоидоподобный пептид периферического действия // Фармакология и токсикология.- 1988.- №4.-С.35-38
95.Костерлиц Т.В., Хьюс Д. Развитие концепций опиатных рецепторов и их лигандов // в кн. ”Эндорфины”, под ред. Коста Э., Трабукки М.- М.- Мир.- 1981.-С.43-55.
96.Кругликов Р.И., Диш Т.Н., Коштоянц О.Х. Макарова М.Ю., Пузырева Т.Г. О некоторых механизмах действия нейропептидов и их аналогов на процессы обучения и памяти. // Нейрохимия. – 1987. – т.6. - №6. – С.199-205.
97.Кузовков А.Г. Функциональное состояние ГЭБ и центральной нервной системы при воздействии некоторых экстремальных факторов // дис. на соиск. степени доктора мед. наук.– Л. – 1971
98.Лакин Г.Ф. Биометрия. - М.- Высшая школа.-1990.-352с.
99.Ламзина Н.А. Закономерности действия АПФ в иммобилизационном состоянии // дис. на соиск. степени канд.хим.наук.- М.-1990
100.Ласукова Т.В. Влияние опиоидных пептидов на функцию коры надпочечников в норме и при стрессе // дис. на соиск. степени канд.биол.наук.- Томск.-1991
101.Лишманов Ю.Б., Братцев Н.Ф., Ламбина С.А. Нейропептиды. Их роль в физиологии и патологии // Томск.-1985.-С. 92-93.
102.Лишманов Ю.Б., Маслов П.Н. Опиоидные нейропептиды, стресс и адаптационная защита сердца . – Томск. - 1994
103.Лишманов Ю.Б., Маслов П.Н., Крылатов А.В., Ускина Е.В. Роль эндогенных опиоидных пептидов в механизмах антиаритмического эффекта адаптации // Физиол.журн.-1996.-82.-№5-6.-С.56-59
104.Лишманов Ю.Б., Маслов П.Н., Ласукова Т.В. Роль опиоидной системы в адаптации организма и защите сердца при стрессе // Усп.физиол.наук. – 1997. – т.28. - №1. – С.75-97.
105.Лишманов Ю.Б., Маслов Л.Н., Титов М.И. О механизме антистрессорного действия Д-ала2-лей5-арг6-энк // Бюл. Экспер.Биол.и Мед.-1985.-№9.-С.268-270.
106.Лишманов Ю.Б., Маслова Л.В., Цибин А.Н., Трифонова Ж.А. Опиоидные пептиды и нейрогормональные реакции при стрессе и адаптации // Пат.физиология.- 1987.-№6.-С.51-53.
107.Лысенко А.В. Протеолитические процессы в мозге крыс при стрессе и адаптации, влияние d-сон индуцирующего пептида // дис. на соиск. степени канд.биол.наук.- Ростов Н/Д. -1993
108.Майзелис М.Я. ГЭБ и его регуляция. – М. – Медицина. – 1973. – 183с.
109.Майзелис М.Я., Заблудовский А.А., Шихов С.Н. Об участии циклических нуклеотидов в механизмах действия энкефалинов // Бюл.Экспер.Биол.и Мед.-1982.-№3.-С.33-35.
110.Малышенко Н.М., Ерошкин С.В. К механизму антистрессорного действия ПДС // Стресс, адаптация и функциональные нарушения.-Кишинев: Штиинца.- 1984.-С 84-85.
111.Малышенко Н.М., Попова Н.С. Гормоны и нейропептиды в интегративных процессах // Усп.физиол.наук.- 1990.-21.-№2.-С.94-110.
112.Маслов Л.Н., Лишманов Ю.Б., Нарыжная Н.В. Об участии различных типов опиатных рецепторов в механизмах стрессорного повреждения сердца // Физиол.журн.-1996.- 82, №5-6.-С.53-58
113.Масюк Т.В., Весельский С.Г., Масюк А.И. Влияние энкефалинов на секреторную функцию печени // Физиол.журн. – 1998.-84.-№4.- С.399-405
114.Машковский М.Д. Фармакология антидепрессантов / под ред. Машковского М.Д., Андреевой Н.И, Полежаевой А.И.- М.- Медицина.- 1983.- 240с.
115.Медведев О.С., Титов М.И. Опиоидные пептиды и регуляция сердечно-сосудистой системы. // Фармакология нейропептидов. - М.: Изд-во ин-та фармакологии.- 1982.-С.88-101.
116.Меерсон Ф.З., Пшенников М.Г. Адаптация к стресс-ситуации и физиологической нагрузке. - М.- Медицина. -1988.-25c.
117.Менджерицкий А.М., Маклецова М.Г. и др. Антистрессорный эффект ?-сон индуцирующего пептида при гипокинетическом стрессе // Укр.биохим.-1991.-63.-№1.-С.34-37.
118.Механизмы развития стресса // Сб.статей.- Кишинев: Штиинца.- 1987.-222с.
119.Митюшина Н.В. Влияние энкефалинов на активность ферментов обмена регуляторных пептидов в головном мозге и периферических тканях крыс // дис. на соиск. степени.канд.биол.наук.- Пенза.-1999
120.Наркевич В.Б. Ингибиторы эндогенных пептидаз мозга: антидепрессантные свойства и взаимодействие с нейромедиаторными системами мозга // дис. на соиск. степени канд.биол.наук. - М.-1995
121.Павлова В.И. Стресс-повреждение организма и его предупреждение метаболитами стресс-лимитирующих систем // дис. на соиск. степени доктора биол.наук.-Томск.-1990
122.Панин Л.Е. Биохимические механизмы стресса /Новосибирск.-Наука.-1983.-232с.
123.Пашутин С.Б. Синтетические пептиды биорегуляторы в обеспечении адаптации организма к экстремальным воздействиям // дис. на соиск. степени доктора биол.наук.-М.-1991
124.Подвигина Т.Т., Богданова Т.С., Филаретов А.А. Значение нейропептидов в изменении свойств гипоталамо-гипофизарно-адренокортикальной системы после стресса. // Физиол.журн. – 1992. – т.78. - №4. – С.149-154.
125.Пшенникова М.Т. Роль опиоидных пептидов в реакции организма на стресс // Пат.физиол. и экспер.терапия. – 1987. – вып.3. – С.85-90.
126.Раевский К.С. Эндогенные опиоидные пептиды как возможные нейропередатчики // в кн. “Опиоидные пептиды и их рецепторы”.- Итоги науки и техники ВИНИТИ.-1982.-№13.-С.185-200.
127.Ростовцев А.П., Григорьянц О.О., Гомазков О.А. Субстраты для исследования энкефалинобразующей карбоксипептидазы в мозге и надпочечниках крыс // Вопр.мед.химии.- 1988.-34, №1.-С. 126-129
128.Рочас С.В., Подвигина Т.Т. Изменение реакции гипофизарно-адренокортикальной системы на стрессор при многократном его повторении // Физиол.журн.- 1998.- т.84.- №12.- С.1386-1394
129.Саксон М.Е., Сафронова В.Г., Белоярцев Ф.Ф. Опиатные рецепторы сердца их роль в реализации ионотропных эффектов наркотических анальгетиков и опиоидных пептидов // Вестник АМН СССР.-1983.-№10.- С. 48-55
130.Салиева Р.М., Коплик Е.В., Каменов З.А., Полетаев А.Б. Влияние бета-эндорфина и пептида, вызывающего дельта сон, на устойчивостью к эмоциональному стрессу // Бюл. Экспер. Биол. и Мед.- 1989.-т.58.-№10.-С.464-465
131.Салиева Р.М. Яновский К. и др. ПВДС, как фактор повышающий содержание вещества Р в гипоталамусе и устойчивости крыс к эмоциональному стрессу // Журн.высш.нервн.деят.-1991.- т.41.- №3.-С.558-563.
132.Селье Г. Стресс без дистресса. – М. –Прогресс.– 1979.– 124с.
133.Сергеева М.Г. Кинетические закономерности рецептор-лигандного комплексообразования в механизме действия нейропептидов и морфина /М.-1995.-55с.
134.Слепушкин В.Д., Золоев Г.К., Виноградов В.А., Титов М.И. Нейропептиды, их роль в физиологии и патологии / Томск.- Изд-во Томского ун-та.- 1988.-143с.
135.Слепушкин В.Д., Лишманов Ю.Б., Золоев П.К., Прум И.А. Современные преставления о некоторых нетрадиционных механизмах стресса // Успехи физиол.наук.- 1985.-16.-№4.-С.422-424.
136.Судаков К.В. Нейрохимическая природа “застойного” возбуждения в структурах мозга при эмоциональном стрессе // Пат.физиол.и экспер.терапия.- 1995.- №1.- С.3-8.
137.Судаков К.С., Иванов В.Т., Бадиков В.И. и др. Механизмы антистрессорного действия ПВДС // Стресс, адаптация и функциональные нарушения.- Кишинев: Штиинца.-1984.-С356-357.
138.Тигранян Р.А. Гормонально-метаболический статус организма при экстремальных воздействиях / М.- Наука.- 1990.- 228с.
139.Тигранян Р.А. Реакция опиоидной системы головного мозга на стресс и ее зависимости от состояния катехоламинэргической системы // Нейрохимия.-1987.-6.-№1.-С.63-71
140.Тигранян Р.А., Вакулина О.П. Содержание энкефалинов и эндорфинов в различных отделах головного мозга крыс при стрессе // тез. 9 всесоюзн. конф. по биохимии нервной системы. – Ереван. – 1983. – С.321-372.
141.Ткаченко Л.Н. Отражение индивидуально-типологических свойств вегетативной нервной системы в характере вегетативных и поведенческих реакций при эмоционально-болевом стрессе // Бюл. Экспер. Биол. и Мед. – 1998. – т.126. - №12. – С.621-625.
142.Тонких А.В. Роль гипоталамо-гипофизарной области в реакциях организма при экстремальных (стрессорных) ситуациях // Усп.физиол.наук. – 1976. – т.7. - №2. – С.3-12.
143.Филаретов А.А., Богданов А.И., Ярушкина Н.И. Стресс-вызванная анальгезия. Роль гормонов гипофизарно-адренокортикальной системы // Физиол.журн.-1995.-81.-№2.-С.40-46.
144.Фурдуй Ф.И. Современные представления о физиологических механизмах развития стресса. // в кн. “Механизмы развития стресса”. – Кишинев. – “Штиинца”. – 1987. – С.8-33.
145.Фурдуй Ф.И. Физиологические механизмы стресса и адаптации при остром действии стресс-факторов // дис. на соиск. степени доктора биол. наук.-Л.-1987
146.Хайсман И.Д., Арефолов Ю.П. Роль периферических катехоламинергических систем в антистрессорном действии нейропептидов //Бюл. Экспер. Биол. и Мед.-1991.-№6. - С.328-333
147.Чайлдерс С.Р., Шварц Р., Койл Дж.Т., Снайдер С.Х. Радиоиммунологический тест на энкефалины. Содержание метионин-и лейцин-энкефалина в мозгу морфинозависимых и поврежденных каиновой кислотой крыс // в кн. “Эндорфины” под ред. Коста Э., Трабука М.- М.- 1981.-С.61-79
148.Шурин М.Р. Иммуномодуляторные свойства опиоидных пептидов // “Структура и функции иммунорегуляторных пептидов”.- Итоги науки и техн.- Иммунология. – М.-1988.-т.26.-с.168-173
149.Щетинина Н.В. Активность основных карбоксипептидаз в тканях и отделах мозга крыс в онтогенезе.// дис. на соиск. степени канд.биол.наук.–Пенза.– 1997
150.Эмоциональный стресс в условиях нормы и патологии человека / Л.- Медицина.- 1976.-223с.
151.Юматов Е.А. Пептидные факторы устойчивости к эмоциональному стрессу: теоретические и прикладные аспекты исследования // в сб. Матер. 1 Сов-инд. симпозиума “Нейрофизиология”.- М.-1983.-С.127.
152.Юматов Е.А., Гехт К., Скоцеляс Ю.Г. Субстанция Р как фактор устойчивости к эмоциональному стрессу // Журн. выс. нервн. деятельности.-1984.-34.-4.-С.771-777.
153.Юматов Е.А., Кириллова О.И., Поппай М., Ратеак Р. Содержание субстанции Р в гипоталамусе у устойчивых и предрасположенных к эмоциональному стрессу крыс // Журн. выс. нервн. деятельности.-1987.-37.-№2.-С.371-372.
154.Юханов Р.Ю., Рожанец В.В., Михалева И.И., Майский А.И. Анализ механизма стресс-протективного действия пептида, индуцирующего ?-фазу сна // Бюл. Экспер. Биол. и Мед.- 1990.- №1.- С.46-47.
155.Якушев В.С., Давыдов З.В., Бушева В.В. Белковый обмен в больших полушариях головного мозга при эмоционально-болевом стрессе // Укр.биохим.журн. – 1985. – вып.57. - №2. – С.15-18.
156.Янг Х.-Ю.Т., Хонг Дж.С., Фратта В., Коста Е. Энкефалины мозга крыс. Распределение и биосинтез // в кн.”Эндорфины”под ред. Коста Э., Трабукки М.- М.-1981.-С.155-164.
157.Ahmed M.S., Cemerikis B., Agbas A. Propepties and functions of human placental opioid system // Life Sci.-1992.-V.50, №2.-P.83-97
158.Akil H. Opiate tolerance and dependence: recent findings and synthesis. New.-Biol.1991.Oct. 3(10):915-23.
159.Armstrong J.D. Esbeshade K.L., Coffey M.T., Heimer E. Opioid control of growth hormone in the suckled sow is primarily mediated through growth hormon releasing factor // Domest –Anim –Endocrinol.- 1990.-Apr.-v.7, №2. – P. 191-198
160.Arregui A., Iversen L.L. Beta-lipotropin potently inhibisa purified angiotensin-conwerting enzyme from human brain // Biochem. Pharmacol.-1979.-v.28.- P.2693-2696
161.Axelrod J. – In.: Stress: The role of catecholamines and other neurotransmitters /Eds. E.Usdin, R.Kvetnansky, J.Axelrod. – V.1. - P.3-13, Gordon and Breach Science Publishers. N.Y. 1984.
162.Bado A., Roze C., Lewin M.J., Dubrasquet M. Endogenous opioid peptides in the control of food intake in cats //Peptides. – 1989, Sep.-Oct. – V.10. – N.5. – P.967-971.
163.Barry N., Jones, Alvin S. Stern, et al. Structure of Two-Adrenal Polypeptides. Containing Multiple Enkephalin Sequences //Arch. Biochemistry and Biophisics, 1980. – V.204, 1. – P.392-395.
164.Bauer A.I., Szurszewski I.H. Effect of opioid peptides on circular muscle of canine duodenum // J.Phisiol. – London. 1992. – Mar. 434: 409-22.
165.Belluzzi J.D., Grant N., Garsky V., Sarantalus D., Wise C.D., Stein L. Analgesia induced in vivo by central administration of enkephalin in rats // Nature. – London. 260, 625. – 1976.
166.Benter I.F., Hirsh E.M., Tuchman A.I., Ward P.E. N-terminal degradation of low molecular weight opioid peptides in human cerebrospinal fluid // Biochem. Pharmacol. – 1990. Aug. 40 (3): 465-72.
167.Bhargava H.N. Opioid peptides, receptors, and immune function / NIDA. Res. Monogr. – 1990. – V.96. – P.220-233.
168.Bloom F., Segal D., Ling N., Guillemin R. Endorphins: profound behaviaral factors in mental illeness // Science. – 1976. – V.194. – P.630-632.
169.Blum A.I. Interactions of ligands with the opiate receptors of brain membrans regulations by ions and nucleotids // Proc. Nat. Acad. Sci. US. – 1978. – V.75. – P.1713-1717.
170.Bunning P., Riordan F. Sulfate potentiation of the chloride activation of angiotensin-converting enzyme // Biochem. – 1987. – V.26. – P.3374-3377.
171.Camargo A.C. et.al. Brain endooligopeptidase A , a putative enkephalin converting enzyme // J. Neurochem.- 1987.-48, №4.- P. 1258-1263
172.Carr D.J. The role of endogenous opioids and their receptors in the immune system // Proc. Soc. Exp. Biol. Med. – 1991, Nov . – V.198. – N.2. – P.710-200.
173.Carr D.J., DeCosta B.R., Kim C.H., Jacobson A.E., Guarcello V., Rice K.C., Blalock I.E. Opioid receptors on cells of the immune system: evidence for delta and –kappa–classes // J. Endocrinol. – 1989, Jul. – V.122. – N.1. – P.161-168.
174.Chevillard C., Duchene N., Pasguir R., Alexander I.M. Relation of the centrally evoked pressor effect of angiotensin II to central noradrenaline in the rabbit // Europ. J. Pharmacol. 1979. – V.58. – P.202.
175.Cool D.R., Normant E., Shen F., Chen H.C., Pannell L., Zhang Y., Loh Y.P. Carboxypeptidase E is a regulated secretory pathway sorting receptor: genetic obliteration leads to endocrine disorders in Cpe(fat) mice // Cell. – 1997, Jan. 10. – V.88. – N.1. – P.73-83.
176.Cover P.O., Buckingham J.S. Effects of selective opioid-receptor blockade on the hypothalamo-pituitary-adrenocortical responses to surgical trauma in the rat // J. Endocrinol. – 1989, May. – V.121. – N.2. – P.213-220.
177.Covi G., Sheiban I., Gelmini G., Arcaro G., Tonni S., Bolner A., Piemonte G., Leãhi A. Left ventricular diastolic function during adrenergic stress in essential hypertension: acute and chronic effects of ACE inhibitiïn // Cardiovasc. Druggs. Ther. – 1996.- Jul. – V.10. – N.3. – P.321-329.
178.Ãuóhman D.W., Ondetti M.A., Gordon E.M. et al. Rational design and biochemical utility of specific inhibitors of angiotensin-cïnverting enzyme // J. Cardiovasc. Pharmacol. – 1987. – V.10. – Suppl.7. – P.17-30.
179.Cushman D.W., Wang F.L., Fung W.C. et al. Comparison in vitro, ex vivo, and in vivo of the actions of seven structurally diverse inhibitors of ACE // Brit. I. Clin. Pharmacol. 1989. – V.28. – P.115-131.
180.Demmer W., Brand R. Processing and degradation of Met-enkephalin by peptidase associated with rat brain cortical synaptosomes / Proteasey potential role in health and disease. Prot. Int. Symp. Wirsburg. 17-20 Oct. – 1982. P.165-177.
181.Duggan A.W. Enkephalins as transmitters in the central nervous system // Cire Res. – 1980. – V.46. – N.6. – Suppl.1. – P.149-1-153.
182.Ehlers M.R., Riordan I.E. Angiotensin-converting enzyme: new concepts concerning its biological role // Biochem. – 1989. – V.28. – N.3. – P.5311-5318.
183.Erdos E.G., Skidgel R.A. The angiotensin-I-converting enzyme // Lab. Invert. – 1987. – V.56. – P.345-348.
184.Ernst A., Schulz P., Schoenenberger G.A. Cirdadian variation of DSIP – like immunoreactivity in human plasma / Sleep research. Brain information service. Brain research institute University of California. Los Angeles. – 1987. – V.16. – P.609.
185.Evans C. et al. Opioid peptides in the adrenal pituitary axes // Psychopharm. Bull. – 1985. – N.3. – P.446-471.
186.Fricker L.D. Activation and membrane binding of carboxypeptidase E // J. Cell Biochem. – 1988. – V.38. – P.279-289.
187.Fricker L.D. Carboxypeptidase E // Ann. Rev. Physiol. – 1988. – V.50. – P.309-321.
188.Fricker L.D. Neuropeptide biosynthesis: focus on the carboxypeptidase processing enzyme // Trends Neurosci. – 1985. – V.8. – N.5. – P.210-214.
189.Fricker L.D. Peptide – processing exopeptidases: amino- and carboxypeptidases involved with peptide biosynthesis / Peptidal biosynthesis and processing. – Florida, 1991. – P.199-230.
190.Fricker L.D., Berman Y.L., Leiter E.H., Devi L.A. Carboxypeptidase E activity is deficient in mice with the fat mutation. Effect on peptide processing // J. Biol. Chem. – 1996, Nov. 29. – V.271. – N.48. – P.30619-30624.
191.Fricker L.D., Reaves B.J., Das D., Dannies P.S. Comparison of the regulation of carboxypeptidase E and prolactin in CH4G1 cells, a rat pituitary cells line // Neuroendocrin.-1990.- 51, №6.- P. 658-663
192.Fricker L.D., Snyder S.H. Enkephalin convertase: purification and characterization of a specific enkephalin-synthesizing carboxypeptidase localized to adrenal chromaffin granules // Proc. Natl. Acad. Sci. USA. – 1982. – 79. – P.3886-3890.
193.Fricker L.D., Snyder S.H. Purification and characterization of enkephalin convertase, an enkephaline-synthesizing carboxypeptidase // J. Biol. Chem. – 1983. – V.258. – N.18. – P.10950-10955.
194.Fricker L.D., Supattapone S., Snyder S.H. Enkephalin convertase: a specific enkephalin synthesizing carboxypeptidase in adrenal chromaffin granules. Brain and pituitary gland // Life Sci. – 1982. – V.31. – P.1841-1844.
195.Gainer H., Russel J.T., Loh Y.P. The enzymology and intracellular organization of peptide precursor processing: the secretory vesicle hypothesis // Neuroendocrin. – 1985. – 40. – P.171-184.
196.Ganten D., Minnich J.L., Grander P. Et al. Angiotensin-forming enzyme in brain tissue // Ibid. – 1971. – V.173. – P.64-65.
197.Gerendaei I. Modulation of testicular functions by testicular opioid peptides // J. Physiol. Pharmacol. . – 1991, Dec. – 42. – N.4. – P.427-437.
198.Gibson A., Hart S., Shabib A. Leucinoenkephalin and methionine-enkephalin produce opposing effects on plasma corticosterone levels in ether-stressing mice //Brit. J. Pharmacol. – 1989. – V.70. – P.509-511.
199.Gorelic D.A., Larlin D.H., George R., Li C.H. β-endorphin is behaviorally active in rats after chronic intravenous administration // Pharmacol. Biochem. Behav. – 1978. – V.9. – N.3. – P.385-386.
200.Graf M., Kastin A.I. Delta-Sleep-Induãing Peptide (DSIP): A review // Neurosci. and Biobehav. Rev. – 1984. – V.8. – N.12. – P.83-93.
201.Graf M., Schenenberger G.A. Delta-Sleep-Inducing Peptide Modulates the Stimulation of Rat-Pineal N-Acetyltransferase Activity bi Ivolving the α1-Adrenergetic Reception // J. Neurochemistry. – 1987. – V.48. – N.4. – P.1252-1257.
202.Gregg D., Goedken E., Gaikin M., Wendell D., Gorski J. Decreased expression of carboxypeptidase E protein is correlated to estrogen-induction of rat pituitary tumors // Mol. Cell. Endocrinol. – 1996, Mar., 25. – V.117. – N.2. – P.219-225.
203.Guest P.C. et.al. Molecular heterogeneity and cellular localization of carboxypeptidase H in the islets of Langerhans // Endocrinology.- 1991.-129, №2.- P.734-740
204.Harmar A. J. Neuropeptides // Transm. Mol. In the brain. – 1987. – 2. – P.17-26.
205.Hook Y.J.H., Eiden L.E. Two peptidases that convert 125J-Lys-Arg-(Met)-enkephalin, 125J-enkephalin-Arg6 and respectively, to 125J-(Met)-enkephalin in bïvine adrenal medullary chromaffin granules // FEBS Lett. – 1984. – 172. – N.2. – P.212-218.
206.Hook V.Y.H., Eiden L.E., Pruss R.M. Selective regulation of carboxypeptidase peptide hormone-processing enzyme during enkephalin biosynthesis in cultured bovine anrenomedullary chromaffin cells // J. Biol. Chem. – 1985. – 260. N.10. – P.5991-5997.
207.Hook V. Y.H., LaGamma E.F. Product inhibit of carboxypeptidase H // J. Biol. Chem.- 1987.-v.262.- № 26.-P. 12583-12588
208.Hook V.J.H., Mezey E., Fricker L.D., Pruss R.M., Siegel R.E., Brownstein M.J. Immunochemical characterization of carboxypeptidase B-like peptide-hormone-processing enzyme // Proc. Natl. Acad. Sci. USA. – 1985. – 82. – P.4745-4749.
209.Hooper N.M. Ançiotensin converting enzyme implications from molecular biology for its physiological functions // Int. J. Biochem. – 1991. – V.23. – N.7-8. – P.641-647.
210.Hooper N.M., Turner A.J. Isolation of two differentially glycosylated from of peptide-dipeptidases A (ACE) from pig brain: a reevaluation of teiner role in neuropeptide-metabolism // Biochem. 1987.-241, №15.-P.1455-1463
211.Hughes J., Smith T.W., Kosterlitz H. Wetal Identification of two related pentapeptides from the brain with potent opiate agonist activity // Nature. – 1975. – V.258. – N.5536. – P.577-579.
212.Hui K.-S., Lajlha A. Neuropeptidases / Handbook of Neurochemistry. – New York and London, 1983. – V.4. – P.1-19.
213.I’Hereault S., Barden N. Regulation of proopiomelanocortin messenger RNA – concentrations by opioid peptides in primary all cultures of rat hypotalamus // Mol. Brain. Res. 1991. - 10 (2). – P.115-121.
214.Jankovic B.D., Radulovic I. Enkephalins, brain and immunity: modulation of immune responses by methionine–enkephalin injected into the cerebral cavity // Int. J. Neurosci. – 1992, Nov-Dec. – V.67. – N.1-4. – P.241-270.
215.Jiang Z.G., North R.A. Pre- and postsynaptic inhibition by opioids in rat striatum // J. Neurosci. – 1992, Jan. – V.12. – N.1. – P.356-361.
216.Junkinz G. Changes of pain threshold aften stress-possible involvement of endogenous opiates // Arzeneimittel Forscheeng Drug. Res. – 1980. – V.30-2. N.8. – P.1237-1238.
217.Kastin A.Y., Nissen C., Coy D.H. DSIP – like immunoreactivity in the developing rat brain // Brain. Res. Bull. – 1981. – 7. – P.687-690.
218.Khanna A.S., Waisman D.M. Metabolism and intracellular processing of protein hormones /Hormones and their actions. Part 1. / Eds. B.A.Cooke et al. – Amsterdam, 1988. – P.117-132.
219.Khawaja X.Z., Green J.C., Thorpe J.R. The occurence and receptor specificy of endogenous opioid peptides within the pancreas and liver of the rat / Comporison with brain // J. Biochim.-1990.-Apr.1.- 267, №1.P. 233-240
220.Kramer T.H., Toth G., Haaseth R.C., Matsunage T.O., Davis P., Hruby V.I., Burks T.F. Influence of peptidase inhibitors on the apparent agonist potency of delta celective opioid peptides in vitro // Life Sci. – 1991. – V.48. – N.9. – P.881-6.
221.Krieger D.T. Brain peptides: what, where and why? // Science. – 1983. – V.222. – N.462. – P.975-985.
222.Lansillo J.J., Stevens J., Dazaratty Y., Yotsumoto H., Fanburg B.L. Angiotensin-converting enzyme from human tessues, physicochemical, catalitic and immunological properties // J. Biol. Chem. – 1985. – V.260. – N.28. – P.14938-14944.
223.Lantz I., Thornwall M., Kihlstrom J.E., Nyberg F. A comparison of human lung, brain, CSF and plasma angiotensin-converting enzyme with regard to neuropeptide metabolism // Biochem. Int. – 1992, Mar. – V.26. – N.3. – P.415-426.
224.Lanzillo J.J., Stevens J., Dararatty Y. et.al. Angiotensin-converting enzyme from human tessues, physicochemical, catalic and immunological properties // J. Biol. Chem.-1985.-260, №28.-P.14938-14944
225.Ling N., Burdus R., Guillemin R. Isolation primary structure and synthesis of α-endorphin and γ-endorphin, two peptides of hypothalamic hypophysial origin with morphinomimetic activity // Proc. Nat. Acad. Sci. USA. – 1976. – V.73. – P.3942-3943.
226.Loe K.S., Frank S., Vanderklish P. Et al. Inhibitions of proteolisis protect hyppocampal neurons from ischemia // Proc. Nat. Acad. Sci. USA. – 1991. – V.88. – N.16. – P.7233-7237.
227.Loh Y.P., Birch N.P., Castro M.G. Pro-opiomelanocortin and provasopressin converting enzyme in pituitary secretory vesicles // Biochemie.-1988.-70, №1.-P.11-16
228.Loh M.H.., Theng L.F., Wei E., Li C.H. β-endorphin as a potent analgetic agent /Proc. Nat. Acad. Sci. USA. - 1976. – V.73. – N.8. – P.2895-2898.
229.Lynch D.R., Snyder S.H. Neuropeptides. Multiple molecular forms. Metabolic pathways and receptors // Anme. Rev. Biochem.-55.- Calif.Alto.-1986.- P.773-799
230.Lynch D.R., Vanable J.C., Snyder S.H. Enkephalin convertase in the heart similar disposition to atrial natriuretic factor // Endocrinology.- 122, № 6.- P.2683-2691
231.Mains R.E., Eipper B.A. Secretion and regulation of two biosyntetic enzyme activities, peptidil-glycine α-amidating monooxygenase and a carboxypeptidase, by mouse pituitary corticotropic tumor cells // Endocrinology.- 1984.-115, №5.-P.1683-1690
232.Makara G.B., Palrovits M., Szentagothai J. The endocrine hypothalamus and the hormonal response to stress /Selyes guide to stress research. / Selye H. (eds.). – New York: Van Nostrand Reinhold Co. – 1980. – P.280-337.
233.McDomald J.K., Schwabe C. Intracellular exopeptidases /Proteinases in Mammalian Cells and Tissues / Barrett A.I. (eds.). – Amsterdam: Elsevier /North Holland Biomedical Press. – 1977. – P.311-391.
234.Mentein R., Roos T. Proteases involved in the metabolism of angiotensin II, bradykinin, calcitonin gene-related peptide (CGRP), and neuropeptide Y by vascular smooth muscle cells // Peptides. – 1996. – V.17. – N.4. – P.709-720.
235.Meunier J.C. The opiad peptides and their receptors // Biochemie.- 1986.-68.- P.1153-1158
236.Millan M.J., Emrich H.M. Endorphinegric system and the response to stress //Psychother. Psychosomat. – 1981. – V.36. – N.1. – P.43-56.
237.Mulder A.H., Wardeh G., Hogenbom F., Frankhuyzen A.L. Selectivity of various opioid peptides toward delta-kappa-and mu-opioid receptors mediating presinaptic inhibition of neurotransmitter release in the brain // Neuropeptides.- 1989.-Aug-Sep.-14, №2.- P.99-104
238.Nakamura M., Kamata R., Jnour H., Inaba M. Effects of opioid peptides administration in conscious rats on the changes in blood adrenaline levels caused by immobilization stress // Jap. J. Pharmacol. – 1989. – V.50. – N.3. – P.354-382.
239.Nicolarakis K.E., Almeida O.F., Yassouridis A., Herz A. Presynaptic auto- and allelo-receptor regulation of hypothalamic opioid peptide release // Neurosci. – 1989. – V.31. – N.73. – P.269-273.
240.North R.A., Williams J.T. How do opiates inhibit neurotransmitter release //Trends. Neurosci. – 1983. – V.6. – N.8. – P.337-339.
241.Oehme P. Substance P: Regulatory functions // Wiss. Beitz. M.-luther Univ. Hall-Wittenberg P.- 1988.- 32.- P. 179-190
242.Olson G.A., Olson R.D., Kastin A.J. Endogenous opiates 1985 // Peptides. – 1986. – V.7. – N.5. P.907-933.
243.Patterson T.A., Schulteins G., Alvarado M.C., Martinez J.L.-J.R., Bennet E.L., Rossenzweig M.R., Hruby V.Y. Influence of opioid peptides on learningand memory process in the chick // Behav.-Neurosci.-1989.-Apr.-103, №2.- P.429-437
244.Przewlocki R. et.al. Gene expression and lokalization of opioid peptides in immune cells of inflamed tissue: functional role in antinoception // Neurosci.-1992.-48, №2.- P.491-500
245.Rakudi H., Yu H., Kamitani A., Nakamura Y., Ohishi M., Kamide K., Nakata Y., Takami S., Higaki J., Ogihara T. Links between hypertension and myocardial infarction // Am. Heart. J. – 1996, Jul. – V.132. – N.1. – P.213-221.
246.Rodrigues C., Brayton K.A., Brownstein M., Dixon J.E. Rat preprocarboxypeptidase H: cloning, characterisation and sequence of the cDNA and regulation of the mRNA by corticotropin-releasing factor // J. Biol.Chem. –1989.- v.264.-P.5988-5995
247.Rossier J., Battenberg E., Piffman Q. et al. Hypothalamic enkephalin neurons may regulate the neurohypophysis // Nature. – 1979. – V.277. – P.653-655.
248.Roth W.W., Mackin R.B., Spiess J., Goodman R.H., Noe B.D. Primary structure and tissue distribution of angelerfish carboxypeptidase H // Mol. Cell Endocrinol. – 1991. – V.78. – N.3. – P.171-178.
249.Rothman R.B., Bycov V., Xue B.G., Xu H., De-Costa B.R., Jacobson A.E., Rice K.C., Kleinman J.E., Brady L.S. Interaction of opioid peptides and other drugs with miltiple kappa receptors in rat and human brain / Evidence for species differences //Peptides. – 1992, Sep.-Oct. – V.13. – N.5. – P.977-987.
250.Ryoichi K., Reiko S., Takshi K. et.al. Hydrolysis of neo-kyotophin (Thr-Ser-Lys-Tyr-Arg) and [met]enkephalin – Arg6-Phe7 by ACE from moncey brain // Biochem. Pharmakol.-1986.-35, №24.- P.4499-4503
251.Schmieder R.E., Schobel H.P., Gatzka C.E., Hauser W., Dominik P., Mann J.F., Luft F.C. Effects of angiotensin converting enzyme inhibitor on renal heamodynamics during mental stress // J. Hypertens. – 1996, Oct. – V.14. – N.10. – P.1201-1207.
252.Seredenin S.B., Blednov Y u A., Badysktov B.A. Pharmacogenetic analyses of mechanisms of emotional stress: effects of benzodiazepines // Ann. Inst. Super. Sanitc. – 1990. – V.26. – P.81.
253.Simantov R., Showman A.M., Synder S.V. A morphine – like factor enkephalin in rat brain subcellular localization // Brain Res. – 1976. – V.107. – P.650-657.
254.Simon E.J. Opioid receptors and Endogenous opioid peptides // Med. Res. Rev. – 1991. – V.11. – N.4. – P.357-374.
255.Skeggs L.T., Jr.Kahn J.R., Shumway N.P. The preparatia and function of hypertensin cïnverting enzyme // J. Exp. Med. – 1956. – V.103. – P.295.
256.Skidgel R.A. Basic carboxypeptidases: regulators of peptide hormone activity //Trends Pharmacol. Sci. – 1988. – V.9. – N.8. – P.299-304.
257.Skidgel R.A., Jonson A.R., Evda E.G. Hydrolisys of opioid hexapeptides by carboxypeptidase N. Presenc of carboxypeptidase in cell membranes // Biochem. Pharmacol. – 1984. – V.33. – N.21. – P.3471-3478.
258.Snyder S.H. Brain peptides as neurotransmitters // Science. – 1980. – V.209. – P.976-983.
259.Soffer R.L., Ei-Dorry H.A. Angiotensin-converting enzyme: immunological, structural and developmental aspects // Federation Proc.-1983.-P.2735-2739
260.Stanisz A.M., Scicchitano R., Payan D., Bienestock J. In vitro studies of immunoregulation by substance P and somatostatin / Second Intern. Workshop on NIM: Scientific Programme and Abstracts. – Dubrobnik, 1986. – P.37.
261.Stein E.A., Hiller J.M., Simon E.R. Effect of stress on opioid receptor binding in the rat central nervous system // Neurosci. – 1992, Dec. – V.51. – N.3. – P.683-690.
262.Steiner D.F. The biosynthesis of biologically active peptides: a perspective / Peptide Biosynthesia and processing /Frisker L.D. (eds.). – CRC Press. – Boca Ration. – Florida, 191. – P.1-16.
263.Strittmater S.M., Lynch D.R., Snyder S.H. (3H)guanidinoethyl merkaptosuccinic acid binding to tissue homogenates selective labeling of enkephalin convertase // J. Biol. Chem.- 1984.- 259, №19.- P.11812-11817
264.Supattapone S., Frisker L.D., Snyder S.H. Purification and characterization of membranebound enkephalin-forming carboxypeptidase “enkephalin convertase” // J. Neurochem. – 1984. – V.42. – N.4. – P.1017-1023.
265.Taub D.D., Eisenstein T.K., Geller E.B., Adler M.W., Rogers T.J. Immunomodulatory activity of mu – and Rappa-selective opioid agonists // Proc. Natl. Acad. Sci. USA. – 1991, Jan., 15. – V.88. – N.2.
266.Terenius L. Opioid peptides, pain and stress // Prog. Brain Res. – 1992.- 92.-P. 375-383
267.Tezapsidis N., Parish D.C. Characterizatoin and partial purificatoin of a novel prohormone processing enzyme from bovine adrenal medulla // FEBS Lett.-1989.-246, №1.-P. 44-48
268.Turner A.I. Neuropeptide processing enzymes // Trends. Neurosci.- 1984.-7, №7.- P.258-260
269.Van-Giersbergen P.L., Cox-Van-Put J., De-Jong W. Central and peripheral opiate receptors appear to be activated during controlled haemorrhagic hypotension // J. Hypertens. Suppl. – 1989, Dec. – V.7. – N.6. – P.26-27.
270.Vernicos-Danellis J., Heyback J.P. Psychophysiologic mechanismus regulating the hypothalamic-pituitary-adrenortical response to stress / Selyes guide to stress research /Eds. Selye H. – New York: Van Nostrand Reinhold Co., 1980. – P.206-251.
271.Viel E., Lefrant J.Y., Aya G., Eledjam J.J. Opioids by the perimedullary route: mechanisms of opioid analgesia // Cah. Anesthesiol. – 1991. – V.39. – N.1.
272.White J.D., Gall C.M. Proenkephalin is prozessed in a projectionspecific monner in the rat central nervous system // Proc. Nat. Acad. Sci. USA. Biol. Sci.-1986.- 83, №18.- P. 7099-7103
273.Yukimura T., Under T., Rascher W. Central peptidergic stimulation in blood pressure control: role of enkephalins in rats // Clin. Sci.-1981.-61, №7.-P.3475-3505
ПРИЛОЖЕНИЕ
Таблица 1. Активность КПН, ФМСФ-ингибируемой КП и АПФ у интактных животных (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М ± m, n = 5-6, здесь и в таблицах 2-7: Г - гипофиз, СМ - средний мозг, ГТ – гипоталамус, ГК – гиппокамп, СТ – стриатум, БП – большие полушария, НП – надпочечники, СЕ - семенники)
| Отделы мозга, органы | КПН | ФМСФ – ингибируемая КП | АПФ |
| M±m | M±m | M±m | |
| Г | 1,54±0,01 | 1,36±0,08 | 0,53±0,06 |
| СМ | 0,22±0,02 | 0,31±0,03 | 0,05±0,02 |
| ГТ | 0,24±0,02 | 0,33±0,03 | 0,06±0,01 |
| ГК | 0,28±0,03 | 0,33±0,03 | 0,01±0,001 |
| СТ | 0,18±0,01 | 0,34±0,03 | 0,19±0,03 |
| БП | 0,18±0,01 | 0,35±0,02 | 0,03±0,01 |
| НП | 0,1±0,02 | 1,84±0,1 | 0,01±0,01 |
| СЕ | 0,06±0,01 | 0,3±0,04 | 0,53±0,03 |
Таблица 2. Активность КПН, ФМСФ-ингибируемой КП и АПФ в мозге и тканях крыс при воздействии острого ЭБС (нМ продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М±m, n=5, *- p<0,05, **- p<0,01, ***- p<0,001 к норме, здесь и в таблицах 3-7: I – отдел мозга, орган, II – время после начала воздействия)
| I | II | КПН | ФМСФ-инг. кп | АПФ | |||
| норма | ЭБС | норма | ЭБС | норма | ЭБС | ||
| Г | 0,5 ч. 4 ч. 24 ч. 72 ч. 240 ч. | 1,54±0,08 | 2,2±0,23** 1,87±0,1* 2,02±0,08** 2,37±0,12*** 1,39±0,05 | 1,36±0,07 | 1,18±0,14 1,26±0,06 1,46±0,06 1,67±0,05** 1,45±0,07 | 0,53±0,06 | 0,48±0,03 0,38±0,06** 0,53±0,05 0,58±0,04 0,46±0,04 |
| СМ | 0,5 ч. 4 ч. 24 ч. 72 ч. 240 ч. | 0,22±0,01 | 0,23±0,01 0,18±0,01* 0,22±0,01 0,22±0,01 0,21±0,01 | 0,31±0,02 | 0,27±0,02 0,29±0,01 0,3±0,02 0,37±0,01* 0,34±0,02 | 0,05±0,02 | 0,05±0,01 0,02±0,01 0,02±0,01 0,04±0,01 0,02±0,01 |
| ГТ | 0,5 ч. 4 ч. 24 ч. 72 ч. 240 ч. | 0,24±0,02 | 0,28±0,02 0,20±0,01 0,24±0,01 0,27±0,03 0,23±0,02 | 0,33±0,01 | 0,31±0,02 0,31±0,01 0,32±0,02 0,4±0,01** 0,34±0,01 | 0,06±0,01 | 0,01±0,01 0,03±0,0,1 0,02±0,01 0,04±0,01 0,04±0,01 |
| ГК | 0,5 ч. 4 ч. 24 ч. 72 ч. 240 ч. | 0,28±0,03 | 0,26±0,01 0,19±0,01** 0,27±0,01 0,29±0,02 0,25±0,02 | 0,33±0,02 | 0,29±0,01 0,32±0,01 0,35±0,03 0,42±0,02** 0,34±0,01 | 0,01±0,01 | 0,04±0,02 0,02±0,01 0,01±0,01 0,04±0,01 0,03±0,01 |
| СТ | 0,5 ч. 4 ч. 24 ч. 72 ч. 240 ч. | 0,18±0,01 | 0,18±0,02 0,2±0,01 0,26±0,01** 0,24±0,03* 0,18±0,01 | 0,34±0,03 | 0,31±0,03 0,33±0,02 0,32±0,01 0,4±0,02 0,34±0,01 | 0,19±0,02 | 0,13±0,02 0,15±0,01** 0,15±0,01 0,18±0,02 0,19±0,01 |
| БП | 0,5 ч. 4 ч. 24 ч. 72 ч. 240 ч. | 0,18±0,02 | 0,21±0,01 0,18±0,02 0,19±0,01 0,24±0,01* 0,198±0,01 | 0,35±0,02 | 0,32±0,01 0,35±0,01 0,34±0,01 0,55±0,01*** 0,37±0,03 | 0,03±0,01 | 0,02±0,01 0,01±0,00 0,01±0,00 0,02±0,01 0,01±0,00 |
| НП | 0,5ч 4ч 24ч 72ч 240ч | 0,1±0,02 | 0,08±0,01 0,06±,002 0,06±0,02 0,09±0,01 0,1±,02 | 1,84±0,05 | 1,72±0,09 1,62±0,05* 1,46±0,09** 2,88±0,04** 1,75±0,02 | 0,01±0,01 | 0,02±0,01 0,03±0,01 0,02±0,01 0,01±0,01 0,02±0,02 |
| СЕ | 0,5ч 4ч 24ч 72ч 240ч | 0,06±0,01 | 0,07±0,01 0,07±0,02 0,07±0,02 0,05±0,01 0,06±0,01 | 0,3±0,02 | 0,45±0,01* 0,3±0,01 0,31±0,02 0,27±0,01 0,25±0,02 | 0,53±0,03 | 0,59±0,01* 0,45±0,03* 0,47±0,01*** 0,41±0,01 0,51±0,02 |
Таблица 3. Активность КПН, ФМСФ-ингибируемой КП и АПФ в мозге и тканях крыс при введении лей-энкефалин-арг (нМ продукта, образовавшегося за 1 мин инкубации на 1 мг белка, М±m, n=5, звездочками показана достоверность: *- p<0,05, **- p<0,01, ***- p<0,001 к норме)
| I | II | КПН | ФМСФ-инг. КП | АПФ | |||
| НОРМА | ЛЕЙ-ЭНК-АРГ | НОРМА | ЛЕЙ-ЭНК-АРГ | НОРМА | ЛЕЙ-ЭНК-АРГ | ||
| Г | 0,5ч 4ч 24ч 72ч 240ч | 1,54±0,01 | 3,89±0,18*** 3,26±0,08*** 2,53±0,14* 2,74±0,20 2,80±0,09 | 1,36±0,08 | 2,72±0,28*** 1,87±0,07** 1,49±0,09 1,88±0,23* 1,72±0,12 | 0,53±0,06 | 0,83±0,08** 0,66±0,04** 0,64±0,07* 0,53±0,12* 0,44±0,06* |
| СМ | 0,5ч 4ч 24ч 72ч 240ч | 0,22±0,02 | 0,47±0,01*** 0,35±0,01** 0,30±0,01* 0,30±0,03* 0,25±0,01 | 0,31±0,03 | 0,62±0,03*** 0,54±0,04** 0,35±0,02 0,41±0,03* 0,33±0,01 | 0,05±0,02 | 0,05±0,02 0,07±0,04 0,04±0,01 0,03±0,01 0,06±0,01 |
| ГТ | 0,5ч 4ч 24ч 72ч 240ч | 0,24±0,02 | 0,49±0,02*** 0,36±0,01* 0,34±0,02* 0,31±0,01 0,32±0,01 | 0,33±0,03 | 0,76±0,03*** 0,50±0,03-* 0,37±0,02 0,42±0,01* 0,39±0,03 | 0,06±0,01 | 0,11±0,02** 0,01±0,01 0,04±0,01 0,05±0,01 0,01±0,01 |
| ГК | 0,5ч 4ч 24ч 72ч 240ч | 0,28±0,02 | 0,57±0,01*** 0,36±0,02* 0,33±0,02 0,39±0,02 0,34±0,02 | 0,33±0,02 | 0,69±0,04*** 0,35±0,02 0,35±0,03 0,38±0,02 0,41±0,01 | 0,01±0,0 | 0,05±0,03 0,03±0,01 0,04±0,01 0,06±0,02 0,01±0,01 |
| СТ | 0,5ч 4ч 24ч 72ч 240ч | 0,18±0,01 | 0,43±0,02*** 0,28±0,01 0,31±0,01*** 0,31±0,01 0,25±0,02 | 0,34±0,03 | 0,64±0,04*** 0,44±0,03 0,40±0,04 0,42±0,01 0,41±0,01 | 0,19±0,02 | 0,31±0,01*** 0,20±0,01* 0,17±0,01 0,18±0,01 0,17±0,03 |
| БП | 0,5ч 4ч 24ч 72ч 240ч | 0,18±0,02 | 0,32±0,01*** 0,22±0,01 0,25±0,01* 0,24±0,02* 0,26±0,01 | 0,35±0,02 | 0,51±0,02*** 0,37±0,02 0,33±0,02 0,44±0,02 0,43±0,02 | 0,03±0,01 | 0,04±0,01 0,02±0,01 0,01±0,01 0,01±00,1 0,01±0,01 |
| НП | 0,5ч 4ч 24ч 72ч 240ч | 0,1±0,02 | 0,25±0,04*** 0,20±0,02*** 0,23±0,01** 0,18±0,02 0,12±0,02 | 1,84±0,05 | 5,24±0,3*** 4,43±0,17*** 2,18±0,03 2,33±0,11 2,31±0,08* | 0,01±0,01 | 0,04±0,02 0,01±0,01 0,03±0,01 0,01±0,01 0,02±0,02 |
| СЕ | 0,5ч 4ч 24ч 72ч 240ч | 0,06±0,01 | 0,12±0,01*** 0,12±0,02*** 0,13±0,02*** 0,12±0,02*** 0,06±0,01 | 0,3±0,02 | 0,20±0,03* 0,26±0,01 0,20±0,06 0,22±0,02 0,25±0,02 | 0,53±0,02 | 1,15±0,16*** 0,78±0,07*** 0,67±0,03*** 0,61±0,03 0,34±0,03 |
Таблица 4. Влияние лей-энкефалин-арг на активность КПН, ФМСФ-ингибируемой КП и АПФ in vitro (в % от контроля, контроль 100%)
| ОТДЕЛ | КПН | ФМСФ- ингибир. КП | АПФ |
| Гипофиз | -27 | -7 | -24 |
| Большие Полушария | -13 | -8 | -44 |
| Надпочечники | -50 | 0 | -100 |
Таблица 5. Активность КПН при введении лей-энкефалин-арг на фоне острого ЭБС (*- p<0,05, **- p<0,01, ***- p<0,001).
| I | II | Норма | ЭБС | ЭБС+ лей-энк-арг | К норме | К ЭБС |
| Г | 0,5 ч 4 ч 24 ч 72 ч 240 ч | 1,54±0,08 | 2,2±0,23 1,87±0,1 2,02±0,08 2,37±0,12 1,39±0,05 | 1,75±0,11 1,74±0,29 1,86±0,13 2,17±0,27 1,36±0,07 | * ** | ** |
| СМ | 0,5 ч 4ч 24ч 72ч 240ч | 0,22±0,01 | 0,23±0,01 0,18±0,01 0,22±0,01 0,22±0,01 0,21±0,01 | 0,26±0,02 0,24±0,02 0,19±0,02 0,23±0,02 0,17±0,02 | ** | |
| ГТ | 0,5ч 4ч 24ч 72ч 240ч | 0,24±0,02 | 0,28±0,02 0,21±0,02 0,24±0,01 0,27±0,03 0,23±0,02 | 0,27±0,02 0,28±0,01 0,25±0,01 0,23±0,02 0,21±0,01 | * | ** |
| ГК | 0,5ч 4ч 24ч 72ч 240ч | 0,28±0,03 | 0,26±0,01 0,19±0,01 0,27±0,01 0,29±0,02 0,25±0,02 | 0,28±0,02 0,31±0,02 0,28±0,02 0,29±0,01 0,24±0,02 | ** | |
| СТ | 0,5ч 4ч 24ч 72ч 240ч | 0,18±0,01 | 0,18±0,02 0,2±0,01 0,26±0,01 0,24±0,03 0,18±0,01 | 0,23±0,01 0,24±0,02 0,19±0,02 0,25±0,02 0,17±0,01 | *** ** ** | ** ** |
| БП | 0,5ч 4ч 24ч 72ч 240ч | 0,18±0,02 | 0,21±0,01 0,18±0,02 0,19±0,01 0,24±0,01 0,18±0,01 | 0,22±0,02 0,24±0,02 0,23±0,03 0,21±0,01 0,17±0,01 | * | ** |
| НП | 0,5ч 4ч 24ч 72ч 240ч | 0,1±0,02 | 0,08±0,01 0,06±0,02 0,06±0,02 0,09±0,01 0,1±0,02 | 0,08±0,02 0,13±0,03 0,06±0,03 0,13±0,03 0,03±0,01 | *** | |
| СЕ | 0,5ч 4ч 24ч 72ч 240ч | 0,06±0,01 | 0,07±0,01 0,07±0,02 0,07±0,02 0,05±0,01 0,06±0,01 | 0,09±0,02 0,09±0,01 0,08±0,02 0,07±0,01 0,06±0,01 | ** ** |
Таблица 6. Активность ФМСФ-ингибируемой КП при введении лей-энкефалин-арг на фоне острого ЭБС (*- p<0,05, **- p<0,01, ***- p<0,001).
| I | II | Норма | ЭБС | ЭБС+ лей-энк-арг | К норме | К ЭБС |
| Г | 0,5 ч 4 ч 24 ч 72 ч 240 ч | 1,36±0,08 | 1,18±0,14 1,26±0,06 1,46±0,06 1,67±0,05 1,45±0,07 | 1,72±0,11 1,25±0,12 1,31±0,12 1,24±0,08 1,39±0,14 | * | * ** |
| СМ | 0,5 ч 4ч 24ч 72ч 240ч | 0,31±0,02 | 0,27±0,02 0,29±0,01 0,3±0,02 0,37±0,01 0,34±0,02 | 0,38±0,03 0,36±0,03 0,31±0,02 0,27±0,01 0,33±0,02 | ** * *** | |
| ГТ | 0,5ч 4ч 24ч 72ч 240ч | 0,33±0,01 | 0,31±0,02 0,31±0,01 0,32±0,02 0,4±0,01 0,34±0,01 | 0,4±0,02 0,43±0,03 0,29±0,02 0,39±0,05 0,33±0,02 | * ** | * ** |
| ГК | 0,5ч 4ч 24ч 72ч 240ч | 0,33±0,02 | 0,29±0,01 0,32±0,01 0,35±0,03 0,42±0,02 0,34±0,01 | 0,4±0,02 0,37±0,03 0,31±0,02 0,38±0,02 0,36±0,03 | * | ** |
| СТ | 0,5ч 4ч 24ч 72ч 240ч | 0,34±0,03 | 0,31±0,03 0,33±0,02 0,32±0,01 0,4±0,02 0,34±0,01 | 0,41±0,02 0,37±0,03 0,31±0,02 0,35±0,03 0,33±0,02 | * | |
| БП | 0,5ч 4ч 24ч 72ч 240ч | 0,35±0,02 | 0,32±0,01 0,35±0,01 0,34±0,01 0,55±0,01 0,37±0,03 | 0,44±0,03 0,4±0,04 0,33±0,02 0,39±0,02 0,36±0,03 | * | ** *** |
| НП | 0,5ч 4ч 24ч 72ч 240ч | 1,84±0,05 | 1,72±0,03 1,62±0,05 1,43±0,09 2,88±0,04 1,75±0,02 | 2,08±0,07 2,02±0,17 1,48±0,05 2,01±0,09 1,81±0,08 | * ** | * ** |
| СЕ | 0,5ч 4ч 24ч 72ч 240ч | 0,3±0,02 | 0,36±0,01 0,3±0,01 0,31±0,02 0,27±0,01 0,25±0,02 | 0,27±0,03 0,41±0,03 0,37±0,02 0,39±0,01 0,38±0,03 | ** * ** * | ** * ** |
Таблица 7. Активность АПФ при введении лей-энкефалин-арг на фоне острого ЭБС (*- p<0,05, **- p<0,01, ***- p<0,001 ).
| I | II | Норма | ЭБС | ЭБС+ лей-энк-арг | К норме | К ЭБС |
| Г | 0,5ч 4ч 24ч 72ч 240ч | 0,53±0,06 | 0,48±0,03 0,38±0,06 0,53±0,03 0,58±0,04 0,46±0,04 | 0,66±0,1 0,41±0,06 0,72±0,06 0,71±0,06 0,4±0,08 | * | *** |
| СМ | 0,5ч 4ч 24ч 72ч 240ч | 0,05±0,02 | 0,04±0,01 0,05±0,01 0,05±0,01 0,04±0,01 0,05±001 | 0,06±0,01 0,05±0,01 0,06±0,01 0,05±0,01 0,05±0,01 | ||
| ГТ | 0,5ч 4ч 24ч 72ч 240ч | 0,06±0,01 | 0,05±0,02 0,05±0,01 0,06±0,01 0,05±0,01 0,05±0,01 | 0,04±0,02 0,,5±0,01 0,05±0,01 0,06±0,01 0,06±0,01 | ||
| ГК | 0,5ч 4ч 24ч 72ч 240ч | 0,01±0,01 | 0,02±0,01 0,01±0,01 0,01±0,01 0,02±0,01 0,01±0,01 | 0,01±0,01 0,03±0,02 0,02±0,01 0,01±0,01 0,01±0,01 | ||
| СТ | 0,5ч 4ч 24ч 72ч 240ч | 0,19±0,02 | 0,16±0,03 0,13±0,01 0,15±0,01 0,18±0,02 0,19±0,01 | 0,17±0,01 0,18±0,01 0,15±0,02 0,22±0,02 0,16±0,03 | * | |
| БП | 0,5 ч 4 ч 24 ч 72 ч 240 ч | 0,03±0,01 | 0,02±0,01 0,02±0,01 0,03±0,01 0,03±0,01 0,03±0,01 | 0,02±0,01 0,03±0,01 0,03±0,01 0,02±0,01 0,03±0,01 | ||
| НП | 0,5ч 4ч 24ч 72ч 240ч | 0,01±0,01 | 0,01±0,01 0,01±0,01 0,02±0,01 0,01±0,01 0,02±0,01 | 0,01±0,01 0,02±0,01 0,02±0,01 0,01±0,01 0,01±0,01 | ||
| СЕ | 0,5ч 4ч 24ч 72ч 240ч | 0,53±0,02 | 0,61±0,01 0,45±0,03 0,47±0,01 0,41±0,01 0,51±0,02 | 0,41±0,04 0,59±0,05 0,58±0,02 0,58±0,04 0,47±0,03 | * ** ** ** |
Похожие работы
... нервной и эндокринной регуляции в организме // Усп. совр. биол. – 1981. – 19, № 3. – С. 380-382. 23. Вернигора А.Н., Бардинова Ж.С., Сметанин В.А., Генгин М.Т. Активность основных карбоксипептидаз в тканях самок крыс на разных стадиях эстрального цикла // Укр. биохим. журн. – 2003. – 75, № 5. – С. 99-102 24. Вернигора А.Н. Карбоксипептидаза Н мозга животных в норме и при действии стресс- ...
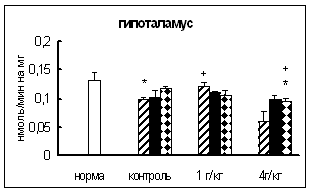
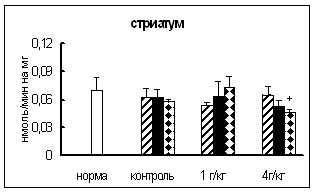

0 комментариев