Навигация
ОБМЕН РЕГУЛЯТОРНЫХ ПЕПТИДОВ
1.2. ОБМЕН РЕГУЛЯТОРНЫХ ПЕПТИДОВ.
1.2.1. Биогенез нейропептидов.
Выделяют два возможных пути образования нейропептидов [55, 89]. Один из них нерибосомальный, биосинтез при этом осуществляется с участием специфических ферментов-синтетаз. Другой путь связан с рибосомами, локализованными на мембранах шероховатого эндоплазма-тического ретикулума. В этом случае нейропептиды синтезируются в организме в виде неактивных высокомолекулярных предшественников, которые преобразуются в активную форму в результате ограниченного протеолиза [71, 229, 268]. Более детальное изучение молекулярно-биологических характеристик опиоидных пептидов позволило установить некоторые закономерности их образования. Так к настоящему времени показано существование трех высокомолекулярных белковых предшественников, которые являются источниками всех известных опиоидных пептидов: проопиомеланокортин, проэнкефалин и продинорфин [268]. Каждый из них закодирован отдельным геном в молекуле ДНК [268].
Для всех нейропептидов характерно наличие ряда общих особенностей в структуре и процессинге препропептидов :
n наличие с N-конца сигнальной последовательности, состоящей из 15-20 остатков гидрофобных аминокислот. Функция ее состоит в обеспечении транслокации синтезируемого пептида через мембраны шероховатого эндоплазматического ретикулума (ЭПР) [71, 268]. В полости ЭПР отщепление этой последовательности осуществляется при участии эндоолигопептидазы - сигнальной пептидазы, которая специфична для определенной последовательности гидрофобных аминокислот [268];
n в структуре предшественников, биологически активные пептиды ограничены парами остатков аргинина и лизина, по которым происходит расщепление [71,268], причем расщепление может происходить не по всем парам остатков основных аминокислот. В связи с этим следует предполагать наличие многообразия и высокой специфичности эндопептидаз к участкам расщепления;
n предшественники нейропептидов могут содержать несколько копий различных пептидов. Например, проопиомеланокортин содержит в своей структуре последовательности мет-энкефалина, адренокортикотропина, a-меланотропина, b-липотропина и b-эндорфина, причем в разных отделах один и тот же предшественник может стать источником различных активных пептидов. Это характерно, например, для предшественника энкефалина в мозге и надпочечниках [272].
Эндопептидазы процессинга представляют собой достаточно большую группу ферментов [171, 203, 227, 267]. На основе их субстратной специфичности выделяют следующие группы:
1) эндопептидазы специфичные для пар остатков основных аминокислот (сериновые, аспартильные, тиоловые);
2) эндопептидазы, расщепляющие связи при единичных остатках основных аминокислот (тиоловые, металлопептидазы);
3) эндопептидазы, расщепляющие пропептиды не по основным остаткам аминокислот (тиоловые, металлопептидазы );
4) высокомолекулярные мультиферментные протеазы;
Следует отметить, что некоторые из эндопептидаз обладают очень узкой субстратной специфичностью, что важно для генеза структур пептидной природы.
Результатом действия эндопептидаз являются неактивные пептиды, содержащие со стороны С- или N-конца остатки аргинина или лизина, которые затем удаляются экзопептидазами с карбоксипептидаза-Б- и аминопептидаза-Б-подобной активностью [208, 229, 268]. Образующиеся в результате биологически активные пептиды, под влиянием какого-либо стимула выбрасываются из клетки либо в кровяное русло, либо в синаптическую щель и мигрируют к клеткам-мишеням, где происходит их связывание со специфическими рецепторами.
По локализации ферменты обмена нейропептидов делят на две большие группы [48]:
1. Ферменты секреторных везикул и эндоплазматического ретикулума (карбоксипептидаза Н (Кф 3.4.17.10), аминопептидаза-В-подобный фермент и др). Эти ферменты участвуют в образовании активных форм нейропептидов.
2. Ферменты вневизикулярной локализации – внеклеточной жидкости и внешней поверхности цитоплазматических мембран – ангиотензинпревращающий фермент (Кф 3.4.15.1), карбоксипептидаза N (Кф 3.4.12.7), различные аминопептидазы и др. Роль ферментов вневизикулярной локализации состоит не только в образовании активных форм нейропептидов, то есть процессинге, но и в инактивации нейропептидов.
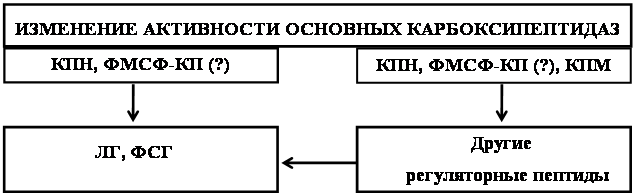
Таким образом, основную роль в регуляции уровня активных нейропептидов, а, следовательно, и в запуске реакций их биологического действия, играют ферменты конечной стадии процессинга и инактивации [189, 209]. Особого внимания в этой связи заслуживают основные КП, поскольку эти ферменты участвуют не только в конечной стадии образования активных пептидов, но и в начальных стадиях их деградации.
Ключевую роль в генезе нейропептидов мозга играет КПН - фермент секреторных везикул, отщепляющий остатки аргинина и лизина с С-конца неактивных пептидов [187, 193, 195, 248]. Известно, также, что данный фермент может участвовать в начальных стадиях инактивации активных пептидов, содержащих остатки основных аминокислот с С-конца молекулы [40, 248].
Недавно в лаборатории нейрохимии Пензенского государственного педагогического университета им. В.Г.Белинского в растворимой фракции серого вещества головного мозга кошки была обнаружена новая экзопептидаза, отщепляющая остатки аргинина с С-конца синтетических аналогов энкефалинов [49, 53]. Активность этой основной КП полностью ингибировалась фенилметилсульфонилфторидом (ФМСФ), в связи, с чем фермент был назван ФМСФ-ингибируемой КП [49]. Особенности тканевого и регионального распределения фермента позволяют отнести ФМСФ-ингибируемую КП, к ферментам, которые наряду с КПН вовлекается в обмен регуляторных пептидов [48, 53].
Известно, что важную роль в обмене таких биологически активных пептидов как энкефалины, ангиотензины, АКТГ, ПВДС, вещество Р и др. играет ангиотензинпревращающий фермент (АПФ), участвующий не только в процессинге, но и в инактивации активных форм пептидов [180, 182, 183]. В последнее время особое внимание исследователей обращено на исследование АПФ мозга.
Ниже представлены сведения о физико-химических свойствах этой группы ферментов.
КАРБОКСИПЕПТИДАЗА Н (Кф 3.4.17.10).
Карбоксипептидаза Н (КПН, энкефалинконвертаза, КПЕ) была впервые выделена из хромаффинных гранул надпочечников быка Fricker и Snyder в 1982 году [192, 193]. Позднее КПН была обнаружена и выделена из различных органов и тканей [191, 194, 203, 206, 230]. При этом было показано, что каталитические и физико-химические свойства КПН из различных источников были достаточно близки.
Фермент является гликопротеином и состоит из одной полипептидной цепи, максимальную активность проявляет при рН 5,6-6,0, что соответствует рН внутри секреторных гранул, Мr50-55кДа [40, 192, 193]. Показано также, что КПН является тиолзависимым металлоферментом, в активном центре которого находится Zn2+ [189]. Фермент активизируется ионами Co2+ и Ni2+, ингибируются ЭДТА, реагентами на сульфгидрильные группы и органическими кислотами, в состав которых входят амино- или гуанидиновые группы при последнем атоме углерода (GEMSA- гуанидилэтилмеркаптоянтарная кислота, GPSA - гуанидинопропилянтарная кислота, APMSA – аминопропилмеркапто-янтарная кислота и 2 меркапт- 3 гуанидинтиопропановая кислота) [256].
Предложены различные методы определения активности КПН. Наиболее широко применяется метод Fricker и Snyder [194], с использованием дансилированных трипептидов – дансил-фен-ала-арг и дансил-фен-лей-арг – в качестве субстратов. Для определения активности КПН предложены также даларгин [127], лей5-энкефалин-арг6 [127], [3Н]-бензоил-фен-лей-арг [247], [3Н]-бензоил-фен-ала-арг [247]. Количественное определение КПН в тканях производится методом связывания [3Н]ГЭМЯК [263].
Согласно первоначальным исследованиям фермент представлен в организме двумя формами - растворимой и мембраносвязанной, которые отличаются по величине Мr [187, 193, 205, 264], значение которой для мембраносвязанной формы выше. Такое отличие связывали с наличием у мембраносвязанной формы С-концевой “якорной” последовательности, состоящей из 15-20 гидрофобных аминокислотных остатков, основное назначение которой состоит в обеспечении рН - зависимой ассоциации КПН с мембранами. Показано также, что активность мембраносвязанной КПН намного меньше активности растворимой формы данного фермента [189, 264]. Было выдвинуто предположение, что фермент, связанный с мембранами секреторных гранул, является предшественником растворимой формы КПН и превращается в нее в результате протеолитического расщепления связи c C-конца у основания “якорной” последовательности. Показано, что при этом активность фермента возрастает в 2-3 раза [186]. По мнению ряда авторов, такое различие в активностях мембраносвязанной и растворимой форм КПН может быть связано ассоциацией менее активной формы с компонентами мембран [71], что ставит под сомнение гипотезу о зависимости активности мембраносвязанной формы от наличия гидрофобной “якорной” последовательности.
В дальнейшем было обнаружено, что фермент, связанный с мембраной секреторных гранул отличается от растворимой формы не только по величине Мr, но и по локализации. Так в хромаффинных гранулах надпочечников, в мозге, передней и промежуточной доле гипофиза преобладает растворимая форма КПН, а мембраносвязанная форма локализована преимущественно в задней доле гипофиза [37, 40, 186]. В связи с этим, было высказано предположение, что описанные формы КПН участвуют в процессинге различных по своей функциональной роли пептидов: растворимая КПН принимает участие преимущественно в образовании секреторных пептидов, в то время как мембраносвязанная форма участвует процессинге пептидов, обладающих местным действием [40, 65].
Тканевая, региональная, клеточная и субклеточная локализация фермента была изучена с применением флюориметрических и радиометрических методов определения активности КПН. Наиболее высокая активность КПН обнаружена в хромаффинных гранулах надпочечников, аденогипофизе и островках Лангерганса поджелудочной железы [191, 194, 203, 206]. Более низкая - в задней доле гипофиза, стриатуме, гипоталамусе, гиппокампе, среднем мозге, коре больших полушарий [37, 149, 194]. Самая низкая активность КПН отмечена в стволовой части головного мозга, спинном мозге, сердце, легких, желудочно-кишечном тракте, печени и почках [149]. Установлено, что фермент локализован в хромаффинных гранулах надпочечников, нейронах мозга, содержащих вещество Р, энкефалины и другие нейропептиды, гормон-продуцирующих клетках гипофиза, a- и b- клетках островков Лангерганса поджелудочной железы, продуцирующих инсулин и глюкагон [189, 192, 194, 248, 256]. Данные о субклеточной локализации КПН показали, что фермент ассоциирован со структукными элементами комплекса Гольджи, ЭПР и секреторными везикулами, где осуществляется процессинг предшественников биологически активных пептидов [195].
Первоначально КПН была описана как фермент, участвующий в образовании энкефалинов из их предшественника, однако данные последующих исследований показали участие его в процессинге многих нейропептидов: глюкагона, инсулина, пролактина, вещества Р, вазопрессина и окситоцина и других регуляторных пептидов [38, 175, 187, 190].
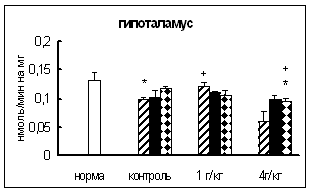
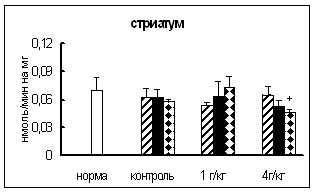
Ряд экспериментальных исследований показал, что КПН вовлекается в ответ организма на воздействие различных факторов, таких как стресс [37, 42, 45, 56, 57, 64], введение in vivo этанола [19, 54, 60, 67], резерпина, диазепама [58] и др.
ФМСФ-ИНГИБИРУЕМАЯ КАРБОКСИПЕТИДАЗА.
ФСМФ-ингибируемая КП впервые была обнаружена в растворимой фракции серого вещества головного мозга котов [49]. Фермент имеет Мr в пределах 100-110 кДа, максимальная активность фермента проявляется при рН 6,0 - 6,5, однако она сохраняется и при рН 5,5, что соответствует рН внутри секреторных везикул [49, 53]. Активность данного фермента полностью ингибируется ФМСФ и п-хлормеркурийбензоатом, 2-меркаптоэтанол, ГЭМЯК, ЭДТА и N-этилмалеимид не оказывали влияния на активность ФСМФ-ингибируемой КП. Полученные сведения об отсутствии влияния хелатирующих агентов, а также специфических ингибиторов металлозависимых КП на активность ФСМФ-ингибируемой КП, свидетельствуют о том, что данный фермент не является металлозависимым. Показано, что активность фермента изменяется в присутствии ионов некоторых металлов, так ионы Zn2+ сильно подавляют активность ФСМФ-ингибируемой КП, что, вероятно связано с их влиянием на стабильность данного фермента. Литературные данные свидетельствуют также об увеличении активности ФСМФ-ингибируемой КП в присутствии NaCl, Na2SO4, NaBr, что позволяет использовать их для повышения стабильности исследуемого фермента в растворах [49].
По субстратной специфичности ФСМФ-ингибируемая КП сходна с КПН и КПN: отщепляет остатки основных аминокислот с С-конца соответствующего субстрата [49, 53]. Однако в отличие от КПН, предпочтительными субстратами для которой являются пропептиды содержащие в качестве предпоследних остатки глицина и аланина, ФСМФ-ингибируемая КП, обладает большим сродством к тем субстратам, у которых остатку основной аминокислоты предшествует лейцин и метионин [53, 119]. Так показано, что величина Кm для гидролиза дансил-фен-лей-арг ФСМФ-ингибируемой КП приблизительно равна 48 мкМ, а для дансил-фен-ала-арг – 96 мкМ [49].
По своим физико-химическим свойствам фермент сходен с лизосомальной КПА (Кф 3.4.16.1), однако есть отличия по субстратной специфичности и, возможно, субклеточной локализации [49, 53, 233]. Данные о тканевом и региональном распределении ФМСФ-ингибируемой КП хорошо коррелируют с данными для КПН, что позволяет предположить участие данного фермента в процессинге предшественников биологически активных пептидов и секретируемых белков [49, 50, 149]. Так отмечено, что активность ФСМФ-ингибируемой КП в гипофизе - отделе, где синтезируются пептидные гормоны - значительно выше, чем в отделах центральной нервной системы, что, вероятно, свидетельствует об участии данного фермента в процессинге предшественников этих гормонов. Наиболее высокая активность ФСМФ-ингибируемой КП в мозге показана в обонятельных долях и сером веществе – отделах, образованных телами нейронов [49, 149]. Активность фермента в отделах с высоким содержанием проводящих путей (больших полушариях, варолиевом мосте и продолговатом мозге) значительно ниже [149]. Полученные данные позволили выдвинуть предположение, что активность ФСМФ-ингибируемой КП преимущественно связана с телами нейронов. Высокая активность ФСМФ-ингибируемой КП обнаружена также в тканях, связанных преимущественно с деградацией белка (почки, селезенка) [149]. В связи с этим, не исключается возможность вовлечения ФМСФ-ингибируемой КП в катаболизм белков или инактивацию биологически активных пептидов.
Таким образом, вопрос о биологической роли ФСМФ-ингибируемой КП до сих пор остается открытым. Имеющийся ряд предположений, может быть подтвержден или опровергнут только в результате исследований влияния на ее активность факторов, которые вызывают уже известные перестройки в метаболизме, например, стресс-воздействие, введение различных биологически активных веществ. Интересным, для выяснения биологической роли, представляется также сравнение активности ФСМФ-ингибируемой КП с другими КП, биологические функции которых известны.
АНГИОТЕНЗИНПРЕВРАЩАЮЩИЙ ФЕРМЕНТ (Кф 3.4.15.1).
Ангиотензинпревращающий фермент (АПФ, дипептидилкарбоксипептидаза, пептидил дипептидаза А) впервые был выделен Скеггом и соавт. из сыворотки крови лошади [255]. В настоящее время известно, что АПФ достаточно широко представлен в различных органах и тканях организма: в эндотелии кровеносных сосудов легких, мозга, сердечной ткани, в сыворотке крови, Т-лимфоцитах, фибробластах, в эпителиальных клетках почек, плаценты, кишечника, репродуктивных органах [182, 196, 209, 223, 259].
По структуре АПФ представляет собой мембраносвязанный гликопротеин, состоящий из одной большой полипептидной цепи, активируется ионами Сl-, NO3- ,SO42- [66, 170], ингибируется 2-меркаптоэтанолом [66].Детальное изучение физико-химических свойств данного фермента способствовало созданию ряда высокоспецифических ингибиторов, первым из которых стал каптоприл [178]. Сегодня известно по крайней мере семь ингибиторов АПФ – это эналаприл, лизиноприл, рамиприл, цилазаприл, фосфоприл и др. [179], проявляющих характерную селективность по отношению к АПФ различной тканевой локализации
Согласно современным представлениям АПФ существует виде двух изоформ: “соматической”, сосредоточенной на поверхности эндотелиальных, эпителиальных и нейроэпителиальных клеток и “репродуктивной”, найденной в семенной жидкости большинства млекопитающих [182, 183]. “Соматическая” форма АПФ имеет молекулярную массу 170кДа и включает С- и- N-гомологичные домены, обладающие энзиматической активностью. “Репродуктивная” форма имеет молекулярную массу около 100кДа и соответствует С-домену первой формы [182].
Известно, что АПФ участвует в отщеплении С-концевого гистидиллейцина от декапептида ангиотензина I и превращении его в физиологически активный октапептид ангиотензин II [209, 222, 234, 259]. Кроме того, АПФ участвует в деструкции брадикинина, пептида, функциональное действие которого противоположно действию ангиотензина II, путем последовательного удаления двух С-концевых дипептидов [66, 222, 234]. Таким образом, АПФ проявляет двойственную функцию в отношении основных субстратов - брадикинина и ангиотензина I.
Началом нового направления в исследовании роли АПФ в организме послужили работы Гантен и др., которые обнаружили в ткани мозга весь спектр компонентов ренин-ангиотензиновой системы – ангиотензиногена, ангиотензина I, ангиотензина II и АПФ [196]. АПФ был найден в мозге в телах и аксонах нервных клеток, в гипофизе, базальных ганглиях и черной субстанции [183, 210]. Обнаруженное соответствие между региональным распределением АПФ и ряда нейропептидов в мозге позволило предположить, что АПФ участвует не только в метаболизме ангиотензинов и кининов. Сегодня известно, что АПФ может гидролизовать такие функционально активные пептиды, как мет-энкефалин, нейротензин, b-эндорфин, вещество Р, b-цепь инсулина (в этих превращениях АПФ действует еще и как эндопептидаза), играя роль одного из регулирующих факторов в обмене этих биологически активных веществ [180, 182, 183]. Обнаружено также, что АПФ может участвовать в процессинге энкефалинов, гидролизуя энкефалинсодержащие пептиды - мет-энк-арг6-фен7 в мет-энкефалина и мет-энк-арг6-глу7-лей8 в мет-энк-арг6 [250]. Окончательно роль АПФ в мозге еще не выяснена.
Таким образом, в настоящее время первоначальное определение АПФ как фактора, связующего калликреин-кининовую и ренинангиотензиновую системы крови несколько расширено. Показано, что АПФ участвует в регуляции работы сердца, почек, уровня артериального давления крови, иммунной и репродуктивной системы, связан с метаболизмом нейротрансмиттеров [180, 182, 183, 209, 223, 224, 251, 259]. Кроме того, известно, что ангиотензинпревращающий фермент вовлекается в ответ организма на воздействие стресс-факторов различной природы [64, 99]. В настоящий момент особое внимание исследователей обращено на создание возможных методов регуляции активности АПФ при различных физиологических и патологических состояниях организма.
Похожие работы
... нервной и эндокринной регуляции в организме // Усп. совр. биол. – 1981. – 19, № 3. – С. 380-382. 23. Вернигора А.Н., Бардинова Ж.С., Сметанин В.А., Генгин М.Т. Активность основных карбоксипептидаз в тканях самок крыс на разных стадиях эстрального цикла // Укр. биохим. журн. – 2003. – 75, № 5. – С. 99-102 24. Вернигора А.Н. Карбоксипептидаза Н мозга животных в норме и при действии стресс- ...

0 комментариев