Навигация
ОПИОИДНЫЕ ПЕПТИДЫ ПРИ ВОЗДЕЙСТВИИ СТРЕССОРНЫХ ФАКТОРОВ
1.3. ОПИОИДНЫЕ ПЕПТИДЫ ПРИ ВОЗДЕЙСТВИИ СТРЕССОРНЫХ ФАКТОРОВ.
В числе актуальных проблем современной биологии и медицины все большее внимание уделяется проблеме стресса. Такой интерес к изучению этого вопроса обусловлен многими факторами, в числе которых постоянное ускорение темпов жизни, шум, урбанизация, которые, так или иначе, воздействуют на организм человека и животных, провоцируя развитие стресса. Достаточно сильное и продолжительное действие стресс-факторов может стать причиной различных функциональных нарушений и патологий [4, 90].
Определение стресса как “неспецифической реакции организма на любое требование извне”, данное Г.Селье [132], а также предложенная им концепция развития стресс-реакции, подверглись критическому анализу со стороны многих ученых. Сегодня, стресс рассматривается как совокупность общих, неспецифических биохимических, физиологических и психических реакций организма, возникающих в ответ на действие чрезвычайных раздражителей различной природы и характера, обеспечивающих мобилизацию организма в целях поддержания гомеостаза или его адаптации [144].
Общей концепцией ограничения стресс-реакции признана концепция сопряжения действия стресс-лимитирующих и стресс-реализующих (АКТГ-подобных) систем [116, 138, 144]. Существование в организме специализированных стресс-лимитирующих систем, ограничивающих само возбуждение стресс-реализующих систем, обеспечивает резистентность к стрессу [124, 125, 134, 135]. Известно, что при воздействии стрессорных факторов происходит активация центральных и местных (антиоксидантная и аденозинэргическая системы) стресс-лимитирующих систем и механизмов. Среди центральных лимитирующих систем активируются такие как: ГАМК-эргическая, серотонинэргическая, холинэргическая и опиоидэргическая системы [29, 116]. Обнаружено, что характер и интенсивность развития стресс-реакции, а также степень участия в ней различных функциональных систем, во многом зависит от исходного состояния организма [80, 232, 270]. Различия животных по врожденной реакции на стресс-раздражители, послужили основанием для деления их на стрессустойчивых (низкоэмоциональных) и стресснеустойчивых (высокоэмоциональных, предрасположенных к стрессу). Основным показателем принадлежности животных к тому или иному типу является проявление их двигательной активности в тесте “открытое поле”: высокий уровень активности позволяет отнести животных к сильному типу (стрессустойчивому) и наоборот [51, 80]. Показано, что устойчивость к эмоциональному стрессу обусловлена прежде всего высоким уровнем опиоидных пептидов, вещества Р, ПВДС [131, 236, 243].
Степень развития стресс-реакции, во многом, определяется видом стресс-воздействия. Например, известно, что, кратковременное острое импульсное стрессирование приводит к экстренному повышению адаптивных способностей организма [37, 70, 145, 151]. Одним из таких воздействий может быть признан острый эмоционально-болевой стресс (ЭБС) [37, 52, 64, 121]. Показано, что при ЭБС происходит мобилизация ГГНС, адренэргической, симпато-адрееналовой и опиоидэргичекой систем. Литературные данные свидетельствуют о возможности включения в круг этих систем и мозговой железы - эпифиза [7]. Осуществление эпифизом своей антистрессорной защиты достигается при участии эндогенных опиоидов.
Таким образом, опиоидным пептидам принадлежит важная роль среди известных естественных биорегуляторов, участвующих в формировании адаптации к стрессорным факторам. Ниже представлены сведения о роли данной группы пептидов в реакциях стресса.
Система эндогенных опиоидных пептидов представляет собой одну из основных регуляторных систем, функционирующих в условиях стресса и адаптации [8, 102, 106, 134, 242]. Течение стресс-реакции сопровождается глубоким сдвигом в опиоидной системе, причем в ответ на воздействие болевого фактора наблюдается повышение уровня опиоидных пептидов, а при воздействии эмоционального - снижение их содержания [14, 18, 72, 239]. Увеличение содержания опиоидов при воздействии стресс-факторов отмечается в крови, ликворе, головном и спинном мозге [33, 34, 72, 140, 243]. Изменения метаболизма в головном мозге при воздействии сильных раздражителей, вызывают повышение проницаемости гемато-энцефалического барьера (ГЭБ) во всех его отделах [88, 97, 108]. Подобные изменения способствуют более интенсивному проникновению различных биологически активных веществ в структуры головного мозга, особенно эмоциогенные и гипофиз [88]. Повышенная проницаемость ГЭБ отмечена в гипоталамусе, что связывают с большой плотностью сети капилляров в нем [88]. При этом концентрация различных представителей семейства опиоидных пептидов также неодинакова, так как при эмоциональном стрессе в гипоталамусе преобладает мет-энкефалин, а уровень b-эндорфина достаточно низок, если же к этому воздействию присоединяется болевой фактор, то отмечается преобладание лей-энкефалина и концентрация b-эндорфина повышена [14, 18, 140, 242]. Повышение уровня энкефалинов способствует стабилизации внутренней среды организма, результатом чего является ограничение или прерывание стресс-реакции [6, 33, 100, 134, 238].
Функционирование этой системы самостоятельно, без взаимодействия с некоторыми регуляторными системами представляется маловероятным. Установлены антагонистические взаимоотношения между опиоидными пептидами и симпатоадреналовой, гипоталамо-гипофизарно-надпочечниковой системами [74, 124, 139, 176, 270], которые играют ключевую роль в генерации первой стадии общего адаптационного синдрома.
В течение первых суток (фаза тревоги) наблюдается снижение уровня энкефалинов в крови [134, 135, 140], в результате чего развивается острый адаптационный синдром, который сопровождается активацией ГГНС [21, 25, 128, 142, 143]. Дальнейшее, повышение уровня эндогенных опиоидных пептидов, в ответ на стресс-воздействие, способствует блокаде ГГНС [135, 261]. Торможение ГГНС опиоидными пептидами эффективно и препятствует избыточной стимуляции ГГНС, если стресс-воздействие осуществляется в легкой форме и непродолжительно по времени. При длительном стресс-воздействии опиоидная система не эффективна, в результате чего развивается гиперэргическая реакция со стороны ГГНС, заканчивающаяся общим стресс-повреждением организма [128, 142].
Одной из важных характеристик стресса является активация симпато-адреналовой системы (САС) [21, 150]. В общий ответ САС на действие раздражителя вовлекаются в первую очередь катехоламины – дофамин, норадреналин и адреналин. Установлено, что активация системы катехоламинов является основным фактором, обуславливающим увеличение концентрации опиоидных пептидов в мозге, а также выброс b-эндорфина из гипофиза в кровь [52, 79, 125, 139]. Опиоидные пептиды, действуя через m-рецепторы, снижают уровень катехоламинов в мозге, приближая их содержание к норме, тем самым ослабляя стресс-реакцию [125, 144]. Активация САС сопровождается также интенсивным высвобождением АКТГ [18, 106, 232]. Установлено, что эндогенные опиоидные пептиды модулируют процессы избыточного синтеза и секреции АКТГ, приближая их уровень к норме [18, 125].
Показанные выше взаимодействия системы опиоидных пептидов с другими функциональными системами организма, а также обнаруженное модулирующее влияние на процессы транссинаптической передачи нервного импульса и активность нейронов, являются следствием включения цепи сложных механизмов внутри клетки [10, 118, 122, 135, 261, 269]. В первую очередь к ним следует отнести депрессивное влияние опиоидных пептидов на систему циклических нуклеотидов, концентрация которых при воздействии экстремальных факторов эмоциональной и болевой природы, повышается [18, 109]. Такое изменение концентрации циклических нуклеотидов в клетке при воздействии стресс-фактора приводит к значительному снижению возбудимости нейронов и оказывает влияние на транспорт нейротрансмиттеров. Действие опиоидных пептидов основано на угнетении активности аденилатциклазы и, как следствие, снижении концентрации цАМФ в клетке [18, 109, 135]. Возможно, также, что энкефалины в первую очередь индуцируют повышение уровня цГМФ, после чего наблюдается активация фосфодиэстеразы и лишь затем идет торможение аденилатциклазы [18]. В любом случае, результатом является снижение избыточного синтеза цАМФ в клетке, что ведет к торможению ряда физиологических реакций, усугубляющих стресс-повреждения систем организма [18, 109 135].
Известно, что при тяжелых и продолжительных видах стресса той активации, которая достигается под влиянием опиоидных пептидов при легких и кратковременных стрессах недостаточно, в результате чего наблюдается неадекватность синтеза и секреции опиоидных пептидов и/или блокада опиоидных рецепторов продуктами метаболизма [112, 134, 145, 261]. Эти изменения влекут за собой истощение нейрогуморальной системы. В этой связи, необходимым становится экзогенное введение опиоидных пептидов с целью повышения потенциальных возможностей системы эндогенных опиоидов [102, 116, 125, 134, 135].
Показано, что экзогенное введение пептидных лигандов опиатных рецепторов приводит к снижению степени гипертрофии надпочечников [9, 34, 100], ослаблению инволютивных процессов в тимусе и селезенке [6], снижению степени стресс-повреждения сердца [102, 104, 238], а также положительно влияет на общее состояние животных при острой ишемии миокарда [103, 145, 269]. В ряде работ показана способность экзогенных опиоидов оказывать седативное действие при аффективных состояниях на синтез и секрецию стресс-гормонов [129], а также влиять на эмоциональный компонент стресса [136, 141, 151]. Стресс-лимитирующий характер действия опиоидных пептидов опосредуется через ингибирование избыточной секреции АКТГ, катехоламинов и других катаболических гормонов на начальных этапах развития общего адаптационного синдрома. В фазу резистентности реализация эффектов экзогенных опиоидных пептидов осуществляется через стимуляцию образования анаболических инкретов - пролактина, соматотропина и др. [101].
Предполагается, что адаптогенным действием обладает предшественник лей-энкефалина – лей5-энкефалин-арг6 [69, 134, 135].
Основными причинами, ограничивающими широкое использование регуляторных пептидов в клинике являются: слабовыраженный эффект при приеме внутрь, зависимость эффекта от исходного функционального состояния организма, трудности при прохождении ГЭБ, а также кратковременность действия, обусловленная в основном их быстрым протеолизом. Одним из наиболее известных препаратов, устойчивым к действию пептид-гидролаз, обладающим селективным пролонгированным действием, а также биодоступным, является даларгин - аргининсодержащий гексапептидный аналог лей- энкефалина ( Д-ала2-лей5-арг6-энк ) [69, 94, 105, 123, 146]. Внутримышечное введение его стимулирует репаративную регенерацию периферических нервных образований в условиях их повреждения, повышает активность коры надпочечников при стрессе [34], положительно влияет на организм после перенесенного инфаркта миокарда, симптоматика которого сходна с изменениями, возникающими в организме, подверженном острому эмоционально-болевому стрессу [245]. Показана также возможность использования даларгина для профилактики и патогенетической коррекции стресс-индуцированных нарушений иммунитета [148]. Выраженное антистресорное действие аргининсодержащего гексапептидного аналога обусловлено наличием аргининового компанента [101]. Важное значение в механизмах действия даларгина при стрессе имеет стимулирующее влияние его на опиатные рецепторы нейрональных структур мозга, а также на тормозную ГАМК-эргическую систему [101, 146]. Обнаруженные эффекты способствуют ограничению стресс-реакции на стадии тревоги и формированию резистентности к действию стресса в ходе общего адаптационного синдрома [89, 101].
Таким образом, экспериментально и теоретически доказана значимость системы опиоидных пептидов в адаптации и устойчивости организма к стрессу. Одним из важных, и в то же время малоизученных, вопросов в понимании механизмов регуляции активности нейропептидов в организме при воздействии стресса является выяснение путей их синтеза и деградации при экстремальных условиях.
Похожие работы
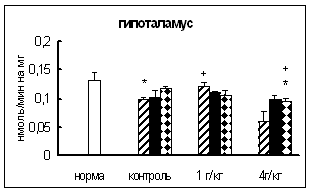
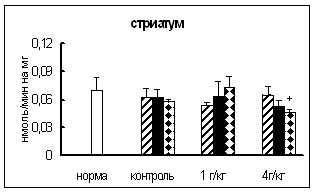
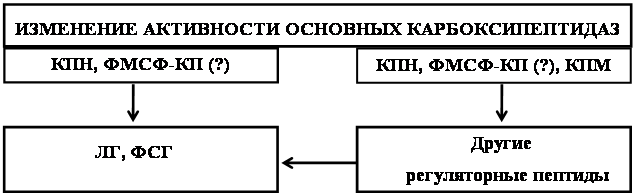
... нервной и эндокринной регуляции в организме // Усп. совр. биол. – 1981. – 19, № 3. – С. 380-382. 23. Вернигора А.Н., Бардинова Ж.С., Сметанин В.А., Генгин М.Т. Активность основных карбоксипептидаз в тканях самок крыс на разных стадиях эстрального цикла // Укр. биохим. журн. – 2003. – 75, № 5. – С. 99-102 24. Вернигора А.Н. Карбоксипептидаза Н мозга животных в норме и при действии стресс- ...

0 комментариев