Навигация
Определение видовой принадлежности
2.4 Определение видовой принадлежности
Чистой культурой считается выращенная масса клеток, состоящая из дрожжей, которые принадлежат одному виду и получены как потомство одной клетки.
Дрожжи в виде чистых культур широко используются в технологии производства многих пищевых продуктов (кисломолочные, сыры, хлеб, вино, пиво и др.). Применение культур дрожжей с известными свойствами дает возможность эффективнее использовать их деятельность — экономичнее перерабатывать сырье, получать высокий выход и надлежащее качество продукции.
Идентификация — определение систематического положения микроорганизмов, выделенных в чистые культуры. Для установления семейства, рода, вида, к которому принадлежат выделенные в чистые культуры дрожжей, необходимо изучить их морфологические, культуральные и физиологические признаки.
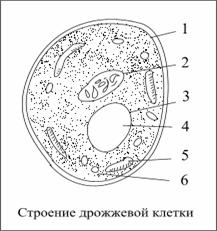
Морфологические признаки изучаются под микроскопом в препаратах живых и мертвых микроорганизмов.
Культуральные признаки устанавливаются по характеру роста культуры изучаемого микроорганизма на плотных и жидких питательных средах.
Физиологические признаки, обусловленные наличием ферментов в клетках, устанавливаются при посеве в специальные среды, в состав которых входят те вещества, воздействие на которые выявляется у изучаемого микроба.
Каждый новый штамм микроорганизмов должен быть охарактеризован для получения полных данных о свойствах чистой культуры данного микроорганизма.
Результатом идентификации обычно является отождествление выделенного микроорганизма с каким-нибудь видом или отнесение его к определённому роду.
Полученные данные используют для составления паспорта промышленных штаммов, а так же для их идентификации.
Проведя исследования важнейших морфологических, физиологических и культуральных признаков, устанавливают видовое название микроорганизма по определителю («ключу»). Для каждой группы микроорганизмов (бактерии, дрожжи, грибы) существуют свои определители, составленные с учетом специфических особенностей данной группы.
При описании колоний, выросших на поверхности среды отмечают:
- форму, профиль и цвет- невооружённым глазом;
- край- при малом увеличении микроскопа (объектив 8*);
- консистенцию - прикосновение петли к колонии;
- величину – линейкой ( колонии точечные – менее 1мм в диаметре, мелкие – 1-2 мм, крупные – 3-4 мм и более).
Морфологические свойства изучаемых штаммов микроорганизмов. n=5
Таблица 2.
| № штамма | Морфологические свойства. | ||||
| Форма | Размеры, мкм | Наличие спор | Почкование | Подвижность | |
| 1 | Клетки круглые и овальные. | 6±0,4 | + | + | − |
В результате полученных данных установлено, что размер дрожжевых клеток 6 мкм.
На плотных питательных средах изучают характер колоний. Поскольку колония образуется в результате размножения клеток, её строение зависит от особенностей размножения микробов данного вида и, следовательно, каждому виду присущи характерные признаки.
Культуральные свойства исследуемых штаммов дрожжей n=5
Таблица 3
| № колоний | Культуральные свойства | ||||||
| Размер | Профиль | Форма | Цвет | Край | Консистенция | структура | |
| 1 | Точечный. | Выпуклый. | Округлая. | Белый. | Гладкий. | Мягкая. | Зернистая. |
Физиолого-биохимические свойства изучаемых штаммов
В связи с тем, что 5 исследуемых штаммов по культуральным свойствам были идентичными, для дальнейшего изучения взяли один из них штамм №5. Для определения вида была проведена идентификация по приложению №2.6
Физиолого-биохимические свойства изучаемого штамма Таблица 4
| Показатели | № пробы | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Рост на среде Сабуро при температуре 20 оС 36 оС 45 оС | + + − | + + − | + + − | + + − | + + − |
| Рост на среде Пивное сусло-агар. 20 оС 36 оС 45 оС | + + − | + + − | + + − | + + − | + + − |
| Рост на среде Рисовая –Левиной. 20 оС 36 оС 45 оС | + + − | + + − | + + − | + + − | + + − |
| Образование СО2 из глюкозы | + | + | + | + | + |
| Нагревание в течение 30 мин при температуре 60 °С | − | − | − | − | − |
| Сбраживание углеводов: | + + + ± + ± | + + + ± + ± | + + + ± + ± | + + + ± + ± | + + + ± + ± |
| Мальтоза Сахароза Лактоза Галактоза Декстрин Раффиноза | |||||
У выделенных штаммов микроорганизмов, рост наблюдается при температуре от 19 − 36 ºС. Оптимальной для культивирования штамма является температура от 30 − 35°С. При культивировании на рисовой среде Левиной, испытуемого штамма дрожжей наблюдается спорообразование. Образование СО2 из глюкозы наблюдается в аэробных условиях. Выделенный штамм сбраживает следующие углеводы: мальтоза, сахароза, лактоза, декстрин; галактоза, раффиноза − частично.
Культуральные свойства Saccharomyces
Клетки круглые и овальные, иногда удлиненные. Вегетативное размножение многосторонним почкованием. Может быть примитивный псевдомицелий, истинного мицелия нет. Колонии обычно пастообразные. На жидких средах при продолжительном культивировании может образовываться пленка, но она не бывает сухой порошковидной или всползающей. Аски образуются преимущественно из вегетативных диплоидных клеток без непосредственно предшествующей конъюгации. При созревании спор сумки не вскрываются. Аскоспоры круглые или слабоовальные, бесцветные, гладкие, 1 — 4 в аске. Все виды активно сбраживают сахара и не используют нитраты. Лактозу и высшие парафины не ассимилируют. Дрожжи этого рода с давних времен распространены в кустарном виноделии и широко используются в разных отраслях бродильной промышленности, в связи с чем они более всех других дрожжей изучены в разных аспектах. Их систематика, однако, постоянно пересматривается. Центральный вид — Saccharomyces cerevisiae Hansen известен в десятках синонимов, которые в настоящее время рассматриваются как производственные расы, но не самостоятельные виды.
В разных определителях объем рода Saccharomyces сильно варьирует. Ван дер Вальт в определителе Лоддер [55] различает 41 вид, среди которых есть диплоидные, гаплоидные и виды с соматогамной автогамией. В. И. Кудрявцев [11] включает в род Saccharomyces только диплоидные дрожжи, выделяя гаплоидные виды в Zygosaccharomyces, а виды с автогамным половым процессом — в род Debaryomyces. В результате полученных данных, при изучении физиологических свойств штамма, установлено, что данный штамм относится к дрожжам и предварительно идентифицирован как Saccharomyces сеrеvisiае. (рис.3.в приложении № 2.)
Основные показатели процесса культивирования дрожжей
Для определения химического состава дрожжей, нам было необходимо накопить определенное количество биомассы. С этой целью мы использовали ферментер БИОЛУК-3Ш, аппарат для непрерывного культивирования микроорганизмов. Установка может использоваться при процессах переработки субстратов сложного химического состава, для интенсификации микробиологических процессов, а также для ускоренного автоматического отбора активных штаммов, перспективных при использовании в различных областях народного хозяйства и промышленности. Установка-БИОЛУК-3Ш может использоваться при исследованиях в генетике, биохимии, микробиологии, физиологии и экологии.
Технологические характеристики установки БИОЛУК-3Ш
Установка может работать с ферментерами объемом 0,1-10 л
Объем культуры в ферментерах 0,05-7 л
Скорость вращения мешалки до 1500 об/мин
Аэрация 0-2,76 л/мин
Производительность дозатора 20-400 мл/час
Автоматическая стабилизация рН от 2 до 12
Потребляемая мощность 600 Вт
Напряжение питания 220 В, 50 Гц
Вес 25 кг
Принцип действия установки БИОЛУК-3Ш
Установка работает следующим образом. Питательная среда при помощи перистальтического насоса дозатора по силиконовому шлангу подается в ферментер. Скорость подачи среды в ферментер регулируется в зависимости от цели и задачи исследования, то есть в режиме рН-стата, хемостата. Воздух ферментер поступает от микрокомпрессора через ротаметр, показывающий расход воздуха, воздушный и водяной фильтр, служащий для стерилизации и увлажнения подаваемого воздуха для насыщения кислородом культуральной жидкости. Перемешивание культуральной жидкости осуществляется вращением мешалки на основе электродвигателя. Регистрация и управление параметров растущей культуры происходит с помощью датчиков рН, еН, рО2 и др. Выбор датчиков определяется задачей исследования для стабилизации температуры в ферментере предусмотрено устройство, соединенное с термостатом, для поддержания заданной температуры. Излишки культуральной жидкости из ферментера уносятся воздухом через сливную трубку в бак для урожая.
Подъемная сила и бродильная энергия таких дрожжей понижается, в процессе выращивания наблюдается отмирание части дрожжевых клеток. Количество мертвых клеток составляет около 7 %. В связи с этим на протяжении всего процесса культивирования нами поддерживалось температура 28 – 300 С.
Основные показатели процесса культивирования дрожжей. Таблица 5
| Часы культивирования | t0С среды | Биомасса г/л | ||
| Номер опыта | ||||
| 1 | 2 | 3 | ||
| Начальная | 28-30 | 1,82 | 1,71 | 1,93 |
| 1 | 28-30 | 3,63 | 3,34 | 4,05 |
| 2 | 28-30 | 16,69 | 18,76 | 19,75 |
| 3 | 28-30 | 37,04 | 37,14 | 37,12 |
| 4 | 28-30 | 49,38 | 49,52 | 49,49 |
| 5 | 28-30 | 61,73 | 61,90 | 61,86 |
| 6 | 28-30 | 74,08 | 74,28 | 74,24 |
| 7 | 28-30 | 88,78 | 89,04 | 88,98 |
Во время культивирования дрожжей нами каждый час определялись следующие показатели: температура, прирост биомассы и количество дрожжевых клеток в мл.
Дрожжевые клетки, как и все микроорганизмы, при культивировании развиваются по четырем фазам роста: лагфаза, фаза логарифмического роста, стационарная фаза и фаза отмирания. Однако наша работа предусматривает только первые три фазы.
Лагфаза – это период, во время которого внесенные в питательную среду дрожжевые клетки адаптируются к окружающей среде.
Фаза логарифмического роста характеризуется высокой активностью размножения клеток. Количество почкующихся клеток быстро увеличивается, достигая 70 – 80%. Биомасса дрожжей увеличивается вследствие образования новых дочерних клеток, которые, вырастая до размеров материнской клетки, начинают почковаться, образуя новую генерацию. После отпочковывания молодой клетки материнские клетки вновь начинают почковаться, т.е. в этой фазе наблюдается максимальная скорость роста дрожжевых микроорганизмов.
В стационарной фазе образование новых клеток практически прекращается, заканчивается также и почкование, так как питательные вещества в дрожжерастительный аппарат не поступают. Для поддержания жизнедеятельности клетки используют оставшиеся питательные вещества. Увеличивается масса и размер клеток. Эта фаза соответствует их дозреванию.
Фаза отмирания характеризуется отсутствием роста и размножения микроорганизмов. Масса клеток уменьшается, наблюдается автолиз. Качество клеток резко ухудшается.
Содержание питательных веществ в биомассе дрожжей, n=5
В полученных нами дрожжах были определены следующие показатели:
· сухое вещество – высушиванием в сушильном шкафу при температуре 60°С;
· гигроскопическая влажность – высушиванием в сушильном шкафу при температуре 100 – 105° С, ГОСТ 1396.3 – 92 (27548 - 97);
· «сырой» жир – в аппарате Сокслета, ГОСТ 13496.65;
· «сырой» протеин – по методу Къельдаля, ГОСТ 1396.4 (28074 – 89);
· «сырая» зола – методом сухого озоления (температура 400 – 4500С), ГОСТ 26226 – 95;
· БЭВ – расчетным методом.
В полученных нами дрожжах были определены показатели, которые представлены в таблице 6.
Химический состав дрожжей Таблица 6
| Показатель | Содержание в дрожжах |
| Сухое вещество, % | 28,1±1,2 |
| Влага, % | 71,9±3,5 |
| «Сырой» протеин, % | 41,4±1,5 |
| «Сырой» жир, % | 1,8±0,7 |
| «Сырая» зола, % | 8,8±1,2 |
| БЭВ, % | 48±3,1 |
Содержание сухого вещества составило 28,1 %, влаги около 80%, протеина 41,4%, жира 1,8%, золы 8,8%. Содержание БЭВ (Безазотистых Экстрактивных Веществ) составило 48%.
Из анализа выше приведенных данных следует, что исследуемые штаммы дрожжей можно отнести к роду Saccharomyces виду сеrеvisiае.
2.5 Обсуждение результатов
1. Вегетативное размножение наблюдали на твёрдых средах в культурах 2–3 суточного возраста, культуральные признаки, описывали по штриху. Отметили: круглую форму колоний, выпуклый профиль, гладкие края и однородную структуру. Цвет колоний – белый.
2. В ходе проведённых опытов, было выделено 5 штаммов дрожжей, из которых для дальнейших исследований были использованы штаммы дрожжевых микроорганизмов, которые максимально соответствует нашим требованиям, по фенотипическим признакам.
3. Пересевы производили в стерильную плотную питательную среду до получения однородных колоний. После каждого пересева содержимое чашек Петри проверяли на чистоту культуры.
4. На плотных питательных средах изучают характер колоний. Поскольку колония образуется в результате размножения клеток, её строение зависит от особенностей размножения микробов данного вида и, следовательно, каждому виду присущи характерные признаки. В результате размеры клеток 6 ± 0,4мкм, отметили также наличие спорообразования и почкования. Клетки не подвижны.
5. У выделенных штаммов микроорганизмов, рост наблюдается при температуре от 19 − 36 ºС. Оптимальной для культивирования штамма является температура от 30 − 35°С. В процессе культивирования была получена биомасса дрожжей (88,98 г/л.)
7. Выделенный штамм сбраживает углеводы. Наблюдается спорообразование, при культивировании на рисовой среде Левиной. Образование СО2 из глюкозы − в аэробных и анаэробных условиях.
6.Содержание сухого вещества составило 28,1 %, влаги около 80%, протеина 41,4%, жира 1,8%, золы 8,8%. Содержание БЭВ (Безазотистых Экстрактивных Веществ) составило 48%. В результате полученных данных, установлено, что данный штамм относится к дрожжам и предварительно идентифицирован как Saccharomyces сеrеvisiае.
Глава 3 Экономическая эффективность
Одно из важнейших направлений повышения эффективности производства в пищевой промышленности – снижение материалоемкости. Пивоваренная промышленность относится к числу наиболее материалоемких отраслей. Удельный вес материальных затрат в издержках производства в пивоваренной промышленности достигает 80%. Эффективное использование материальных ресурсов в пивоварении означает снижение себестоимости продукции и более эффективное использование сельскохозяйственного сырья.
Материалоемкость производства определяется величиной материальных затрат, приходящихся на 1 руб. товарной продукции.
Основным элементом материальных затрат являются затраты на зерновое сырье. На величину затрат зернового сырья в стоимостном выражении существенное влияние оказывают закупочные цены на ячмень, удельный вес товарного солода, состав закупаемого зерна по классам.
В экономическом смысле себестоимость — это денежное выражение затрат предприятия на производство и реализацию продукции. Количественно она не совпадает с той частью стоимости, которую отражает, поскольку потребленные в процессе производства орудия (машины, оборудование и т. д.) и предметы труда (питательные среды), включаются в себестоимость продукции не по общественно необходимым затратам, а по действующим ценам которые, как правило, не совпадают со стоимостью.
Основу себестоимости продукции, (работ, услуг) составляют затраты прошлого и живого труда. Прошлый труд заключен в средствах производства, которые оцениваются по фактическим ценам приобретения, а материалы собственного производства (агар, пептон и т. д.) — по себестоимости. Живой труд учитывается в размере его фактической оплаты, включая и часть затрат по воспроизводству рабочей силы.
Себестоимость продукции (работ, услуг) представляет собой стоимостную оценку используемых в процессе их производства природных ресурсов, сырья, материалов, топлива, энергии, основных фондов, трудовых ресурсов, а также других затрат на ее производство и реализацию. Таким образом, она отражает величину таких затрат, которые обеспечивают процесс простого воспроизводства на предприятии; это форма возмещения потребляемых факторов производства.
Основным направлением повышения эффективности производства в пищевой промышленности является более полное использование производственных мощностей и основных фондов предприятия, а также рост производительности труда и улучшения качества продукции. (Опарин Н.Г., 2003).
Валовая продукция - это стоимость всей произведенной, продукции и выполненных работ, включая незавершенное производство. Выражается в сопоставимых и действующих ценах.
Товарная продукция отличается от валовой тем, что в нее не включают остатки незавершенного производства и внутрихозяйственный оборот. По своему составу на многих предприятиях валовая продукция совпадает с товарной, если нет внутрихозяйственного оборота и незавершенного производства.
Расчет себестоимости и производства.
Сырье и основные материалы. Стоимость сырья и основных материалов для производства продукции представлена в таблице.
Таблица 7 Стоимость сырья и основных материалов, используемых при производстве 100г. дрожжей
| Наименование затрат | Норма расхода, г. | Цена руб., кг. | Сумма, руб. |
| Хмель | 200 | 50 | 10 |
| Дрожжи ( для приготовления автолизата) | 240 | 400 | 60 |
| Агар | 80 | 961,08 | 160 |
| Пептон | 20 | 908,76 | 30 |
| Витамин В1 | 100 | 400 | 40 |
| Витамин В12 | 100 | 320 | 32 |
| Глюкоза | 100 | 1080 | 108 |
| Сахароза | 30 | 1200 | 120 |
| Галактоза | 25 | 1000 | 25 |
| Раффиноза | 15 | 960 | 14,4 |
| Лактоза | 15 | 1100 | 16,5 |
| Фильтры бумажные | 50шт. | 600 | 600 |
| Вода | − | − | − |
| Итого: | 1215,9 |
Остальные составляющие затрат сводятся в следующих таблицах.
Похожие работы
... повышенной температуре, несвоевременное шпунтование танков при дображивании, приготовление заторов из сильно растворенных солодов, отрицательно влияют на пенообразование. Раздел 3.Технологический расчет сырья для производства пива Наименование Условное обозначение Количество на 100 кг зернового сырья Объем сусла Vc 54,51583365 Горячее сусло Vгс 56,696467 Холодное сусло Vхс 53, ...
... этих препаратов превосходит активность ферментов солода по осахаривающей способности в 3-4 раза, по разжижающей - в 8-10 раз, по декстринирующей - в 10-20, по протеолитической - в 15-20 раз. Опыт использования в пивоваренной промышленности МЭК свидетельствует о том, что создание широкого набора эффективных мультиэнзимных композиций способствует успешной переработке повышенных количеств ...
... любого, кто украдет росток, чтобы его возделывали в другой стране.[11] Учитывая все вышесказанное, утверждать с полной уверенностью - так сказать, однозначно, кто именно и когда первым стал использовать в технологии пивоварения хмель, весьма затруднительно. Но это, впрочем, не так уж важно. Главное то, что в результате у пива появился тот "пивной" вкус, который мы хорошо знаем сегодня.[11] Что ...
... со 100 до 138°С остается неизменным. При дальнейшем повышении температуры (до 143°С) уровень аминокислот падает, что связано с усилением реакции меланоидинообразования. 2. ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ 2.1 Описание технологии производства пива «Рецептура №1», «Рецептура №2» и «Рецептура №3» В технологической схеме производства пива можно выделить несколько этапов (приложение 1): подготовка воды ...
0 комментариев