Навигация
Обмен лигандами в экстрактах комплексов Ni(II) и Cu(II) с PAN на оксинат
2.3 Обмен лигандами в экстрактах комплексов Ni(II) и Cu(II) с PAN на оксинат
В работе поставлена задача изучить обмен в экстрактах комплексов Ni(II) и Cu(II) с PAN при добавлении разных концентраций 8-оксихинолина. Полноту обмена изучали добавлением в экстракт панатов указанных металлов разных количеств оксина. Спектры поглощения комплексов с PAN практически не накладываются на поглощение PAN, оксина и оксинатов, поэтому обмен удобно наблюдать по измерению светопоглощения комплексов PAN с ионами металлов. Спектры поглощения комплексов металлов (Ni(II) и Cu(II)) с PAN в CHCl3 приведены на рисунке 2.1, а численные значения ε (молярный коэффициент поглощения) приводились в предыдущих подразделах.
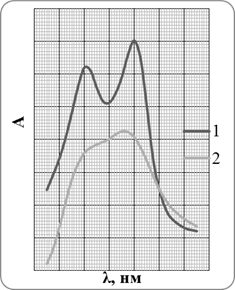
Рисунок 2.1. Спектры поглощения панатов Ni – 1 и Cu – 2
Было проведено две серии измерений с концентрациями оксина, которые различались на порядок.
Результаты первой и второй серий были занесены в таблицу 3 и приложение А соответственно. Результаты второй серии для меди вынесены в приложение (через большой избыток оксина идет полное разрушение), но они полезны тем, что для паната меди установлено погрешность измерения – светопоглощение A2; с учетом этого представлены результаты первой серии.
Таблица 3 Первая серия измерений. Светопоглощение экстрактов комплексов металлов в CHCl3 при добавлении разных концентраций оксихинолина. A0 – без добавления оксина, A1 – ![]() ; A2 –
; A2 – ![]() ; A3 –
; A3 – ![]() ;
; ![]()
| λ, нм | A0 | A1 | A2 | A3 |
| Ni(PAN)2 +Ox; | ||||
| 570 | 0,507 | 0,488 | 0,487 | 0,486 |
| Cu(PAN)2 +Ox; | ||||
| 560 | 0,326 | 0,180 | 0,125 | 0,074 |
Из таблицы 3 видно, что в экстрактах комплексов металлов с PAN обмен почти полностью проходит в комплексе меди (идет полное разрушение), а в комплексе никеля он практически не происходит.
При изучении межлигандного обмена в экстрактах комплексов металлов с PAN на оксихинолин удобно оценить эффективность используемых эмпирических оценок степени протекания реакций обмена. Сопоставляя эти две системы, целесообразно проверить насколько оправдано использование констант образования нейтральных хелатных комплексов при априорной неколичественной оценке возможности межлигандного обмена (данные оценки представлены в таблице 7, что помещено в приложении А).
Константы реакции обмена для Ni и Cu
M(PAN)2 + 2Ox ![]() M(Ox)2 + 2PAN
M(Ox)2 + 2PAN
приведенные в таблице 4, измерены следующим образом. По светопоглощению комплексов с PAN определяли их концентрацию и вычитанием ее с общей концентрации металла находили концентрацию M(Ox)2. Из начальных концентраций реагентов c(PAN) и c(Ox) находили их равновесные концентрации, учитывая расход на комплексообразование, и рассчитывали подставляя значения всех концентраций

Таблица 4 Результаты определения![]()
| Ион металла |
|
|
| Cu(II) | 24,55 (из1-й серии) | 1,39 |
| Ni(II) | 0,025 (из 2-й серии) | -1,60 |
Так как было проведено всего 2 серии измерений, то эти результаты не могут быть представлены как справочные данные. Однако в пределах тех интервальных значений констант, приведенных в литературе, они могут быть использованы для ответа на вопрос – «Идет обмен, или нет в данных системах?».
После этого можно сделать заключение о возможности совместного определения никеля и меди фотометрическим методом с предварительным экстракционным концентрированием и отделением с помощью PAN и оксина, так как спектры панатов этих металлов не накладываются (рис 2.1, ст. 19), и что есть возможность почти полного маскирования влияния меди оксином (это видно из значений констант обмена).
0 комментариев