Навигация
Актуальность разработки стандарта
2.2 Актуальность разработки стандарта
Конкурентоспособность предприятия напрямую зависит от качества производимой продукции.
Актуальность разработки данного стандарта определяется тем, что в последние годы в стране имеет место появление на рынке низкокачественных и малоэффективных лекарственных средств, а также фармацевтической продукции сомнительного происхождения, что угрожает здоровью населения. Использование данного стандарта на предприятии позволит обеспечить гарантированное качество лекарственных средств, поступающих на внутренний рынок, и развитие отечественного производства в соответствии с международными требованиями.
Внедрение данного стандарта на предприятии позволяет не только эффективно организовать контроль качества выпускаемой продукции, но и подготовиться к сертификации по международному стандарту, открывающей возможность выхода предприятия на международный рынок фармацевтической продукции.
Также внедрение стандарта позволяет значительно повысить инвестиционную привлекательность, сократить производственные издержки.
2.3 Сведения о соответствии проекта стандарта законодательству Российской Федерации
Построение, изложение, оформление и содержание стандарта соответствует требованиям ГОСТ Р 1.5 - 92, ГОСТ Р 1.2 - 2004 и ГОСТ Р 1.4-2004.
Разработанный стандарт соответствует основным положениям стандартизации в Российской Федерации, изложенных в ГОСТ Р 1.0-2004.
СТО соответствует Федеральному Закону Российской Федерации «О техническом регулировании» [5], закону Российской Федерации «О защите прав потребителей». Также СТО не противоречит требованиям Технического Регулирования и требованиям безопасности.
2.4 Сведения о патентной чистоте проекта стандарта
Согласно данным Федеральной службы по интеллектуальной собственности, патентам и товарным знакам
(ФГУ ФИПС), заявок на патент контроля качества лекарственных средств не подавалось, поэтому объект с этой точки зрения чист.
2.5 Сведения о взаимосвязи проекта стандарта с другими нормативными документами
Проект стандарта оформляется в соответствии с СТП СГАУ 6.1.4 - 97 Общие требования к оформлению учебных текстовых документов и ГОСТ Р 1.5 – 2002 ГСС. Стандарты. Общие требования к построению, изложению, оформлению, содержанию и обозначению.
ГОСТ Р 1.4-2004 Стандартизация В Российской Федерации. Стандарты организаций. Общие положения.
Гражданский кодекс Российской Федерации от 18.12.2006 №230-Ф3.
Закон Российской Федерации «О защите прав потребителей» от 07.02.1992 №2300-1.
2.6 Сведения о консенсусе
Общее согласие всех заинтересованных сторон, разрабатывающих и потребляющих продукцию, по её качеству, экономичности, применимости, совместимости, взаимозаменяемости и безопасности достигается:
- Федеральным агентством по стандартизации;
- Дирекцией фармацевтического предприятия;
- Ректорат Самарского государственного аэрокосмического университета.
В данные организации была направлена заявка стандарта организации первой редакции на рассмотрение, в течении двух месяцев она была рассмотрена и утверждена.
2.7 Система обозначения стандарта
В обозначении СТО была использована Внутренняя система документации предприятия (ВСДП) [6].
Согласно ВСДП документу присвоен номер: СТО СГАУ 023-2009 (смотри рисунок 1).
СТО СГАУ 011 - 2009
 | |||||||
 | |||||||
Год утверждения стандарта
![]()
![]() Порядковый (регистрационный) номер
Порядковый (регистрационный) номер
![]() Аббревиатура организации
Аббревиатура организации
Самарский государственный аэрокосмический университет
Категория документа
![]()
Стандарт организации
Рисунок 1 –Структура обозначения стандарта организации
В стандарте приведены библиографические данные, представленные Госстандартом России:
- код Общероссийского классификатора стандартов (смотри рисунок 2);
- ключевые слова.
03. 120. 10
Управление качеством и обеспечение качества
![]() Подгруппа
Подгруппа
Качество
![]() Группа
Группа
Социология. Услуги. Организация фирм и управление ими. Администрация.
Транспорт
![]() Раздел
Раздел
Рисунок 2 - Структура обозначения Общероссийского классификатора стандартов (ОКС)
Заключение
В данной курсовой работе был разработан проект стандарта организации, который определяет правила контроля качества лекарственных средств на предприятии. Определены основания и целесообразность разработки стандарта, дано описание объекта стандартизации и оптимальность выбранных требований стандарта, сведения о соответствии проекта стандарта законодательству Российской Федерации. Определена патентная чистота проекта стандарта и его взаимосвязь с другими нормативными документами по стандартизации. Разработан проект стандарта первой редакции.
На основании разработанного стандарта можно сделать следующие выводы:
1) Повысится конкурентоспособность предприятия;
2) Сократится количество неудовлетворенных покупателей;
3) Повысится качество выпускаемой продукции.
Список использованных источников
1 СТО СГАУ 02068410-004-2007Общие требования к учебным текстовым документм. – М.: Издательство стандартов, 2007. – 30 с.
2 ГОСТ Р 1.5 – 92 ГСС. Стандарты. Общие требования к построению, изложению, оформлению, содержанию и обозначению. – М.: Издательство стандартов, 1993. – 101 с.
1 Желтов И.Н. Стандартизация. Конспект лекций. – СГАУ, 2007.-61с.
2 www.quality.eup.ru
3 Федеральный закон «О техническом регулировании». – М.: ТК Велби, Издательство Проспект, 2003. – 32 с.
4 Государственная система стандартизации: Сб. Стандартов: ГОСТ Р 1.0 – 92, ГОСТ Р 1.2 – 92, ГОСТ Р 1.4 – 93, ГОСТ Р 1.5 – 92. – М.: ГОССТАНДАРТ РОССИИ,1994.–124 с.
5 Общероссийский классификатор стандартов.- М.: Издательство стандартов, 1994.-583с.
Приложение А
(обязательное)
Структура кода УДК
658. 562. 64
![]()
![]()
![]()
![]()
![]()
![]()
![]() Подраздел
Подраздел
Контроль и надзор за готовой продукцией, готовыми изделиями
![]() Раздел
Раздел
Производственный контроль. Технический контроль производства. Контроль и надзор за качеством
Комплекс
![]()
Управление предприятиями. Организация и техника торговли
Рисунок А.1 – Структура кода УДК
Приложение Б
(обязательное)
Политика качества предприятия
Фармацевтическое предприятие должно ставить перед собой цели в области качества для удовлетворения всех заинтересованных сторон:
1) использование и внедрение современных технологий;
2) использование современного технологического оборудования и систем обеспечения производства;
3) использование современных адекватных методов контроля качества продукции;
4)эффективное использование интеллектуального потенциала, управление знаниями;
5) сохранение долгосрочных и развитие взаимовыгодных отношений с партнерами;
6) усовершенствование работы по доведению профессионалам в области здравоохранения и потребителям актуальной информации о продукции, обеспечение надлежащего уровня продвижения и рекламы;
7) Создавать для персонала возможности профессионального и карьерного роста и обеспечивать необходимый компенсационный уровень.
Решение задач будет достигнуто за счет:
- Поддержания и улучшения системы менеджмента качества на базе ISO 9001:2000, сертификации всего производства на соответствии требованиям Надлежащих Правил Производства (GMP), построение Фармацевтической Системы Качества на базе принципов Международной Организации по Гармонизации (ICH Q8, ICH Q9 и ICH Q10).
- Учета и удовлетворенности потребностей персонала в повышении уровня компетенции и обучении;
- Постоянного анализа и внедрения новых методов работы в сфере продвижения с учетом этических принципов;
- Технического дооснащения полного цикла производственного процесса;
- Постоянного анализа и усовершенствования результатов деятельности предприятия в сравнении с деятельностью конкурентов и требованиями потребителей.
Высшее руководство компании должно осознавать ответственность за понимание во всех подразделениях и службах компании целей и задач и должно поддерживать реализацию всех мероприятий, направленных на реализацию Политики в области качества, которой руководствуется во взаимных отношениях с клиентами, поставщиками и работниками.
Приложение В
(обязательное)
СТО СГАУ 011-2009
стандарт организации
(проект)
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ НА ПРЕДПРИЯТИИ
Общие положения
Самарский государственный аэрокосмический университет
СТО СГАУ 011-2009
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения стандартов организаций Российской Федерации – ГОСТ Р 1.4-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 РАЗРАБОТАН студентом группы 1410 И.Д. Кабаковой Руководитель И.Н. Желтов
2 ВНЕСЕН кафедрой производства летательных аппаратов и управления качеством в машиностроении
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ приказом ректора Самарского государственного аэрокосмического университета имени академика С.П.Королева от 1 января 2009г.
4 ВВЕДЕН ВПЕРВЫЕ
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Самарского государственного аэрокосмического университета
Содержание
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Общие положения
5 Управление качеством
6 Регистрация данных о качестве
7 Внутренняя проверка качества
8 Контроль процесса производства
СТАНДАРТ ОРГАНИЗАЦИИ
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ НА ПРЕДПРИЯТИИ
ОБЩИЕ ПОЛОЖЕНИЯ
Дата введения 2009-01-01
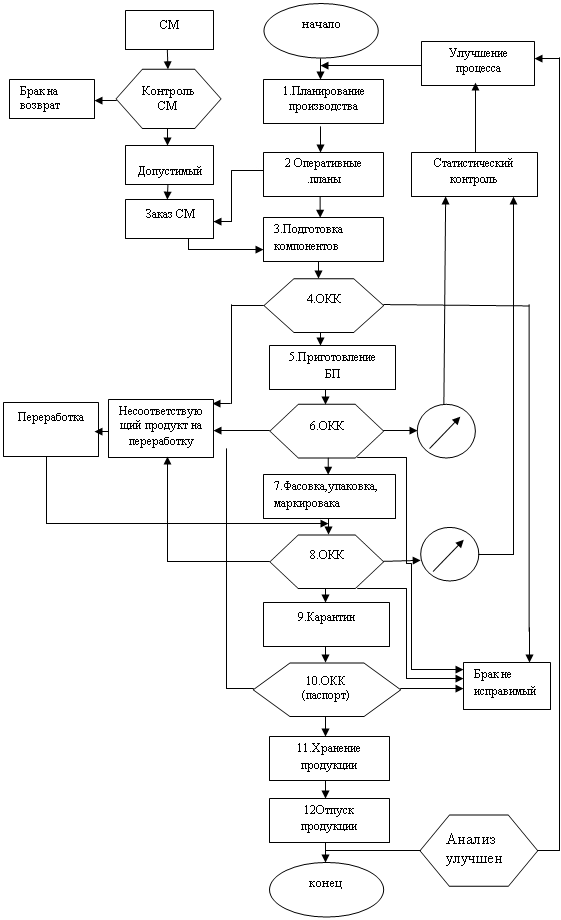
1. Область применения
1.1 Настоящий стандарт представляет собой свод правил по организации производства и контроля качества лекарственных средств медицинского назначения. Отдельные положения настоящего документа распространяются также на производство лекарственных веществ, предназначенных для приготовления готовых лекарственных средств.
1.2 Стандарт распространяется на все предприятия, выпускающие готовые лекарственные средства медицинского назначения и лекарственные вещества, предназначенные для приготовления готовых лекарственных средств, независимо от их ведомственной подчиненности и форм собственности.
Похожие работы
... и контролирует правильность оформления прописей для индивидуального производства лекарств. Ведет текущую и отчетную документацию. Проводит целевое фармацевтическое исследование аптек, других учреждений с целью оценки состояния контроля качества лекарственных средств при их изготовлении, транспортировке, хранении и отпуске. Экспресс-анализ лекарственных форм. Необходимость внутриаптечного ...
... настоящего стандарта обязательны для исполнения всеми участками процесса. Требования настоящего СТО распространяются на действия по производству лекарственного препарата Нитокс 200 и область возможного его улучшения. Сознательное нарушение требований настоящего стандарта организации является нарушением исполнительской дисциплины и может быть основанием для административного взыскания. 2. ...
... показателей и методов контроля качества Л С. Он должен обеспечивать разработку эффективного и безопасного Л С. Новый ОСТ предусматривает наличие двух категорий стандартов качества: I. Государственные стандарты качества лекарственных средств (ГСКЛС), к которым относятся: общая фармакопейная статья (ОФС) и фармакопейная статья (ФС); II. Стандарт качества (СКЛС); фармакопейная ...
... стратегические цели, принципы и задачи развития фармацевтической промышленности, ситуацию в отрасли, проблемы отрасли, способы и пути решения указанных проблем.[12] 7.Исследование доли выпускаемой продукции отечественных производителей в ассортименте товаров аптек базы практики. 7.1.Анализ доли препаратов ЗАО «Эвалар» В Аптеке ООО «Сатурн», расположенной по адресу: Республика Марий Эл, пгт. ...

0 комментариев