Навигация
Фазовые диаграммы систем Mn-O и Si-O
1.7 Фазовые диаграммы систем Mn-O и Si-O
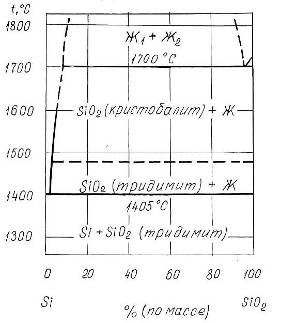
Фазовая диаграмма состояния системы Si-O
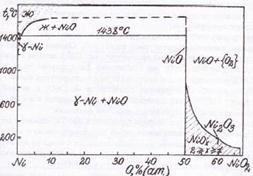
Диаграмма состояния O-Si построена в интервале концентраций 0-66,7 % (ат.) О на основе обобщения литературных данных. В системе существует обширная область расслаивания в жидком состоянии. Температура монотектической реакции отвечает 1703°С. При 1417°С происходит кристаллизация эвтектики Si + SiO2 (тридимит). Как следует из диаграммы, в системе образуется одна устойчивая оксидная фаза - SiO2 (кремнезем). Никаких других промежуточных фаз, кроме SiO2, в системе не обнаружено.
Растворимость кислорода в твердом Si была определена с помощью метода ИК-спектроскопии и представлена ниже:
| Температура, °С | 1412 | 1250 | 1100 | 1000 |
| Растворимость О, % (ат.) |
|
|
|
|
При нормальном давлении устойчивы 4 полиморфные модификации SiO2: β-SiO2, α-SiO2, тридимит и кристобалит. Превращение α-SiO2 в SiO2 (коэзит) происходит при давлении 1,8-2,0 ГПа и температуре 500°С. Стишовит образуется при давлении 16-18 ГПа и температурах 1200-1400°С [2].
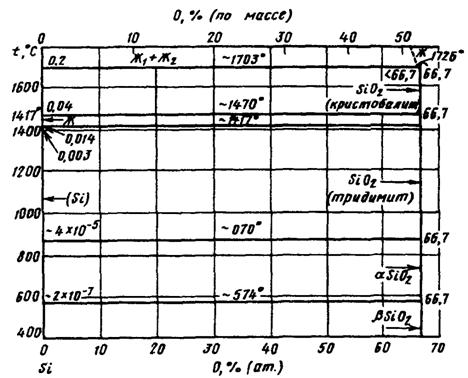
Рис.1.4. Диаграмма состояния системы Si-O.
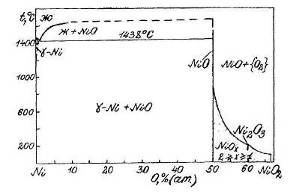
Фазовая диаграмма состояния системы Mn-O.
Взаимодействие марганца с кремнием изучалось на основе оксидов: MnO, Mn3O4, Mn2O3, MnO2, Mn2O7. Методом оптической пирометрии определена температура плавления МnО, равная 1842±10°С, область гомогенности МnО находится в интервале 47,4-52,4 % (ат.) O. Температура плавления Мn3О4 равна 156714°С и область гомогенности находится в интервале 57-58,4 % (ат.) О. Соединение Мn3О4 существует в двух модификациях: β-Мn3О4 и α-Мn3О4. Соединение Мn2О3 существует при температуре не выше 900°С, в интервале температур 600-940°С Мn3О4 в присутствии О2 взаимодействует с МnО2 с образованием Мn2О3, при температуре выше 940°С Мn2О3 распадается на Мn3О4 и О2.
На рис. 1.5. приведена диаграмма состояния Mn-О при давлении 0,021 МПа.
Соединение МnО плавится конгруэнтно, а соединение β-Мn3О4 - инконгруэнтно при температуре 1567±4°С. Соединение α-Мn3О4 образуется по перитектоидной реакции при температуре -1190°С. При температуре 1160±5°С β-Мn3О4 распадается по эвтектоидной реакции [2].
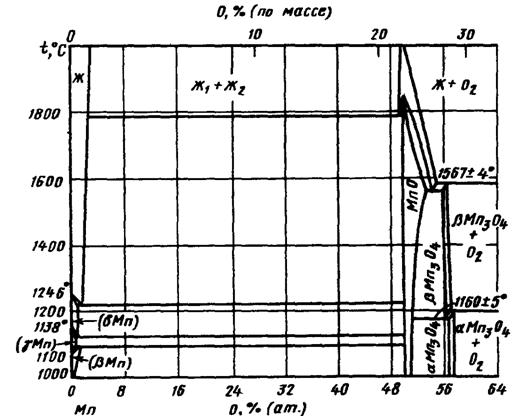
Рис.1.5. Диаграмма состояния Mn-O.
2. Экспериментальная часть
2.1 Расчёт термодинамических функций силицидов марганца по формулам Миедемы и Истмена
Табл. 2.1 Данные, необходимые для расчётов по формулам Миедемы и Истмена [8,9]
| R | P | Q | Φ | n ws 1/3 | ρ, г/см3 | V2/3 | |
| Si | 2,1 | 12,3 | 9,4 | 4,7 | 1,5 | 2,33 | 4,2 |
| Mn | 0 | 14,2 | 9,4 | 4,45 | 1,61 | 7,562 | 3,8 |
Табл. 2.2 Рассчитанные характеристики силицидов марганца.
| Аср. | Vср. | Тразл.,К [7] | ρ | |
| Mn11Si19 | 37,93 | 8,93 | 1423 | 4,25 |
| Mn5Si3 | 44,87 | 8,01 | 1556 | 5,60 |
| Mn5Si2 | 47,27 | 7,79 | 1123 | 6,07 |
| Mn9Si2 | 50,09 | 7,57 | 1333 | 6,61 |
| Mn3Si | 48,23 | 7,71 | 1353 | 6,25 |
Расчеты провели по формулам (1.1) – (1.19).
Результаты расчетов представлены в табл. 2.3.
Табл. 2.3 Стандартные энергии Гиббса образования силицидов марганца.
| хMn | хSi | xsMn | xsSi | f(x) | g | φ | ΔΗf°, Дж/моль | S2980,Дж/моль*К | ΔS2980, Дж/моль*К | ΔG2980, Дж/моль | |
| Mn11Si19 | 0,367 | 0,633 | 0,344 | 0,656 | 0,226 | 6,294 | 1,420 | -485547 | 25,30 | -683,23 | -281944 |
| MnSi* | - | - | - | - | - | - | - | -49680 | 45,42 | -5,28 | -48107 |
| Mn5Si3* | - | - | - | - | - | - | - | -151842 | 238,83 | 23,05 | -158711 |
| Mn5Si2 | 0,714 | 0,286 | 0,693 | 0,307 | 0,213 | 6,078 | 1,292 | -124289 | 29,86 | -167,07 | -74502 |
| Mn0,85Si0,15 | 0,85 | 0,15 | 0,837 | 0,163 | 0,137 | 5,989 | 0,819 | -46627 | 33,16 | -176,75 | 6045 |
| Mn3Si* | - | - | - | - | - | - | - | -26693 | 103,83 | -10,56 | -23546 |
| Mn9Si2 | 0,818 | 0,182 | 0,803 | 0,197 | 0,158 | 6,014 | 0,952 | 83007 | 28,20 | -14,13 | 87218 |
Похожие работы
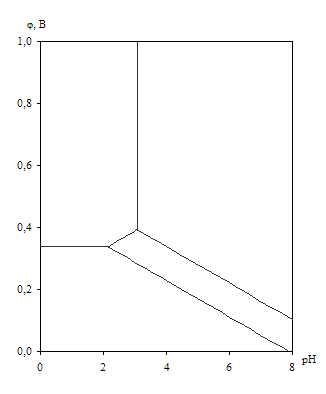
... устойчивость металлов и сплавов определяется их стойкостью к коррозии в водной среде. Лучшим способом представления термодинамической информации о химической и электрохимической устойчивости металлических систем в водных растворах являются диаграммы рН-потенциал. Впервые такие диаграммы в системе элемент-вода для чистых металлов при температуре 250С были построены Марселем Пурбе и использованы им ...
... VIII – CuO + NiO2 + {O2}. Области I и V очень малы и в масштабе диаграммы вырождаются в линии. Анализируя диаграмму Cu – Ni – O можно сделать следующие выводы о химической устойчивости медно-никелевых сплавов: 1) Окисление сплавов начинается уже при давлениях кислорода в газовой фазе над сплавами большем чем атм. Поэтому медно-никелевые сплавы будут окисляться кислородом воздуха при 25оС. 2) ...
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
абсолютно чистые минералы, расплавленные и сублимированные горные породы. Гетерогенной это такая термодинамическая система, которая состоит из двух и более гомогенных областей. Внутри такой системы имеются поверхности раздела фаз, при переходе через которые химический состав и физические свойства вещества изменяются скачкообразно. Фазой гетерогенной системы называется гомогенная область, которая ...


0 комментариев