Навигация
Моделирование фазовых равновесий в системе Mn – Si
2.4 Моделирование фазовых равновесий в системе Mn – Si
Для описания термодинамических свойств фаз переменного состава твердых растворов применялась обобщенная теория «регулярных» растворов в однопараметрическом приближении.
Уравнение реакции, соответствующее образованию R- фазы:
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
Энергии Гиббса реакций 2 и 3 описываются уравнениями температурной зависимости:
![]()
![]()
Энергия Гиббса реакции 1 может быть найдена комбинированием энергий Гиббса реакций 2 и 3:
![]()
![]() ***
***
Активности компонентов системы рассчитываем по формулам:
![]()
![]() ,
,
где ![]() .
.
«Кажущиеся» энергии смешения описываем уравнением температурной зависимости:
![]()
С учётом () уравнения () и () преобразуются:
![]() *
*
![]() **
**
Уравнение изотермы для химической реакции (1):
![]()
Константа равновесия реакции (1):
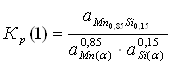
![]()
С учётом формул * и ** уравнение ***:
![]()
![]()
![]()
Пусть ![]() , тогда:
, тогда:
![]()
![]()
Преобразуем:
![]()
![]()
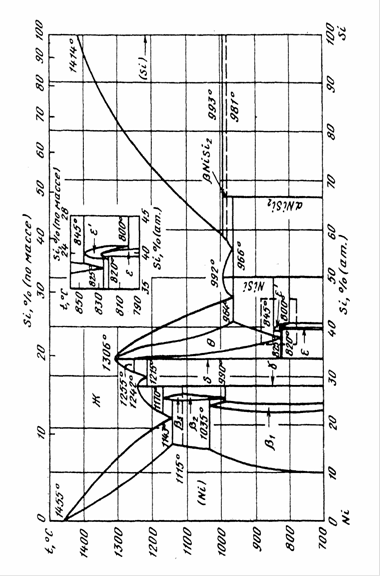
Задача сводится к нахождению неизвестных параметров уравнения![]() Необходимые для расчетов мольные доли кремния, соответствующие равновесию α-фазы с Mn0,85Si0,15 при различных температурах получили из диаграммы состояния Mn – Si.
Необходимые для расчетов мольные доли кремния, соответствующие равновесию α-фазы с Mn0,85Si0,15 при различных температурах получили из диаграммы состояния Mn – Si.
Табл. 2.5. Мольные доли кремния при различных температурах.
| Т, К | 473 | 523 | 573 | 623 | 673 | 723 | 773 | 823 | 873 | 903 |
| х (Si) | 0,0483 | 0,0500 | 0,0510 | 0,0515 | 0,0530 | 0,0550 | 0,0565 | 0,0590 | 0,0610 | 0,0625 |
Таким образом, получается система из 10 уравнений с 4 неизвестными параметрами ![]() Учитывая, что
Учитывая, что ![]() Дж/моль, то вводится дополнительное 11 уравнение
Дж/моль, то вводится дополнительное 11 уравнение ![]()
Для решения этой системы использован метод Крамера. По данному методу для системы n линейных уравнений с n неизвестными
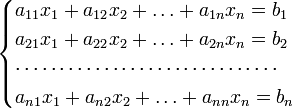
с определителем матрицы системы Δ, отличным от нуля, решение записывается в виде
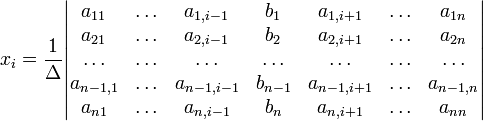
После решения данной системы найдены неизвестные параметры ![]() :
:
![]() ,
, ![]() ,
, ![]() ,
, ![]()
Далее проведена подстановка полученных значений параметров в исходную систему уравнений и установлена адекватность полученных значений.
При Т=298 К определена точка предельной растворимости кремния в альфа-марганце: ![]()
По уравнениям ……находим активности компонентов системы в точке предельной растворимости кремния в альфа-марганце:
![]() ,
, ![]()
Таким образом, исходя из полученных результатов, можно прийти к заключению, что в области низких температур (вплоть до комнатной) кремний практически не растворяется в марганце.
2.5 . Расчет и построение диаграммы состояния Mn-Si-O при 250С. Анализ химической устойчивости
Как следует из экспериментальных данных по системе марганец-кремний (рис.1.1), кремний-кислород (рис.1.4) и марганец-кислород (рис.1.5) в системе Mn-Si-O можно предположить существование областей, в которых присутствуют следующие фазы (поскольку химическое сродство кремния к кислороду выше, чем марганца, то вероятнее, что почти при любом составе сплава Mn-Si в первую очередь будет реализовываться равновесие сплав – SiO2):
1. Si(γ) – Mn11Si19 – SiO2; (I)
2. Mn11Si19 – MnSi –SiO2; (II)
3. MnSi – Mn5Si3 – SiO2; (III)
4. Mn5Si3 – Mn5Si2 – SiO2; (IV)
5. Mn5Si2– Mn3Si – SiO2; (V)
6. Mn3Si – Mn9Si2 – SiO2; (VI)
7. Mn9Si2 – R(Mn6Si) – SiO2; (VII)
8. R(Mn6Si) – α-фаза – SiO2; (VIII)
9. α-фаза – SiO2; (IX)
10. α-фаза ––MnSiO3–SiO2; (X)
11. α-фаза ––Mn2SiO4–MnSiO3; (XI)
12. α-фаза ––MnO– Mn2SiO4; (XII)
13. MnO–Mn3O4– Mn2SiO4; (XIII)
14. Mn3O4– Mn2SiO4– MnSiO3; (XIV)
15. Mn3O4–Mn2O3– MnSiO3; (XV)
16. Mn2O3– MnSiO3–SiO2; (XVI)
17. Mn2O3–MnO2–SiO2; (XVII)
18. MnO2–Mn2O7–SiO2; (XVIII)
19. Mn2O7–SiO2–{O2}; (XIX)
Для того, чтобы однозначно определить инвариантное состояние системы, необходимо задать равновесные составы сосуществующих фаз и давление кислорода в газовой фазе, равновесной с конденсированными фазами.
Примеры расчета:
а) Фазовое равновесие V: Mn5Si2– Mn3Si – SiO2
Уравнение реакции, соответствующее данному равновесию:
![]() (1)
(1)
Константа равновесия реакции (1):
 ; (2.1)
; (2.1)
Мольные доли компонентов равны единице, поэтому выражение для константы равновесия упрощается:
 ; (2.2)
; (2.2)
Уравнение изотермы химической реакции:
![]() ; (2.3)
; (2.3)
Энергия Гиббса реакции (1) рассчитывается по формуле:
![]() ; (2.4)
; (2.4)
С учетом уравнения (2.2):

б) Фазовое равновесие X:
α-фаза ––MnSiO3–SiO2 было описано независимыми реакциями образования SiO2 и MnSiO3 из компонентов α-фазы (Mn, Si) и компонентов газовой фазы O2:
(1) ![]() ;
;
(2) ![]() ;
;
![]()
![]()
Константы равновесия реакций 1 и 2:
 ; (2.3)
; (2.3)
 ; (2.4)
; (2.4)
Для определения состава α-фазы исключим ![]() из конечного термодинамического уравнения. Для этого возведем уравнение (2.3) в куб и поделим полученное на уравнение (2.4), получим:
из конечного термодинамического уравнения. Для этого возведем уравнение (2.3) в куб и поделим полученное на уравнение (2.4), получим:
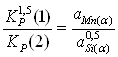 ; (2.5)
; (2.5)
Это уравнение можно переписать в виде:
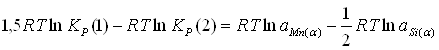 ; (2.6)
; (2.6)
Из уравнения изотермы химической реакции:
![]() ; (2.7)
; (2.7)
уравнение (2.3.4) можно переписать:
![]() ; (2.8)
; (2.8)
Данное трансцендентное уравнение можно решить только численным методом. Обозначив ![]() ,
, ![]() , получим:
, получим:
![]() ; (2.9)
; (2.9)
![]() ; (2.10)
; (2.10)
Подставив уравнения (2.9) и (2.10) в (2.8) решаем численным методом, находим значение х. Исходя из уравнений (2.3) или (2.4) определяем величину ![]() .
.
Полученные результаты сведены в таблице 2.6.
Табл.2.6 Характеристики фазовых равновесий системы Mn-Si-O при 25 0С
| Состояние | Уравнение реакции |
|
|
| Si – Mn11Si19 – SiO2 | Si(A) + O2 = SiO2 | 805067 | 7,7e-142 |
| Mn11Si19 – MnSi –SiO2 | Mn11Si19 + 8O2 = 11MnSi + 8SiO2 | 789464 | 4,18E-139 |
| MnSi – Mn5Si3 – SiO2 | 5MnSi + 2O2 = Mn5Si3 + 2SiO2 | 757015 | 2,04E-133 |
| Mn5Si3 – Mn5Si2 – SiO2 | Mn5Si3 + O2 = Mn5Si2 + SiO2 | 742497 | 7,14E-131 |
| Mn5Si2– Mn3Si – SiO2 | 3Mn5Si2 + O2 = 5Mn3Si + SiO2 | 739167 | 2,74E-130 |
| Mn3Si – Mn9Si2 – SiO2 | 3Mn3Si + O2 = Mn9Si2 + SiO2 | 736728 | 7,33E-130 |
| Mn9Si2 – Mn6Si – SiO2 | 2Mn9Si2 + O2 = 3Mn6Si + SiO2 | 702737 | 1,99E-129 |
| Mn6Si – α – SiO2 xSi(α)=0,0361; aMn(α)=0,91 | Mn6Si + O2 = 6Mn(α) + SiO2 | 693587 | 3,77E-122 |
| α – SiO2 | Si(α)+O2=SiO2 Mn(α)+Si(α)+1,5O2=MnSiO3 | ||
| α ––MnSiO3–SiO2 | 2,3Е-128 | ||
| α ––Mn2SiO4–MnSiO3 | - | - | - |
| α ––MnO– Mn2SiO4 | - | - | - |
| MnO–Mn3O4– Mn2SiO4 | 6MnO + O2 = 2Mn3O4 | 387290 | 1,3E-68 |
| Mn3O4– Mn2SiO4– MnSiO3 | 6Mn2SiO4 + O2 = 6MnSiO3 + 2Mn3O4 | 375710 | 1,4E-66 |
| Mn3O4–Mn2O3– MnSiO3 | 4Mn3O4 + O2 = 6Mn2O3 | 147860 | 1,21E-26 |
| Mn2O3–MnO2–MnSiO3 | 2Mn2O3 + O2 = 4MnO2 | 102920 | 9,1E-19 |
| MnO2 – MnSiO3 – SiO2 | 2MnSiO3 + O2 = 2MnO2 + 2SiO2 | 200474 | 7,25E-36 |
| MnO2–Mn2O7–SiO2 | 4MnO2 + 3O2 = 2Mn2O7 | 1335600 | 1,09E+78 |
| Mn2O7–SiO2–{O2} |
кремний марганец термодинамический химический равновесие
Рассчитать равновесия 10-12 не представляется возможным, что может свидетельствовать о том, что какой-либо из силицидов окисляется до силиката раньше, чем α-фаза. С этим же может быть связана и неупорядоченная последовательность вычисленных значений Р(О2).
Для того, чтобы показать термодинамическую возможность или невозможность осуществления реакций между оксидами марганца и кремния в равновесии с альфа-фазой, выполнены следующие расчёты. Для каждой из возможных реакций вычислен интервал значений Q12, удовлетворяющий условию возможности протекания этой реакции при в области составов системы Mn – Si, при которой альфа-фаза термодинамически устойчива.
1) ![]()
![]() ;
;
![]() ;
;
![]() ;
;
 .
.
2) ![]()
![]() ;
;
![]() ;
;
![]() ;
;
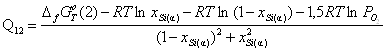 .
.
3) ![]()
![]() ;
;
![]() ;
;
![]() ;
;
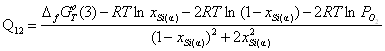 .
.
4) ![]()
![]() ;
;
![]() ;
;
![]() ;
;
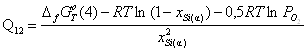 .
.
При оценке параметров Q12 необходимо учесть следующие условия: а) мольная доля кремния в альфа-фазе должна находиться в пределах существования альфа-фазы – ![]() ; б) давление кислорода в газовой фазе над конденсированной фазой не должно быть больше значения, при котором возможно окисление чистого марганца –
; б) давление кислорода в газовой фазе над конденсированной фазой не должно быть больше значения, при котором возможно окисление чистого марганца – ![]() атм. Подставляя в выражения для энергий смешения значения энергий Гиббса реакций (1) – (4), получаем следующие неравенства:
атм. Подставляя в выражения для энергий смешения значения энергий Гиббса реакций (1) – (4), получаем следующие неравенства:
Для реакции (1): ![]() ,
,
Для реакции (2): ![]() ,
,
Для реакции (3): ![]() ,
,
Для реакции (4): ![]() .
.
Сравнивая между собой полученные значения Q12, можно прийти к выводу о том, что протекание реакций между оксидами марганца и кремния в равновесии с альфа-фазой невозможно.
Таким образом, предположение о том, что окисление SiO2 до MnSiO3, MnSiO3 до Mn2SiO4, Mn2SiO4 до MnO реализуются в равновесии с альфа-фазой, не подтвердилось. Поэтому необходимо проверить предположение о том, что вышеуказанные реакции реализуются в равновесии с одним из силицидов марганца. Для этого были рассмотрены все возможные трёхфазные равновесия в системе Mn-Si-O, которые представлены в таблице.
Табл. 2.7 Все возможные трёхфазные равновесия в системе Mn-Si-O
| Состояние | Уравнение реакции |
| Si – Mn11Si19 – SiO2 | Si(A) + O2 = SiO2 |
| Mn11Si19 – MnSi –SiO2 | Mn11Si19 + 8O2 = 11MnSi + 8SiO2 |
| MnSi – Mn5Si3 – SiO2 | 5MnSi + 2O2 = Mn5Si3 + 2SiO2 |
| Mn5Si3 – Mn5Si2 – SiO2 | Mn5Si3 + O2 = Mn5Si2 + SiO2 |
| Mn5Si2– Mn3Si – SiO2 | 3Mn5Si2 + O2 = 5Mn3Si + SiO2 |
| Mn3Si – Mn9Si2 – SiO2 | 3Mn3Si + O2 = Mn9Si2 + SiO2 |
| Mn9Si2 – Mn0,85Si0,15 – SiO2 | 17Mn9Si2 + 7O2 = 180Mn0,85Si0,15 + 7SiO2 |
| Mn0,85Si0,15 – α – SiO2 xSi(α)=0,042; aMn(α)=0,855 | 20Mn0,85Si0,15 + 3O2 = 17Mn(α) + 3SiO2 |
| ================= | ================= |
| Mn11Si19 – SiO2 – MnSiO3 | 2Mn11Si19 + 49O2 = 22MnSiO3 + 16SiO2 |
| MnSi – SiO2 – MnSiO3 | 2MnSi + 0SiO2 + 3O2 = 2MnSiO3 |
| Mn5Si3 – SiO2 – MnSiO3 | 2Mn5Si3 + 4SiO2 + 11O2 = 10MnSiO3 |
| Mn5Si2 – SiO2 – MnSiO3 | 2Mn5Si2 + 6SiO2 + 9O2 = 10MnSiO3 |
| Mn3Si – SiO2 – MnSiO3 | 2Mn3Si + 4SiO2 + 5O2 = 6MnSiO3 |
| Mn9Si2 – SiO2 – MnSiO3 | 2Mn9Si2 + 14SiO2 + 13O2 = 18MnSiO3 |
| Mn0,85Si0,15 – SiO2 – MnSiO3 | 40Mn0,85Si0,15 + 28SiO2 + 23O2 = 34MnSiO3 |
| ================== | ================= |
| Si – Mn11Si19 – MnSiO3 | 2Mn11Si19 + 33O2 = 22MnSiO3 + 16Si |
| Mn11Si19 – MnSi – MnSiO3 | 0Mn11Si19 + 2MnSi + 3O2 = 2MnSiO3 |
| MnSi – Mn5Si3 – MnSiO3 | 2MnSi + 3O2 = 0Mn5Si3 + 2MnSiO3 |
| Mn5Si3 – Mn5Si2 – MnSiO3 | 6Mn5Si3 + 15O2 = 4Mn5Si2 + 10MnSiO3 |
| Mn5Si2– Mn3Si – MnSiO3 | 4Mn5Si2 + 3O2 = 6Mn3Si + 2MnSiO3 |
| Mn3Si – Mn9Si2 – MnSiO3 | 14Mn3Si + 9O2 = 4Mn9Si2 + 6MnSiO3 |
| Mn9Si2 – Mn0,85Si0,15 – MnSiO3 | 4Mn9Si2 + 3O2 = 40Mn0,85Si0,15 + 2MnSiO3 |
| Mn0,85Si0,15 – α – MnSiO3 xSi(α)=0,042; aMn(α)=0,855 | 40Mn0,85Si0,15 + 9O2 = 28Mn(α) + 6MnSiO3 |
| ================== | ================= |
| Mn11Si19 – MnSiO3 – Mn2SiO4 | 2Mn11Si19 + 16Mn2SiO4 + 49O2 = 54MnSiO3 |
| MnSi – MnSiO3 – Mn2SiO4 | 2MnSi + 3O2 = 0Mn2SiO4 + 2MnSiO3 |
| Mn5Si3 – MnSiO3 – Mn2SiO4 | 2Mn5Si3 + 11O2 = 2MnSiO3 + 4Mn2SiO4 |
| Mn5Si2 – MnSiO3 – Mn2SiO4 | 2Mn5Si2 + 2MnSiO3 + 9O2 = 6Mn2SiO4 |
| Mn3Si – MnSiO3 – Mn2SiO4 | 2Mn3Si + 2MnSiO3 + 5O2 = 4Mn2SiO4 |
| Mn9Si2 – MnSiO3 – Mn2SiO4 | 2Mn9Si2 + 10MnSiO3 + 13O2 = 14Mn2SiO4 |
| Mn0,85Si0,15 – MnSiO3 – Mn2SiO4 | 40Mn0,85Si0,15 + 22MnSiO3 + 23O2 = 28Mn2SiO4 |
| ================== | ================= |
| Si – Mn11Si19 – Mn2SiO4 | 2Mn11Si19 + 22O2 = 27Si + 11Mn2SiO4 |
| Mn11Si19 – MnSi – Mn2SiO4 | 27MnSi + 16O2 = Mn11Si19 + 8Mn2SiO4 |
| MnSi – Mn5Si3 – Mn2SiO4 | Mn5Si3 + 4O2 = MnSi + 2Mn2SiO4 |
| Mn5Si3 – Mn5Si2 – Mn2SiO4 | Mn5Si3 + Mn5Si2 + 10O2 = 5Mn2SiO4 |
| Mn5Si2– Mn3Si – Mn2SiO4 | Mn5Si2 + 2O2 = Mn3Si + Mn2SiO4 |
| Mn3Si – Mn9Si2 – Mn2SiO4 | 5Mn3Si + 6O2 = Mn9Si2 + 3Mn2SiO4 |
| Mn9Si2 – Mn0,85Si0,15 – Mn2SiO4 | 11Mn9Si2 + 14O2 = 100Mn0,85Si0,15 + 7Mn2SiO4 |
| Mn0,85Si0,15 – α – Mn2SiO4 xSi(α)=0,042; aMn(α)=0,855 | 20Mn0,85Si0,15 + 6O2 = 11Mn(α) + 3Mn2SiO4 |
| ================== | ================= |
| Mn11Si19 – Mn2SiO4 – MnO | 2Mn11Si19 + 54MnO + 49O2 = 38Mn2SiO4 |
| MnSi – Mn2SiO4 – MnO | 2MnSi + 2MnO + 3O2 = 2Mn2SiO4 |
| Mn5Si3 – Mn2SiO4 – MnO | 2Mn5Si3 + 2MnO + 11O2 = 6Mn2SiO4 |
| Mn5Si2 – Mn2SiO4 – MnO | 2Mn5Si2 + 9O2 = 4Mn2SiO4 + 2MnO |
| Mn3Si – Mn2SiO4 – MnO | 2Mn3Si + 5O2 = 2Mn2SiO4 + 2MnO |
| Mn9Si2 – Mn2SiO4 – MnO | 2Mn9Si2 + 13O2 = 4Mn2SiO4 + 10MnO |
| Mn0,85Si0,15 – Mn2SiO4 – MnO | 40Mn0,85Si0,15 + 23O2 = 6Mn2SiO4 + 22MnO |
| ================== | ================= |
| Si – Mn11Si19 – MnO | 2Mn11Si19 + 11O2 = 38Si(A) + 22MnO |
| Mn11Si19 – MnSi – MnO | 19MnSi + 4O2 = Mn11Si19 + 8MnO |
| MnSi – Mn5Si3 – MnO | Mn5Si3 + O2 = 3MnSi + 2MnO |
| Mn5Si3 – Mn5Si2 – MnO | 6Mn5Si2 + 5O2 = 4Mn5Si3 + 10MnO |
| Mn5Si2– Mn3Si – MnO | 4Mn3Si + O2 = 2Mn5Si2 + 2MnO |
| Mn3Si – Mn9Si2 – MnO | 2Mn9Si2 + 3O2 = 4Mn3Si + 6MnO |
| Mn9Si2 – Mn0,85Si0,15 – MnO | 80Mn0,85Si0,15 + 7O2 = 6Mn9Si2 + 14MnO |
| Mn0,85Si0,15 – α – MnO xSi(α)=0,042; aMn(α)=0,855 | 2Mn(α) + O2 = 2MnO |
| ================== | ================= |
| MnO – Mn3O4 – Mn2SiO4 | 6MnO + O2 = 2Mn3O4 |
| Mn3O4 – Mn2SiO4 – MnSiO3 | 6Mn2SiO4 + O2 = 6MnSiO3 + 2Mn3O4 |
| Mn3O4 – Mn2O3 – MnSiO3 | 4Mn3O4 + O2 = 6Mn2O3 |
| Mn2O3 – MnO2 – MnSiO3 | 2Mn2O3 + O2 = 4MnO2 |
| MnO2 – MnSiO3 – SiO2 | 2MnSiO3 + O2 = 2MnO2 + 2SiO2 |
| MnO2 – Mn2O7 – SiO2 | 4MnO2 + 3O2 = 2Mn2O7 |
| Mn2O7 – SiO2 – {O2} |
Задача состоит в том, чтобы подобрать последовательность равновесий, которая бы удовлетворяла условию возрастания давления кислорода в системе. При этом возможно проводить варьирование значений энергий Гиббса образования силицидов в пределах возможных справочных значений.
После многократного согласования энергий Гиббса образования силицидов, взятых из различных источников, получен следующий вариант последовательности окисления.
1. Si – Mn11Si19 – SiO2; (I)
2. Mn11Si19 – MnSi – SiO2; (II)
3. MnSi– Mn5Si3– SiO2; (III)
4. Mn5Si3 – MnSiO3– SiO2; (IV)
5. Mn5Si3 – MnSiO3 – Mn2SiO4; (V)
6. Mn5Si3 – Mn5Si2 – Mn2SiO4; (VI)
7. Mn5Si2– Mn3Si – Mn2SiO4; (VII)
8. Mn3Si –Mn2SiO4 – MnO; (VIII)
9. Mn9Si2 – Mn3Si – MnO; (IX)
10. Mn0,85Si0,15 – Mn9Si2 – MnO; (X)
11. α – Mn0,85Si0,15– MnO; (XI)
12. MnO – Mn3O4 – Mn2SiO4; (XII)
13. Mn3O4 – Mn2SiO4 – MnSiO3; (XIII)
14. Mn3O4 – Mn2O3 – MnSiO3; (XIV)
15. Mn2O3 – MnO2 – MnSiO3; (XV)
16. MnO2 – MnSiO3 – SiO2; (XVI)
17. MnO2 – Mn2O7 – SiO2; (XVII)
18. Mn2O7–SiO2–{O2}; (XVIII)
Примеры расчета:
а) Фазовое равновесие III: MnSi– Mn5Si3 – SiO2
Уравнение реакции, соответствующее данному равновесию:
![]() (1)
(1)
Константа равновесия реакции (1):
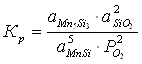 ; (2.1)
; (2.1)
Мольные доли компонентов равны единице, поэтому выражение для константы равновесия упрощается:
![]()
 ; (2.2)
; (2.2)
Уравнение изотермы химической реакции:
![]() ; (2.3)
; (2.3)
Энергия Гиббса реакции (1) рассчитывается по формуле:
![]() ; (2.4)
; (2.4)
С учетом уравнения (2.2):

б) Фазовое равновесие X:
Mn0,85Si0,15 – Mn9Si2 – MnO
Уравнение реакции, соответствующее данному равновесию:
80Mn0,85Si0,15 + 7O2 = 6Mn9Si2 + 4MnO
Константа равновесия реакции (2):
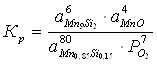 ;
;
Мольные доли компонентов равны единице, поэтому выражение для константы равновесия упрощается:
 ;
;
Дальнейшие расчёты аналогичны предыдущему.
в) Фазовое равновесие XI:
α – Mn0,85Si0,15– MnO
Уравнение реакции, соответствующее данному равновесию:
2Mn(α)+O2=2MnO
Константа равновесия реакции (3):
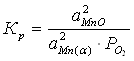 ;
;
Мольная доля чистого вещества равна единице, поэтому выражение для константы равновесия упрощается:
 (4)
(4)
Равновесие MnO с альфа-фазой является моновариантным, поэтому давление кислорода в газовой фазе, равновесной с конденсированной фазой, будет зависеть от активности марганца в альфа-фазе. Однозначно определить его можно, например, для точки, соответствующей предельной растворимости кремния в марганце. В этой точке мольная доля кремния ![]() ,
, ![]() и
и ![]() .
.
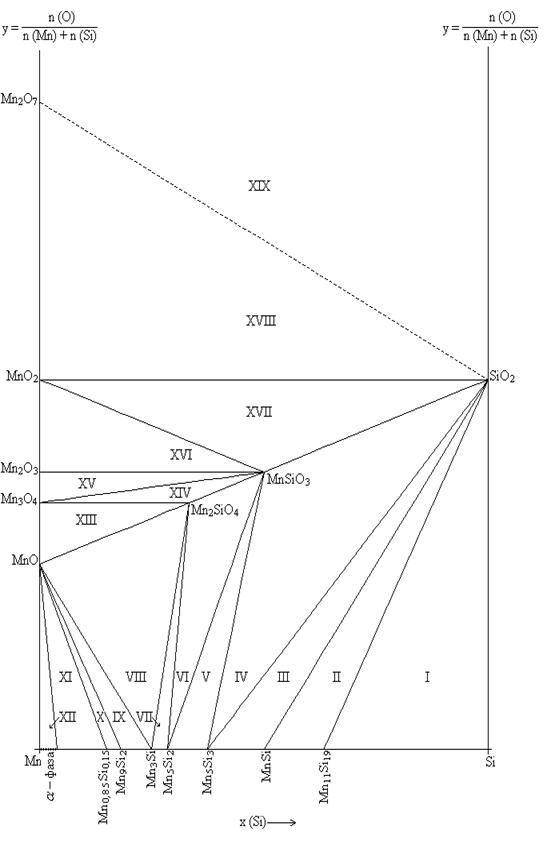
Рис.2.1. Фазовая диаграмма состояния системы Mn-Si-O при 25 0С.
Таблица 2.8 Характеристики фазовых равновесий системы Mn-Si-O при 25 0С
| № | Равновесие | Уравнение реакции |
| Равновесный состав фаз | ||||
| I | Si – Mn11Si19 – SiO2 | Si(A) + O2 = SiO2 |
|
| ||||
| II | Mn11Si19 – MnSi – SiO2 | Mn11Si19 + 8O2 = 11MnSi + 8SiO2 |
|
| ||||
| III | MnSi– Mn5Si3– SiO2 | 5MnSi + 2O2 = Mn5Si3 + 2SiO2 |
|
| ||||
| IV | Mn5Si3 – MnSiO3– SiO2 | 2Mn5Si3 + 4SiO2 + 11O2 = 10MnSiO3 |
|
| ||||
| V | Mn5Si3 – Mn5Si2–MnSiO3 | 6Mn5Si3 + 15O2 = 4Mn5Si2 + 10MnSiO3 |
|
| ||||
| VI | Mn5Si2–MnSiO3–Mn2SiO4 | 2Mn5Si2 + 2MnSiO3 + 9O2 = 6Mn2SiO4 |
|
| ||||
| VII | Mn5Si2– Mn3Si – Mn2SiO4 | Mn5Si2 + 2O2 = Mn3Si + Mn2SiO4 |
|
| ||||
| VIII | Mn3Si –Mn2SiO4 - MnO | 2Mn3Si + 5O2 = 2Mn2SiO4 + 2MnO |
|
| ||||
| IX | Mn9Si2 – Mn3Si – MnO | 2Mn9Si2 + 3O2 = 4Mn3Si + 6MnO |
|
| ||||
| X | Mn0,85Si0,15–Mn9Si2–MnO | 80Mn0,85Si0,15 + 7O2 = 6Mn9Si2 + 4MnO |
|
| ||||
| XI | α – Mn0,85Si0,15– MnO | 2Mn(α)+O2=2MnO |
|
| ||||
| XII | α– MnO | |||||||
| XIII | MnO – Mn3O4 – Mn2SiO4 | 6MnO + O2 = 2Mn3O4 |
|
| ||||
| XIV | Mn3O4–Mn2SiO4–MnSiO3 | 6Mn2SiO4 + O2 = 6MnSiO3 + 2Mn3O4 |
|
| ||||
| XV | Mn3O4 – Mn2O3 – MnSiO3 | 4Mn3O4 + O2 = 6Mn2O3 |
|
| ||||
| XVI | Mn2O3 – MnO2 – MnSiO3 | 2Mn2O3 + O2 = 4MnO2 |
|
| ||||
| XVII | MnO2 – MnSiO3 – SiO2 | 2MnSiO3 + O2 = 2MnO2 + 2SiO2 |
|
| ||||
| XVIII | MnO2 – Mn2O7 – SiO2 | 4MnO2 + 3O2 = 2Mn2O7 |
|
| ||||
| XIX | Mn2O7–SiO2–{O2} | |||||||
Список литературы
1. Гельд П. В., Сидоренко Ф. А. Силициды переходных металлов четвертого периода. М.: Металлургия, 1971. С. 120 – 143.
2. Диаграммы состояния двойных металлических систем. Под общей ред. Н. П. Лякишева. М.: Машиностроение, 1997-2000. Т. 3 кн.1. С. 361,383,698
3. «Твёрдые растворы. Химическая энциклопедия»
http://www.xumuk.ru/encyklopedia/2/4329.html
4. Тюрин А. Г. Термодинамика химической и электрохимической устойчивости сплавов: Учеб. Пособие в 2 ч. Часть 1.Общие принципы. Высокотемпературное окисление. Челябинск: Изд-во ЧелГУ, 2004. 86 с.
5. «Интерметаллиды. Химическая энциклопедия». 02.06.2009.
http://www.xumuk.ru/encyklopedia/1712.html
6. Мосунова Т.В. Термодинамика химической и электрохимической устойчивости сплавов системы Co-Si: дипломная работа // рук. Тюрин А.Г. Челябинск, 2001. 56 с.
7. Тюрин А.Г. Моделирование термодинамических свойств растворов: Учебное пособие; Челябинск: ЧелГУ, 1997. 74 с.
8. О. Кубашевски. Диаграммы состояния двойных систем на основе железа: справ. изд. / пер. с англ. М.: Металлургия, 1985. С. 175 – 179.
9. Могутнов Б. М., Томилин И. А., Шварцман Л. А. Термодинамика сплавов железа. М.: Металлургия, 1984. 208 с.
10. Рузинов Л. П., Гуляницкий Б. С. Равновесные превращения металлургических реакций. М.: Металлургия, 1975. 416 с.
11. База данных «Термические константы веществ».
12. Моисеев и др. Температурные зависимости приведённой энергии Гиббса.
13. Ерёменко и др. Физическая химия неорганических материалов.
Похожие работы
... устойчивость металлов и сплавов определяется их стойкостью к коррозии в водной среде. Лучшим способом представления термодинамической информации о химической и электрохимической устойчивости металлических систем в водных растворах являются диаграммы рН-потенциал. Впервые такие диаграммы в системе элемент-вода для чистых металлов при температуре 250С были построены Марселем Пурбе и использованы им ...
... VIII – CuO + NiO2 + {O2}. Области I и V очень малы и в масштабе диаграммы вырождаются в линии. Анализируя диаграмму Cu – Ni – O можно сделать следующие выводы о химической устойчивости медно-никелевых сплавов: 1) Окисление сплавов начинается уже при давлениях кислорода в газовой фазе над сплавами большем чем атм. Поэтому медно-никелевые сплавы будут окисляться кислородом воздуха при 25оС. 2) ...
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
абсолютно чистые минералы, расплавленные и сублимированные горные породы. Гетерогенной это такая термодинамическая система, которая состоит из двух и более гомогенных областей. Внутри такой системы имеются поверхности раздела фаз, при переходе через которые химический состав и физические свойства вещества изменяются скачкообразно. Фазой гетерогенной системы называется гомогенная область, которая ...


0 комментариев