Навигация
Сигнальные молекулы, их способность индуцировать процессинг тДНК
1.3. Сигнальные молекулы, их способность индуцировать процессинг тДНК
Экспрессию генов vir-области индуцируют специфические сигнальные молекулы посредством позитивной регуляции системы в состав которой входят гены virA и virG [Melchers et al., 1986; Stackel, Zambryski, 1986].
Активаторами транскрипции vir-генов являются низкомолекулярные моноциклические фенольные соединения, синтезируемые в механически поврежденных тканях растений [Stuchel, 1985]. Примерами таких соединений являются ----------- и довольно широкий круг производных ------- биосинтетического пути метаболитов защитной природы или предшественников лигнина.
Сигнальные молекулы были впервые обнаружены в экссудатах корней и листьев двудольного растения Nicotiano tabacum, они были идентифицированы как ----- и -------. Эти соединения синтезировали метаболически активные поврежденные ткани растений. В настоящее время установлена сигнальная индуцирующая активность у большой группы ------- соединений растительной природы. Механическое повреждение тканей растений приводит к усилению синтеза таких сигнальных соединений. Известно, что ------------ и коричная кислоты, проявляющие сигнальную активность, обладают так же антимикробными свойствами и являются промежуточными метаболитами на пути синтеза -------. ---------- распознаются специфическими рецепторами агробактерий, являющимися трансмембранными хеморецептргыми белками с различной ------- к таким молекулам [Leroux, 1987]. Для оптимальной индукции экспрессии генов vir требуется присутствие в эксцудатах растений различных углеводов: глюкозы, глюкуроновой кислоты, галактозы, галактуроновой кислоты, арабинозы, маннозы, фукозы, целлобиозы и ксилозы, представляющих компоненты клеточной стенки растений. Такие углеводы связываются с периплазматическим доменом рецептора в виде предварительно обработанного комплекса с белком-продуктом хромосомного вирулентного гена Chv E, причем конечный результат индукции процессинга тДНК зависит от синергической активности сигнальных соединений и сахаров эксцудатов растений.
Структурная формула:
Позитивная регуляторная система vir A – vir G, контролирующая экспрессию генов vir -----, работает следующим образом. Экспрессируемый конститутивно ген vir A выполняет функцию рецепции сигнальных молекул растений и трансмиссии этого сигнала в бактериальную клетку. Этот мембранный хеморецептор после принятия внешнего сигнала активирует продукт гена vir G, который в свою очередь выступает в качетве позитивного регулятора собственной транскрипции и транскрипции остальных генов vir -----. Механизмы активации следующие.
Белок vir A, дважды пронизывающий мембрану бактерии, при появлении сигнальных молекул автофосфорилируется --------- на своем С-конце, переходя в активную форму. (В отсутствии индукции С-терминальный домен белки vir A взаимодействуют с W-терминальным доменом, ингибируя киназную активность).
Активированный белок vir A в свою очередь --------- внутренний клеточный белок – трансдуктор сигнала vir a по остатку аспарагина – 52 [Jin et al., 1990]. Фосфорилированный белок vir G связывается с промоторами остальных генов регулона и со своим собственным, выступая в качестве транскрипционного активатора. Индукция vir генов обратимая, и каскад реакций может быть прерван, что очень важно для патогена: в случае, если хозяин больной и нежизнеспособный организм, перенос тДНК в его клетки не осуществляется [Hess et al., 1991].
Кроме позитивной регуляторной системы vir A – vir G, локализованной на Ti-плазмиде, в регуляции экспрессии vir-генов принимают участие также хромосомные гены. Об этом свидетельствует обнаружение спонтанного хромосомного мутанта ros, у которого гены vir C и vir D – оперонов экспрессируются в отсутствие сигнальных молекул растений.
3. Материалы и методы
2.1. Материалы
2.1.1. Оборудование
Копалка, термомиксер 5436, центрифуга "Эппиндорф", прибор для горизонтального электрофореза, источник питания 2197, термостат ТС–80 Мг.
2.1.2. Бактериальные штаммы и плазмиды| Штамм: | Escherichia coli HB 101 Agrobacterium tumefaciens C58C1 |
| Плазмиды: | рGV3850 |
| тДНК: | рBR322 маркер Ар, Тс |
2.1.3. Растения
В качестве объектов исследования использовали двух–, трехмесячное однодольное растение ряски крошечной (Lemna perpusilla).
Растения выращивали в теплице в вегетационных сосудах при температуре 18–250 С и 12 часовом световом периоде. Относительную влажность воздуха в теплице поддерживали в пределах 65–70%. Для анализа брали стерильные ткани листьев. Стерилизацию проводили гипохлоридом натрия в течение 5–10 минут, а затем материал 3 раза промывали стерильной водой и использовали в экспериментах по индукции vir–генов Ti–плазмид. Для сравнения были взяты двудольные растения табака красного и льна долгунца.
2.1.4. Среды микробиологические для культивирования растений
В работе использовали среды:
1. Для микроорганизмов – LB (Лурия–Бертани)
| NaCl Дрожжевой экстракт Бантотриптон | 10 мг/л 5 г/л 5 г/л |
рН 7,5
Температура 240 С
Длина светового дня 16 часов
На чашку Петри:
| LB штамм | 10 мл 1 мл |
2. Для культивирования растений – среда MS (Мурасиге–Скуча) приведена в таблице.
2.1.5. Другие растворы
Фосфатный буфер
ТЕ буфер (10 мМТрис–HCl (pH 8.0), 1 мМ ЭДТА)
Саркозилат Na
Проназы – 1,5 мг/мл
Фенол
Хлороформ
Агарозные гели
Фитогормоны:
БАП (6–бензиламинопурин) растворяли в растворе 0,1 – NaOH
HУК (2–нафтилуксусная кислота) растворяли в этаноле и разводили водой до 10 мг/мл. Стерилизовали фильтрованием через фильтры В 485.
Ацетосирингон растворяли в 70% спирте (этаноле) в концентрации 10 мг/мл. Добавляли в среду MS до конечной концентрации 100 мМ.
2.1.6. Ферменты, используемые в генной инженерии
Гидролиз ДНК проводили рестрикционными эндонуклеазами:
Hind III, Bam Hi, Sal I, Eco RI.
2.1.7. Антибиотики
Ампицилин 50, Н2О 50. Для селекции бактерий с определенными плазмидами.
2.2. Методы
2.2.1. Инкубация Agrobacterium tumefaciens с экссудатами тканей растений
Ночную культуру A. tumefaciens С58С1 (pGV3850), выращенную на ротационном шейкере (20 циклов/мин) при 290 С в жидкой среде LB, собирали центрифугированием и суспензировали в среде МС – 0,1 М фосфатном буфере (рН 5,5) до кислотности А600 – 0,05.
После 5 часов роста в бактериальную культуру добавляли мелконарезанные стерильные ткани растений (листья, стебли) в количестве 2 г на 10 мл среды и продолжали инкубацию в течение 48 часов.
В качетве положительного контроля использовали агробактериальную культуру с добавлением в качестве индуктора 100 мкМ ацетосирингона. В качестве отрицательного контроля использовали агробактериальные клетки, выращенные на среде без ацетосирингона и эксцудатов растений.
Эффективность индукции процессинга тДНК церез 48 часов инкубации агробактерий с тканями растений. Титр жизнеспособных бактерий после инкубации с эксцудатами растений проверяли путем их высева в различных разведениях на чашки Петри с агаризованной средой LB. Каждый вариант опытов проводили в трех повторностях.
Похожие работы
... очередь, активизирует ферменты — киназы подобно тому, как цифровая информация наносится на поверхность компакт-диска. Участки мозга человека, отвечающие за различные виды забывчивости: „выветривание“ воспоминаний со временем, рассеянность, заторможенность (например, человек забыл слово, вертящееся на языке), нарушение причинно-следственных связей в воспоминаниях, придуманные воспоминания ...
... Во-вторых, в настоящее время известно достаточное количество соединений, нерастворимых в неполярных растворителях или же, наоборот, хорошо растворимых в воде, которые, тем не менее, относят к липидам. В современной органической химии определение термина «липиды» основано на биосинтетическом родстве данных соединений — к липидам относят жирные кислоты и их производные [1]. В то же время в биохимии ...
... . Очевидно, что научное наследие, оставляемое нам И. И. Мечниковым, и в будущем будет определять основные направления учения о фагоцитах. Макрофаги перитонеального экссудата как модель фагоцитоза и нарушений фагоцитарной активности. В организме человека фагоцитирующую функцию выполняют несколько типов клеток. Прежде всего, это те клетки, которые осуществляют защиту при каких-либо инфекциях и ...
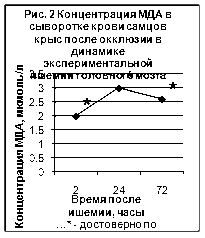
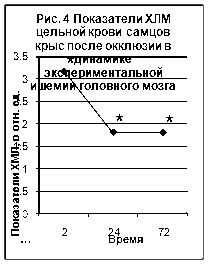
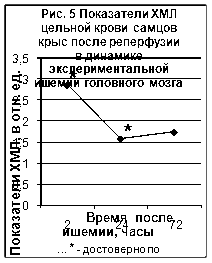
... ТБК-активных продуктов – малонового диальдегида (МДА), показателям люминолзависимой хемилюминесценции. 3.2. Исследование активности хемилюминесценции цельной крови и концентрации МДА в сыворотке крови при экспериментальной ишемии головного мозга Центральное место в изучении ишемического инсульта занимают экспериментальные модели на животных [65]. Именно по результатам эксперимента ...



0 комментариев