Навигация
Строение индивидуального расплава трихлорида
1.1.1. Строение индивидуального расплава трихлорида
гадолиния.
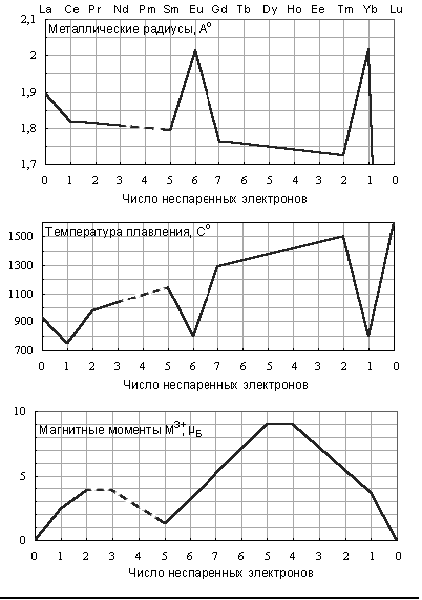
Кристаллические хлориды элементов от лантана до европия, включая гадолиний, имеют гексагональную решетку, а от диспрозия до лютеция (также и хлорид иттрия),- моноклинную. Температура плавления хлоридов РЗЭ постепенно снижается от лантана до диспрозия, а затем снова возрастает до лютеция; летучесть хлоридов увеличивается с возрастанием порядкового номера элемента, т.е. с увеличением ионного радиуса.
Безводные трихлориды очень гигроскопичны и расплываются на воздухе. Хорошо растворяются в воде и спирте. Поглощают NH3, выделяя теплоту и образуя аммиакаты LnCl3.n NH3. Заслуживает внимания тот факт, что монокристалл GdCl3 при низких температурах становится ферромагнетиком при 2,2˚К [2]. В данной работе отмечается, что в ряду лантаноидов трихлориды от La до Gd включительно изоструктурны (гексагональная типа UCl3). Здесь же отмечается, что GdCl3 – вещество с высокой температурой плавления (602˚С), в вакууме при высокой температуре летуче, что подтверждается данными по давлению паров [3].
Под строением ионного расплава понимают состав и взаимное расположение частиц, из которых он состоит. Первые выводы о строении ионных расплавов были сделаны на основании изучения их физико-химических свойств. Значительный прогресс в наших представлениях о строении ионных расплавов был достигнут в результате рентгеноструктурных и спектроскопических исследований. Вопреки прежним положениям, в соответствии с которыми жидкости вообще и ионные расплавы в частности считались отдаленными аналогами газов, а из рентгеновских исследований вытекает, что их нужно рассматривать как аналоги твердых кристаллических структур.
Однако если в структуре твердых кристаллов трихлорида гадолиния имеются как ближний, так и дальний порядок во взаимном расположении частиц, то в ионном расплаве сохраняется лишь ближний порядок. При плавлении кристаллов этого вещества дальний порядок разрушается. Рентгеновские исследования [4] несколько неожиданно показали уменьшение межионных расстояний в этом случае. Данный факт объясняется тем, что увеличение объема ионного вещества при его плавлении происходит не за счет возрастания параметров «кристаллической решетки», а «дефектов» в расплавленном ионном кристалле. Такое состояние ионного вещества называется квазикристаллическим. К тому же, по сравнению с твердым GdCl3, ионный расплав трихлорида гадолиния характеризуется большими свободными объемами. В работе [5] отмечается, что в расплавленном GdCl3 в качестве структурных единиц существуют также кластерные димеры и более полимеризованные комплексные анионы.
Итак, на основании рентгенографических исследований [6] структуры расплавленного GdCl3 можно сделать следующие выводы:
1. расстояния между разноименными ионами меньше, а между одноименными больше в солевом расплаве, чем в кристаллическом трихлориде гадолиния;
2. координационное число в расплаве ниже, чем в твердом GdCl3;
3. в высокой степени сохраняется ближний порядок во взаимном расположении частиц.
На основании всего сказанного можно говорить о следующих составных слагающих ионного расплава трихлорида гадолиния: разноименно заряженные ионы (Gd3+, Cl-), недиссоциированные молекулы, ассоциаты (например Gd2Cl6), свободные объемы (дислокации, дырки).
1.1.2. Строение растворов расплава трихлорида гадолиния в
хлоридах щелочных металлов
Изучение взаимодействия хлоридов РЗМ с хлоридами щелочных металлов представляет большой интерес для характеристики расплава, кроме того, чистые хлориды РЗМ и их смеси с хлоридами щелочных металлов являются одними из исходных соединений для получения редкоземельных металлов высокой чистоты.
В расплавленном трихлориде гадолиния и его смесях с хлоридами щелочных металлов образуются прочные комплексные группировки с большим числом аддентов, что подтверждается различными методами исследований.
Например, для изучения комплексообразования РЗЭ в солевых хлоридных расплавах применены методы изоморфной сокристаллизации и ионного обмена [7]. В данной работе исследованы хлоридные расплавы, содержащие микроконцентрации РЗЭ.
Из диаграмм состояния бинарных систем типа MIIICl3 - MICl, где MIII – РЗЭ; MI – щелочной металл, следует, что все хлориды РЗЭ образуют конгруэнтные либо инконгруэнтные соединения с хлоридами K, Rb, Cs. Для хлорида натрия такие соединения образуют РЗЭ, начиная с самария.
Образование анионных хлоридных комплексов лантаноидов в расплавах констатируется также путем изучения ИК – спектров при температуре 400 – 800 ˚С. при этом хлориды лантаноидов в расплавленной эвтектике LiCl – NaCl – KCl в области 0,8 – 2,6 µ имеют характеристические полосы поглощения, найденные в расплавах, соответствующих нитратным комплексам.
Соединения типа KLnCl4 существуют в расплаве и в парообразном состоянии, что показано тензометрическими исследованиями и подтверждено масс-спектроскопией.
Интересна работа японских ученых A.Matsuoka и др. [8], в которой при помощи Раман-спектроскопии и молекулярно-динамического моделирования были изучены структуры систем GdCl3 – ACl (A – Li, K, Na). В результате найдено, что октаэдрические комплексные анионы GdCl63- не соединены друг с другом в расплавах с концентрацией GdCl3 менее 25 мол.%, за исключением системы GdCl3 – LiCl.
В работе [9] исследованы системы GdCl3 – NaCl GdCl3 – KCl. В первом случае в системе образуется инконгруэнтно плавящееся химическое соединение Na3GdCl6. Перитектическая точка отвечает 30 % GdCl3 и температуре 486˚С. в случае системы GdCl3 – KCl образуется два конгруэнтно и одно инконгруэнтно плавящихся соединения. Соединение KGd3 Cl10 плавится конгруэнтно при 580˚С. Соединение K2Gd Cl5 плавится инконгруентно при 542˚С. Конгруэнтно плавящееся соединение K3GdCl6 характеризуется температурой плавления 825˚С и имеет полиморфное превращение при 380˚С.
Интересно отметтить работу японских ученых Y.Katayama, R.Hagiwara и Y.Ito [31], которые исследовали образование оксихлоридов и оксидов РЗЭ в эвтектическом расплаве LiCl – KCl, содержащем исследуемый РЗЭ (III) и оксид лития. Отмечено, что когда к расплаву, содержащему 1 мол.% трихлорида гадолиния добавили 0,5 мол.% хлорида лития, наблюдалось осаждение лишь GdOCl. Дальнейшее добавление Li2О (~1 мол.%) дает осаждение Gd2O3 и GdOCl.
Похожие работы
... H2O + Cl2 NaOH + CeO2 = Na2CeO3 + H2O а соединения со степенью окисления II (Eu, Sm, Yb) – восстановительные, причем окисляются даже водой: 2SmCl2 + 2H2O = 2SmOHCl2 + H2 Лантаноиды очень реакционноспособны и легко взаимодействуют со многими элементами периодической системы: в кислороде сгорают при 200–400 °С с образованием Э2O3, а в атмосфере азота при 750–1000 °С образуют ...
0 комментариев