Навигация
Исследование электровосстановления фторалюминат-иона на фоне хлоридного расплава KCl-NaCl, влияние добавок
3.1. Исследование электровосстановления фторалюминат-иона на фоне хлоридного расплава KCl-NaCl, влияние добавок
фторид-иона.
Вольтамперные зависимости хлоридного расплава KCl-NaCl, содержащего фторалюминат-ион в концентрационном интервале 0,5.10-4 - 5.10-4 моль/см3 (рис.3.1.) характеризуются следующими особенностями:
1) волна электровосстановления фторалюминат-иона на серебряном электроде находится в области потенциалов 1,25 – 1,55 В относительно платинового электрода сравнения;
2) волны электровосстановления фторалюминат-иона удается обнаружить при довольно высоких концентрациях (1,0.10-4 моль/см3);
3) при стационарных условиях поляризации волны электровосстановления фторалюминат-иона s-образны и растянуты по оси потенциалов;
4) на стационарных вольтамперометрических зависимостях отсутствует диффузионный пик, волна растянута по потенциалу и по форме похожа на стационарные вольтамперометрические зависимости;
5) на циклических вольтамперных зависимостях имеется волна анодного растворения продукта катодного цикла, которая также растянута по оси потенциалов и не имеет диффузионного пика;
6) повышение концентрации фторалюминат-иона на фоне хлоридного расплава приводит к увеличению предельного тока как при стационарных и нестационарных режимах поляризации, но при этом не наблюдается прямолинейная зависимость тока от концентрации.
Анализ стационарных и нестационарных вольтамперометрических зависимостей электровосстановления фторалюминат-иона на фоне хлоридного расплава KCl-NaCl по общеизвестным критериям, приведенным во второй главе, раздел 1., а именно, наклон стационарных вольтамперометрических кривых в полулогарифмических координатах, полуширина пика при нестационарных вольтамперометрических зависимостях, разность потенциалов катодного и анодного пиков, свидетельствуют о замедленности стадии переноса заряда.
Отсутствие прямо пропорциональных зависимостей тока от концентрации при стационарных и нестационарных режимах поляризации, и при этом, не исходящих из начала координат, уменьшение соотношения ip/V1/2 при увеличении скорости поляризации свидетельствует о том, что электродному процессу предшествует химическая реакция образования электрохимически активных частиц (ЭАЧ).
Рис. 3.1. Циклические хроновольтамперограммы расплава NaCl – KCl – Na3AlF6, С(Na3AlF6) = 1,5.10-5 моль/см3 на серебряном электроде при добавлении NaF, моль/см3 .104: 1, 2 – 0; 3 – 1,5; 4 – 3,0; 5 – 7,5; 6 – 15,0; 7 – 30,0. Т=973К. Э.с.- Pt.
Отсутствие диффузионного пика на нестационарных вольтамперометрических зависимостях, растянутость по оси потенциалов как катодных, так и особенно анодных волн, может свидетельствовать как о замедленности стадии переноса заряда, так и о том, что в электродном процессе могут принимать участие различные комплексы алюминия, с близкими потенциалами восстановления. На фоне хлоридных расплавов, содержащих фторалюминат –ион, вследствие большой активности хлорид-ионов возможны частичные замещения фторид-иона хлорид-ионом во фторалюминатных комплексах.
На рис.3.1. приведены циклические хроновольтамперограммы расплава KCl-NaCl, содержащего 1,5·10-4 моль/см3 криолита на серебряном электроде при последовательном добавлении фторида натрия. Циклические вольтамперные зависимости иллюстрируют, что добавление фторид-иона существенно не сказывается на высоту волны. Однако наблюдается влияние фторид-иона как на форму катодной волны восстановления, так и анодной волны окисления.
Отсутствие стандартного электрода сравнения в изучаемой системе не позволило нам четко провести анализ смещения волн в зависимости от концентрации фторид-иона в расплаве.
Судя по потенциалу выделения щелочного металла, можно сделать вывод, что при увеличении концентрации фторид-иона в расплаве, потенциал катодной волны восстановления смещается в отрицательную область.
При увеличении концентрации фторид-иона наблюдается увеличение наклона вольтамперной кривой, хотя более прочный чисто фторидный комплекс AlF63- будет разряжаться труднее (более необратимо). Причина заключается в том, что при больших избытках фторид-иона ион алюминия прочно закомплексован в AlF63- и вольтамперная кривая является волной восстановления одного комплекса AlF63-.
Такой вывод можно сделать также и при рассмотрении анодной ветви циклической хроновольтамперограммы при добавлении фторида натрия. Если в чисто хлоридных расплавах анодная волна растянута по потенциалу и нечетко выражена, то при добавлении фторид-иона на анодных участках пик появляется и смещается в отрицательную область потенциалов.
При более чем 10-кратном избытке фторид-иона по отношению к криолиту, на циклической вольтамперограмме наблюдается четкая волна анодного растворения продуктов катодного цикла.
С увеличением концентрации F--иона разность потенциалов существенно уменьшается. Основываясь на вышеприведенных данных о влиянии на электровосстановление фторалюминат-иона фторид-иона, определенный интерес представляет процесс электровосстановления в хлоридно-фторидных расплавах KCl-NaCl-NaF (10 мас.%). В этот расплав вводится такое количество фторид-иона, который обеспечивал бы полную закомплексованность иона Al3+ фторид-ионами.
Таблица 3.1
Электрохимические параметры электровосстановления Na3AlF6 в расплаве
NaCl - KCl – NaF (10 вес.%) на серебряном электроде. Т = 973 К.
| C(LaCl3), моль/см3 | v, В/с | v1/2 | ip,, мА/см2 |
| -jp, B | -jp/2, B | Dj, B |
| 8,0·10-5 | 0,1 | 0,3162 | 80 | 253,16 | 1,47 | 1,37 | 0,10 |
| 0,2 | 0,4472 | 110 | 246,08 | 1,43 | 1,37 | 0,06 | |
| 0,5 | 0,7071 | 170 | 240,45 | 1,32 | 1,23 | 0,09 | |
| 1,0·10-4 | 0,2 | 0,4472 | 135 | 302,01 | 1,42 | 1,35 | 0,07 |
| 0,5 | 0,7071 | 201 | 284,30 | 1,52 | 1,375 | 0,145 | |
| 3,0·10-4 | 0,1 | 0,3162 | 310 | 918,00 | 1,55 | 1,35 | 0,20 |
| 0,2 | 0,4472 | 420 | 939,59 | 1,58 | 1,41 | 0,17 | |
| 0,5 | 0,7071 | 850 | 1202,26 | 1,67 | 1,42 | 0,25 | |
| 0,5 | 0,7071 | 820 | 1159,83 | 1,67 | 1,46 | 0,21 | |
| 3,0·10-4 | 0,1 | 0,3162 | 492,30 | 1557,91 | 1,66 | 1,46 | 0,20 |
| 0,1 | 0,3162 | 507,69 | 1606,62 | 1,66 | 1,46 | 0,20 | |
| 0,2 | 0,4472 | 646,15 | 1445,53 | 1,70 | 1,49 | 0,21 | |
| 0,5 | 0,7071 | 484,00 | 684,58 | 1,77 | 1,50 | 0,27 |
На основании анализа результатов вольтамперных измерений (табл.3.1.), электродную реакцию восстановления фторалюминат-иона в хлоридных расплавах можно представить в виде:
AlF63- + xCl-![]() [AlF6-xClx]3-
[AlF6-xClx]3-
[AlF6-xClx]3- + 3e → Al + (6-x)F- + xCl-
При добавлении фторид-иона происходит химическая реакция:
AlF6-xClx + xF ![]() AlF63- + xCl-
AlF63- + xCl-
AlF63- + 3e → Al + 6F-
Таким образом, анионный состав расплава влияет на электродный процесс восстановления алюминия в галогенидных расплавах.
Похожие работы
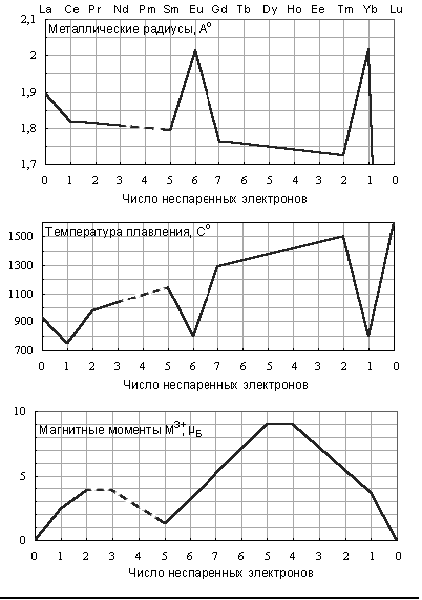
... H2O + Cl2 NaOH + CeO2 = Na2CeO3 + H2O а соединения со степенью окисления II (Eu, Sm, Yb) – восстановительные, причем окисляются даже водой: 2SmCl2 + 2H2O = 2SmOHCl2 + H2 Лантаноиды очень реакционноспособны и легко взаимодействуют со многими элементами периодической системы: в кислороде сгорают при 200–400 °С с образованием Э2O3, а в атмосфере азота при 750–1000 °С образуют ...
0 комментариев