Навигация
2. РАСПРОСТРАНЕНИЕ В ПРИРОДЕ.
Галлий состоит из двух стабильных изотопов с массовыми числами 69 (60,5%) и 71 (39,5%). Хотя среднее содержание галлия в земной коре относительно высокое, 0,0015% по массе, что равно содержанию свинца и молибдена, и в десятки раз больше, чем, например, тантала или вольфрама, в сотни раз больше, чем ртути или серебра. Галлий - типичный рассеянный элемент. В природе он встречается в исключительно малых количествах (0,002% и меньше), обычно это - бокситы, нефелины, сфалериты, каменные угли, некоторые железные руды. Основная часть галлия заключена в минералах с алюминием, меньше - с железом, цинком, медью и другими металлами. Дело в том, что галлий практически не имеет как собственных месторождений, так и "персональных" минералов.
Лишь сравнительно недавно в юго-восточной части Африки был обнаружен первый галлиевый минерал, который и получил название галлит
- CuGaS2. В нем содержится почти 37% галлия. До этого самым богатым галлием минералом - был германит из Тсумба в Юго-Восточной Африке. В нём содержится 0,6 - 0,7% галлия. Как выяснилось, сравнительно богата галлием зола каменных углей. Английские ученые подсчитали, что каждая тонна угля, добытого на Британских островах, содержит в среднем 5 граммов галлия.
3. ПОЛУЧЕНИЕ.
Даже такая, казалось бы, ничтожная концентрация этого элемента, как в золе каменных углей, считается вполне достаточной для его промышленного извлечения. (Все в мире относительно: железную руду, на тонну которой приходится 300 - 400 килограммов железа, принято называть бедной.) Зато и масштабы производства галлия, прямо скажем, невелики. Первые 50 килограммов этого металла получили в Германии в 1932 году. Спустя примерно четверть века производство галлия возросло лишь до 350 килограммов. И хотя сегодня счет идет на тонны, даже такой редчайший металл, как рений, которого в земной коре содержится в десятки тысяч раз меньше, чем галлия, по объему производства оставил его далеко позади.
Главным источником получения галлия служат... отходы алюминиевого производства. Хоть на сырье и не приходится тратиться, сам процесс извлечения галлия настолько сложен (чего стоит, например, хотя бы отделение его от алюминия!), что он оказывается одним из самых дорогих металлов на мировом рынке. В середине 50-х годов 1 килограмм галлия стоил 3000 долларов - почти в три раза дороже золота! Подумать только: небольшой слиточек металла, вполне умещающийся на ладони, - и такая солидная сумма!..
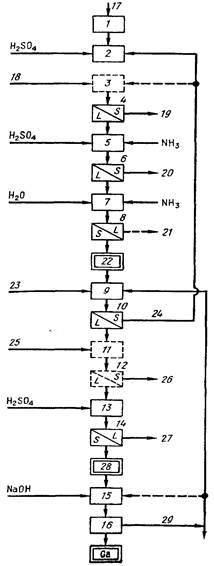
Методы выделения и получения галлия были разработаны самим первооткрывателем и его учеником Юнгфлейшем. Для получения в лабораторных условиях лучше всего сначала осадить галлий в виде цианоферрата(II). Последний при сильном нагревании превращается в смесь Ga2O3 и Fe2O3. Смесь окислов сплавлением с бисульфатом калия переводят в растворимое состояние. Затем из солянокислого раствора действием большого количества едкого кали высаживают железо (окись галлия растворима в щелочи). После этого галлий можно выделить из щелочного раствора электролитически. Кейл (Keil, 1926) рекомендует сплавлять цианоферрат(II) с твёрдым едким кали в серебряном тигле, затем растворять плав в воде (при этом железо выделится в виде гидроокиси) и из фильтрата после подкисления соляной кислотой аммиаком осадить галлий в виде гидроокиси. Гидроокись при прокаливании переходит в окись, из которой можно получить металл, сильно нагревая вещество в токе водорода. Ричардс (Richards,.1923) описал метод, по которому свинец, полученный при рафинировании цинка дистилляцией (выделенного из руд, содержащих галлий), перерабатывается на галлий.
<- 5 ->
Из германита галлий можно просто и количественно получить по методике Берга и Кейла (Berg, Keil, 1932), которая основана на лёгкой растворимости GaCl, в эфире. В Леопольдсхолле много лет назад стали получать галлий в заводских условиях при переплавке мансфельдского медного сланца. Содержащие галлий остатки, в которых имеются также тяжёлые металлы и алюминий,преимущественно в виде сульфатов, фосфатов и молибдатов (Feit, 1933) - прежде всего обрабатывают NaOH. Затем отфильтровывают выпадающие гидроокиси тяжелых металлов, а раствор нейтрализуют. Выпадающий при этом осадок, помимо галлия, содержит еще цинк и алюминий в виде фосфатов и сульфатов. Осадок вновь растворяют в серной кислоте и раствор разбавляют водой. При этом в результате фракционного осаждения сероводородом из сернокислого раствора последний обогащается галлием вследствие отделения остатков молибдена и цинка.
Затем раствор смешивают с твердым едким натром, причем фосфорная кислота отделяется в виде тринатрийфосфата, почти нерастворимого в щёлочи. Оставшийся раствор подвергают электролизу. При тщательной работе получается почти чистый галлий.
В промышленности галлий получают так. При переработке бокситов галлий по способу Байера концентрируется в оборотных маточных растворах после выделения Al(OH)3. Из таких растворов галлий выделяют электролизом на ртутном катоде. Из щелочного раствора, полученного после обработки амальгамы водой, осаждают Ga(OH)3, которую растворяют в щёлочи и выделяют галлий электролизом.
При содово-известковом способе переработки бокситовой или нефелиновой руды галлий концетрируется в последних фракциях осадков, выделяемых в процессе карбонизации. Для дополнительного обогащения осадок гидроокисей обрабатывают известковым молоком. При этом большая часть Al остаётся в осадке, а галлий переходит в раствор, из которого пропусканием CO2 выделяют галлиевый концентрат (6-8% Ga2O3); последний растворяют в щелочи и выделяют галлий электролитически.
Источником галлия также может служить остаточный анодный сплав процесса рафинирования Al по методу трёхслойного электролиза. В производстве цинка источниками галлия являются возгоны (вельцокислы), образующиеся при переработке хвостов выщелачивания цинковых огарков.
Полученный электролизом щелочного раствора жидкий галлий, промытый водой и кислотами (HCl, HNO3), содержит 99,9-99,95% Ga.
Более чистый металл получают плавкой в вакууме, зонной плавкой или вытягиванием монокристалла из расплава.
Похожие работы
... . В природе встречается в основном в виде: 1) алюмосиликатов; 2) бокситов; 3) корунды; 4) глинозёма. Природные соединения алюминия:а – боксит; б – корунд; в – рубин; г – сапфир. Основные области применения алюминия и его сплавов Алюминий используется в производстве зеркал оптических телескопов, в электротехнике, для производства сплавов (дюралюмин, ...
... чистоты его подвергают электролитическому рафинированию в щелочном электролите с жидким галлиевым катодом, а затем вакуумной плавке. Глава 2. ИЗВЛЕЧЕНИЕ ГАЛЛИЯ ИЗ СТОЧНЫХ ВОД ПРОЦЕССА ПОЛУЧЕНИЯ ОКСИДА АЛЮМИНИЯ Галлий, побочный продукт переработки алюминиевых соединений, получается из части так называемого зеленого раствора, образующегося в процессе производства оксида алюминия А1203. Оксид ...
... , связанные с герметизацией слитка GaAs в кварцевой ампуле и неизбежностью его испарения, делают процесс бестигельной зонной плавки мало пригодным для практического использования. Слиток арсенида галлия, полученный по методу бестигельной зонной плавки, после нескольких проходов имеет высокое удельное сопротивление (порядка Мом*см) в начальной и низкое удельное сопротивление в остальной части ...
... почти вдвое тяжелее галлия и в обычных условиях эти металлы не могут равномерно перемешиваться: при застывании слитка верхние его слои оказываются богатыми галлием, а нижние - молибденом. В космосе же царит невесомость, и перед ее законами молибден и галлий равны, поэтому слиток получается равномерным по составу. Вполне вероятно, что именно галлий поможет ученым ответить на вопрос, почему... ...


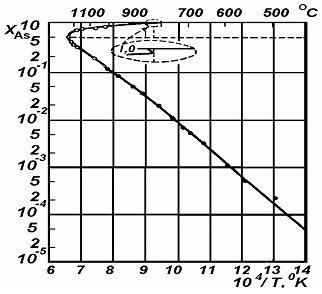
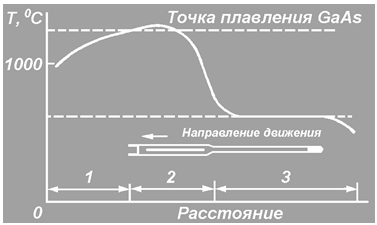
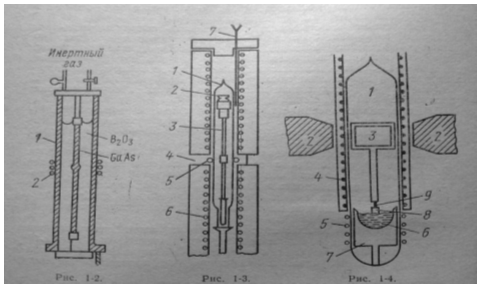
0 комментариев