Навигация
5. СОЕДИНЕНИЯ ГАЛЛИЯ
В своих соединениях галлий, как правило, проявляет положительную трехвалентность. Трёхвалентные соединения галлия, наиболее устойчивы, они во многом близки по свойствам химическим соединениям алюминия. Наиболее характерно координационное число 6, реже 4. Соли его бесцветны, в водном растворе сильно гидролизованы, сильнее даже, чем соли алюминия, на которые они в большинстве случаев похожи по своим свойствам.
Так же как в случае алюминия, из раствора соли галлия под действием веществ, сдвигающих равновесие гидролиза вследствие понижения концентрации ионов водорода, выпадает белый гидрат окиси.
Прибавлением винной кислоты можно предотвратить осаждение вследствие комплексообразования (так же как и для алюминия).
Из соединений двухвалентного галлия известны галогениды GaCl2, GaBr2 и халькогениды GaS, GaSe и GaTe. Окись двухвалентного галлия до сих пор не удалось получить. Это тем удивительнее, что халькогениды двухвалентного галлия относительно устойчивы. GaO был обнаружен на основании изучения полосатых спектров. Теплота его образования из атомов составляет ~58 ккал/моль. Для InO вычисленная теплота образования составляет 25 ккал/моль. TlO, по-видимому, не существует в газообразной форме. Соединения двухвалентного галлия, имеющие солеобразный характер, менее устойчивы. Они легко окисляются или распадаются при реакциях окисления на соединение трехвалентного галлия и металл. Еще менее устойчивы соединения одновалентного галлия. Из соединений одновалентного галлия существуют, по-видимому, окисел Ga2O, сульфид Ga2S и селенид Ga2Se.
Соединения трехвалентного и одновалентного галлия диамагнитны. Интересно, что это справедливо и для приведенных выше со-
единений двухвалентного галлия, по крайней мере в твердом состоянии.
Их диамагнетизм обусловлен тем, что в кристаллической решетке соединений двухвалентного галлия размещены не ионы Ga 2+, а ионы (Ga4+)2. Ионы Ga 2+ здесь связаны попарно гомеополярной связью, благодаря чему происходит насыщение спинов неспаренных электронов.
Образование иона Ga 2+ полностью соответствует образованию ионов |
Ga 2+
Hg+ для ртути. Следует отметить существование гидрида галлия,
|
Hg+ летучего при обычной температуре.
5.1. СОЕДИНЕНИЯ С КИСЛОРОДОМ
ОКИСЛЫ. Высший окисел Ga2O3 белого цвета, получается окислением металла или нагреванием гидроокиси, сульфата, нитрата, оксалата и других подобных соединений галлия. Подобно окиси алюминия Ga2O3 образует несколько полиморфных модификаций. а-Модификация со структурой типа корунда возникает при разложении нитрата или гидроокиси галлия при температурах 400 - 450 . Она отличается
<- 9 ->
большой плотностью - 6,48 г/см3. Быстрым нагреванием гидроокиси до
400 - 500, а также гидротермальным синтезом можно получить g-Ga2O3 с кубической структурой типа шпинели. Разложением нитрата при 200 - 230 С получают d-модификацию, имеющую малую плотность (5 г/см3) и структуру, аналогичную структуре окиси индия. Все эти модификации метастабильны и при длительном нагревании выше 1000 С переходят в устойчивую моноклинную b-модификацию со структурой типа O-Al2O3, с плотностью 5,95 г/см3. Эта модификация может быть получена также гидротермальным путем при 300 С и выше . В ее структуре имеются атомы галлия, находящиеся как в тетраэдрическом, так и октаэдрическом окружении атомов кислорода.
Температура плавления окиси галлия 1725 C, теплота образования 260 ккал/моль. При высоких температурах окись галлия незначительно диссоциирует с выделением летучего низшего окисла Ga2O. Сама окись галлия нелетуча.
Полученная при невысоких температурах окись галлия растворима как в кислотах с образованием солей галлия, так и в щелочах с образованием галлатов. Для перевода прокаленной окиси галлия в растворимую форму приходится сплавлять ее со щелочью или бисульфатом калия.
При спекании с основными окислами или карбонатами получены различные галлаты, с кремнеземом стекла . Окись галлия способна образовывать с окисью алюминия широкие области твердых растворов при высоких температурах. Ниже 810 C при взаимодействии этих окислов получено соединение AlGaO3, дающее твердые растворы со своими компонентами.
Низший окисел галлия Ga2O можно получать нагреванием металла в разреженной атмосфере углекислого газа или водяного пара, а также восстановлением окиси галлия (лучше всего металлическим галлием).
Это темно-коричневое (до черного цвета) вещество с плотностью 4,77 г/см3, устойчивое на воздухе при комнатной температуре и легко окисляющееся при нагревании, обладает сравнительно большой летучестью и может быть сублимировано в вакууме выше 500 C. При температуре выше 700 диспропорционирует:
3Ga2O <--> 4Ga + Ga2O3
В парах при температуре выше 1000 С это соединение устойчиво. Закись галлия является сильным восстановителем. Например, растворяясь в серной кислоте, она восстанавливает ее до сероводорода.
Что касается двухвалентного галлия GaO, то о нем в литературе имеются весьма скудные и во многом противоречивые сведения. В последнее время его существование в конденсированном состоянии вообще подвергается сомнению.
ГИДРООКИСЬ. Только высший окисел галлия образует гидрат Ga(OH)3. Гидроокись может быть выделена в виде белого студенистого осадка при осторожной нейтрализации как растворов солей галлия каким-либо основанием, так и растворов галлатов щелочных металлов кислотой. Из растворов солей галлия гидроокись начинает осаждаться при pH около 3; полное осаждение достигается при рН 4,1. Из растворов галлатов осаждение гидроокиси начинается при рН около 9,7 и заканчивается при рН 6,4.
Из растворов сульфата сначала осаждается нерастворимая основная соль, наиболее вероятный состав которой Ga3(ОН)7SO4*nH2O. Прибавление щелочи к растворам хлорида галлия вызывает сначала образование растворимых основных солей, выпадение осадка начинается лишь при содержании щелочи более 2 г-экв/моль хлорида. Выпавшая основная соль Ga5(OH)4Cl затем переходит в гидроокись. Произведение растворимости галлия 1,4*10-34.
Гидроокись галлия аморфна. Свежевыпавшие осадки представляют собой сложные аквагидроксокомплексы с большим числом молекул воды.
<- 10 ->
Старение осадка как под водой, так и при высушивании на воздухе приводит к образованию разных гидратов. Гидроокись Ga(OH)3 может быть получена при 20 C. Высушивание при 80 дает Ga2O3*2H2O, при 160
- 3Ga2O3*4H2O. Нагреванием до 400 получают кристаллический гидрат GaOOH со структурой одного из гидратов окиси алюминия - диаспора (этот гидрат правильнее рассматривать как метагалловую кислоту HGaO2). Он может быть выделен также нагреванием гидроокиси галлия в автоклаве при 150 - 160 C. Полное обезвоживание гидроокиси галлия происходит при 550 C.
Гидроокись галлия амфотерна: растворяется как в кислотах, так и в щелочах. Кислотные свойства гидроокиси галлия выражены сильнее, чем основные. Первая константа диссоциации ее как кислоты - 1,2*10-7, как основания - 3,4*10-8. Это более сильная кислота, чем
гидроокись алюминия. Поэтому растворы галлатов устойчивее растворов
соответствующих алюминатов, что может быть использовано при их разделении.
Интересно отметить, что свежеосажденная гидроокись галлия растворима в аммиаке; в этих растворах галлий, по-видимому, не образует аммиачных комплексов и находится в форме аниона.
ПЕРЕКИСНЫЕ СОЕДИНЕНИЯ. При взаимодействии хлорида галлия со щелочью в концентрированной перекиси водорода при -20 C выпадает белый осадок перекисного соединения Ga(OH)3*2Н2O2*nН2O. При нагревании до 2 - 4 C оно постепенно разлагается с образованием Ga(OH)3*Н2O2, а затем 2Ga(OH)3*Н2O2. Последнее соединение устойчиво вплоть до 60 C.
Похожие работы
... . В природе встречается в основном в виде: 1) алюмосиликатов; 2) бокситов; 3) корунды; 4) глинозёма. Природные соединения алюминия:а – боксит; б – корунд; в – рубин; г – сапфир. Основные области применения алюминия и его сплавов Алюминий используется в производстве зеркал оптических телескопов, в электротехнике, для производства сплавов (дюралюмин, ...
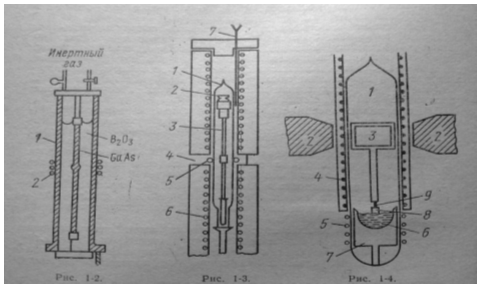
... чистоты его подвергают электролитическому рафинированию в щелочном электролите с жидким галлиевым катодом, а затем вакуумной плавке. Глава 2. ИЗВЛЕЧЕНИЕ ГАЛЛИЯ ИЗ СТОЧНЫХ ВОД ПРОЦЕССА ПОЛУЧЕНИЯ ОКСИДА АЛЮМИНИЯ Галлий, побочный продукт переработки алюминиевых соединений, получается из части так называемого зеленого раствора, образующегося в процессе производства оксида алюминия А1203. Оксид ...
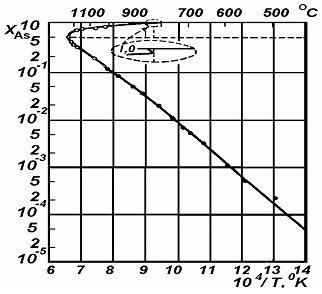
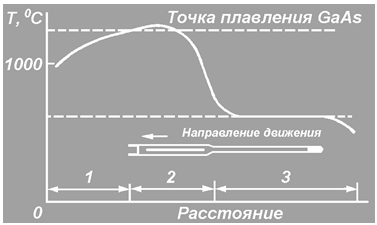
... , связанные с герметизацией слитка GaAs в кварцевой ампуле и неизбежностью его испарения, делают процесс бестигельной зонной плавки мало пригодным для практического использования. Слиток арсенида галлия, полученный по методу бестигельной зонной плавки, после нескольких проходов имеет высокое удельное сопротивление (порядка Мом*см) в начальной и низкое удельное сопротивление в остальной части ...
... почти вдвое тяжелее галлия и в обычных условиях эти металлы не могут равномерно перемешиваться: при застывании слитка верхние его слои оказываются богатыми галлием, а нижние - молибденом. В космосе же царит невесомость, и перед ее законами молибден и галлий равны, поэтому слиток получается равномерным по составу. Вполне вероятно, что именно галлий поможет ученым ответить на вопрос, почему... ...


0 комментариев