Навигация
2.3 Визначення індію
Індій кількісно осаджується оксихіноліном з оцтовокислого розчину, що містить ацетат, і з слабкомінерального розчину, при рН 2,5 – 3. Реакція дуже чуттєва. Висушений до постійної ваги оксихінолінат індію має наступну формулу – In(C9H9NO)3. Оксихінолін не осаджує індій при рН вище, ніж 5,3 і з розчинів з високою концентрацією індію, внаслідок утворення розчинних комплексів. Жовтувато – зелений осад оксихінолінату помітно розчинний у оцтовій кислоті. З сильнокислого або сильнолужного середовища індій не осаджується. Оксихінолінат індію кількісно екстрагується хлороформом та іншими органічними розчинниками, що не змішуються з водою.
2.3.1 Гравіметричне визначення індію
Для осадження індію застосовують 5%-овий спиртовий розчин оксихіноліну, або 3%-овий розчин оксихіноліну в оцтовій кислоті. До розчину що містить індію додають 0,5г оцтовокислого натрію і 0,5 мл льодяної оцтової кислоти, розчин розводять до 50 мл водою і нагрівають до 70 – 800С. Осаджують індій додаючи оксихінолін по краплях, постійно перемішуючи розчин. Суміш охолоджують, часом перемішують, залищають на 2 – 3 години. Після відстоювання рідину зливають. Осад промивають гарячою і холодною водою, до зникнення жовтого забарвлення промивних вод. Осад висушують при температурі 1200С на протязі 1 - 1,5 години до постійної маси. Гравіметричний фактор (F) перерахунку на In – 0,2099, у перерахунку на In2O3 – 0,2538.
2.3.2 Броматометричне визначення індію
Оксихінолінат індію можна титрувати броматометричним методом. Оксихінолін реагує як фенол і зв’язує два атоми брому з утворенням 5,7 дибромоксихіноліну. Бром утворюється при взаємодії бромату і броміду калію у солянокислому розчині, точку еквівалентності встановлюють індикатором, що руйнується під дією надлишку брому. 1 мл 0,1 н. розчину бромату калію еквівалентний 0,9575 г індію.
Осад оксихінолінату розчиняють у 10%-овій соляній кислоті, далі додають 1 – 2 г твердого броміду калію і титрують броматом калію у присутності метилового оранжевого, або метилового красного.
Точність методу приблизна дорівнює точності гравіметричного методу.
2.3.3 Фотометричне визначення індію
Іон індію повністю екстрагується з водного розчину з рН 3,2 – 4,5 розчином оксихіноліну у хлороформі з утворенням жовтого забарвлення. Якщо загальна концентрація оксихіноліну і індію дорівнює відповідно 0,1 і 0,01 М а відношення об’ємів водної фази і СНСl3 відповідно дорівнює 1:1, то індій починає екстрагуватися при рН дещо вище 1, а кількісно екстрагуватися при рН >3. [6]
2.4 Визначення урану
З основних та слабо-кислих розчинів оксихінолін осаджує уран у вигляді у вигляді червонувато – оранжевої сполуки. При відсутності надлишку реагенту осад має склад UO2(C9H6NO)2. При осадженні надлишком реагенту, осад має склад UO2(C9H6NO)2(C9H6NO). При нагріванні до 150-2000Сйого склад не змінюється. Кількісне осадження урану має місце при рН від 4,1 до 13,5. Якщо осадження проводити при рН 10 – 12, то осадженню урану не заважають фосфати, тартрати, фториди, оксалати, гідроксиламін. Однак, при осадженні з рН > 11, осад захопляю з розчину натрій (якщо лужне середовище – гідроксид натрію).
2.4.1 Гравіметричне визначення урану
Аналізований розчин об’ємом близько 100мл, що містить до 100мг урану у вигляді сульфату, нітрату або хлориду уранілу, нейтралізують розчином аміаку, додають 1 – 2 г ацетату амонію, підкислюють приблизно 5мл оцтової кислоти, нагрівають до кипіння і по краплях додають 3%-овий розчин оксихіноліну у 3%-овій оцтовій кислоті. Після осадження осад фільтрують, промивають холодною водою і сушать при температурі 105 – 1400С. Осад зважують. Гравіметричний фактор (F) дорівнює 0,3385. Визначенню урану за цим методом не заважають лужні та лужноземельні метали.
2.4.2 Колориметричне визначення урану
Оксихінолін з ураном здатен утворювати у нейтральному, або слабо – лужному розчині забарвлену сполуку складу UO2(C9H6NO)2С9Н6NОН, що добре екстрагується хлороформом. Оксихінолін утворює з торієм дві клішневидні сполуки, що містять 4 або 5М оксихіноліну на один атом торію. При взаємодії торію з оксихіноліном у слабо - оцтовому розчині, у присутності ацетату амонію в залежності від температури утворюються дві забарвлені форми: при 500С – жовта форма – Th(C9H6ON)4. А при температурі 700С і вище оранжева форма – Th(C9H6ON)4C9H7ON. Також важливим є те, що оксихінолят торію не осаджується при рН нижче чим 3,7 і вище ніж 12,5. Сполуки торію з оксихіноліном, аналогічно іншим металам, розчинні у органічних розчинниках, наприклад, хлороформі, бензолі, бутанолі, тетрахлорметані. Найкраще розчинення проходить у хлороформі. Оранжева сполука розчиняється швидше ніж жовта. Жовтий комплекс - сполука, у якій координаційне число торію дорівнює – 8. Також цікаво те, що розчини оксихіноляту торію у ацетоні підпорядковуються закону Бера; для інших розчинників ця залежність не зберігається.
Похожие работы
... сигналу K+; - зміни активності протеїнкіназ A та С у корі надниркових залоз під впливом іонів калію. Об’єкт дослідження. Внутрішньоклітинні сигнальні системи, залучені до перенесення сигналів регуляторів та модуляторів функції кори надниркових залоз. Регуляція синтезу кортикостероїдів в корі надниркових залоз модуляторами адренокортикальної функції: кортикотропіном, естрогенами, дофамі ...
... в разі несприятливих змін кон'юнктури окремих сегментів споживчого ринку. Це визначає невикористання в звичайній практиці роботи торговельних підприємств стратегій ціноутворення, орієнтованих на виживання, збереження ринку збуту. Проведемо аналіз цінової політики ВАТ „Фармак”. Можна зробити що принцип ціноутворення на ВАТ „Фармак” орієнтований на ринок про це свідчить те, що за кількістю зареє ...
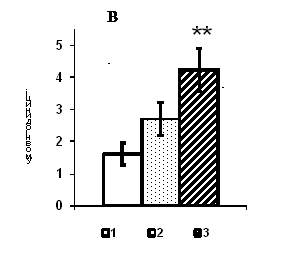
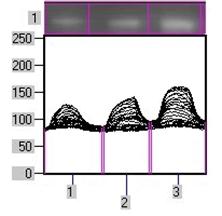
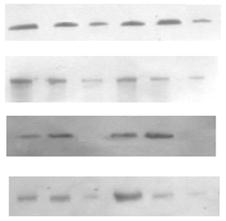
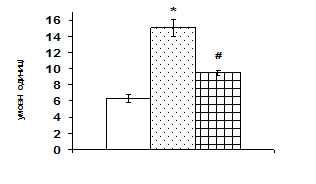
0 комментариев