Навигация
РАСЧЕТ РАСХОДА ПАРА
5.5 РАСЧЕТ РАСХОДА ПАРА
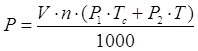
где V – объем раствора – 1,4м(кв.)
n – кол-во ванн данного типаразмера - 6
P1 – удельный расход пара на разогрев до данной температуры – 105кг/м(куб.)ч
Tc – кол-во рабочих суток в году - 253
P2 – удельный расход пара при работе ванны – 13,6кг/м(куб.)ч
T – эффективный часовой фонд времени работы оборудования – 3807 час.
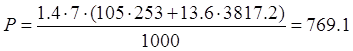 кг.
кг.
Расход для ванн горячей прмывки:
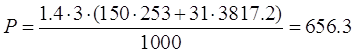 кг.
кг.
Суммарный расход:
∑Р = 769,1+656,3=1425,4 кг.
5.6 РАСХОД ВОДЫ НА ПРОМЫВКУ
![]()
Где q – удельный вынос раствора из ванны поверхностью детали л/м(кв.) –0,2
k – критерий окончательной промывки даталей
Fчас – часовая производительность линии – 5,57м (кв.)/час.
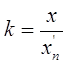
Где х – концентрация основного компонента г/л.
Хn – предельно допустимая концентрация в последней ванне промывки
Если перед промывкой электролит улавливают, то величину удельного выноса раствора уменьшают введением коэффициентов: 0,4 при одной ванне улевливания: 0,15 – при двух ваннах улавливания.
Промывка после ванны обезжиривания. Последовательная двуступенчатая каскадная промывка.
ХNaOH = 40г/л. Хn = 0.1г/л.
![]()
![]()
Промывка после ванны хромирования
CrO3 = 250г/л. Хn = 0.01г/л. Хcr = ![]() =
=![]() г/л.
г/л.
![]()
∑Q = (22.28+6.84)3817.2=111160.8 л/год=111,15м(куб.)/год
Расход воды на составление растворов, восполнение испарения, промывку оборудования принимается в размере 15-20% от расхода на промывные воды
![]()
Общий расход воды составляет:
Qобщ = ![]()
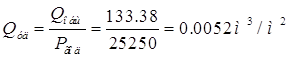
6. ЭНЕРГЕТИЧЕСКИЙ РАСЧЁТ
Электрический расчёт ЭХА сводится к составлению баланса напряжения для данного вида ЭХА. Для электрохимического аппарата, рассматриваемого в данной курсовой работе, баланс напряжения будет иметь вид[4]:
![]() (4.1 )
(4.1 )
где U – напряжение между анодной и катодной штангами, В;
Epa – Epk – равновесные электродные потенциалы анодной и катодной реакции, соответственно, В;
ŋa и ŋk – абсолютные значения перенапряжения анодной и катодной реакции, соответственно, В;
ΔEэл-т – падение напряжения в электролите, В;
ΔЕэл-д – падение напряжения в электродах, В;
ΔЕтокоподвод – падение напряжения в ошиновке ванны, анодных и катодных штангах, анодных крючках, В;
ΔЕконт – падение напряжение в контактах, В.
6.1 РАСЧЁТ РАЗНОСТИ РАВНОВЕСНЫХ ПОТЕНЦИАЛОВ
Электролит электрохимического обезжиривания состава:
NaOH – 40г/л.
іа =ік =5,3 А/дм(кВ.) : t = 18-35 ºC аноды – никелированная сталь.
Катод: ![]()
Анод: ![]()
Суммарная: ![]()
Рассчитаем потенциалы анода и катода по формуле:
![]()
где ΔG – свобдная энергия Гиббса, Дж/моль;
Е – электродвижущая сила системы, В;
n – количество электронов, принимающих участие в реакции;
По справочнику находим величины энергии Гиббса всех участвующих в реакциях веществ:
ΔGH2=0 кДж/моль;
ΔGH+=0 кДж/моль;
ΔGO2=0 кДж/моль;
ΔGH2O=-237,23 кДж/моль.
ΔGОН=-157,35 кДж/моль.
![]() ,
,
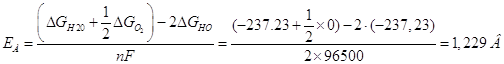
При изменении температуры (от 25 оС до 100 оС) можно пользоваться так называемым температурным коэффициентом стандартного электродного потенциала (напряжения разложения) dE/dT. Он показывает, на сколько вольт меняется потенциал при изменении температуры на один градус:
![]()
Величины температурного коэффициента стандартного электродного потенциала (напряжения разложения) приводятся в литературе или рассчитываются, как:
![]()
где ΔS – энтропия реакции, Дж/(моль·К); Е – электродвижущая сила системы, В; n – количество электронов, принимающих участие в реакции; F – число Фарадея.
Рассчитаем энтропию реакции:
![]()
Из справочных данных[16] находим величины энтропии всех участвующих в реакциях веществ:
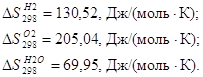
Отсюда:
![]()
![]()
![]()
Если активность потенциалопределяющих компонентов в растворе отличается от 1, то потенциал анодной или катодной реакции можно рассчитать по уравнению Нернста:
![]()
где аox, аred – активность окисленной и восстановленной форм вещества, а=Сγ, γ – коэффициент активности; С – концентрация вещества; ν – стехиометрический коэффициент.
![]()
В большинстве случаев электролит в электрохимических производствах представляет собой смесь разных компонентов с различными концентрациями. При этом, на величину коэффициента активности потенциал-определяющих ионов оказывает влияние концентрация всех компонентов. Выражение для равновесного потенйиала катодной реакции при 30 град. Будет:
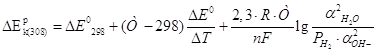
Активность воды определим по закону Рауля:
![]()
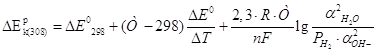
![]()
Запишем вырожение для ![]() :
:
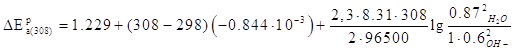
![]()
![]()
![]()
![]()
![]()
Разность потенциалов:
![]()
Похожие работы
... технологиям очистки или даже с помощью неудовлетворительной очистки добиться выполнения жёстких требований к очищенной воде [8, c. 151]. 3.Совершенствование технологий эффективности очистки гальванических стоков на Санкт-петербургском заводе гальванических покрытий 3.1 Направления совершенствования Загрязнение тяжелыми металлами активных илов очистных сооружений связано с тем, что на ...
... завода (бывш.) оснащены устройствами автоматического регулирования температуры, фильтрации электролитов, очистки зеркала раствора. Грузоподъемность автооператора — 4,45 Н. Производительность линий при гальванических покрытиях — до 30 м2/ч, при химическом — до 60 м2/ч. Загрузка и разгрузка производятся с одной стороны линии. Автоматические линии с автооператором консольного типа (АГ-24 и АГ-42) ...
... известной с точностью ; 3) разброс значений толщины покрытия на поверхности эталона не должен превышать номинального значения. 3.1 Расчёт погрешности установки и определение требований к компонентам установки Толщина гальванического покрытия, определяемая кулонометрическим методом, вычисляется по формуле: ,где K=0,73 - электрохимический эквивалент никеля; V=1 ; H=160 мм- высота ...
... интерес главным образом для группового разделения и качественного испытания на хром, а не для количественного его определения, так как многие другие элементы также образуют нерастворимые соединения с этими реагентами. Точные результаты получаются при определении хрома методом, основанным на восстановлении хромата иодистоводородной кислотой и титровании выделяющегося при этом йода раствором ...


0 комментариев