Навигация
ОБРАЗОВАНИЕ РАСТВОРОВ. РАСТВОРИМОСТЬ
3.1 ОБРАЗОВАНИЕ РАСТВОРОВ. РАСТВОРИМОСТЬ
Концентрация компонента в растворе может изменяться от нуля до некоторого максимального значения, называемого растворимостью компонента. Растворимость S – концентрация компонента в насыщенном растворе. Насыщенный раствор – раствор, находящийся в равновесии с растворенным веществом. Величина растворимости характеризует равновесие между двумя фазами, поэтому на неё влияют все факторы, смещающие это равновесие (в соответствии с принципом Ле Шателье – Брауна).
Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо поглощение теплоты. Теория растворов должна объяснять все эти явления. Исторически сложились два подхода к образованию растворов – физическая теория, основы которой были заложены в XIX веке, и химическая, одним из основоположников которой был Д.И. Менделеев. Физическая теория растворов рассматривает процесс растворения как распределение частиц растворенного вещества между частицами растворителя, предполагая отсутствие какого-либо взаимодействия между ними. Единственной движущей силой такого процесса является увеличение энтропии системы ΔS; какие-либо тепловые или объемные эффекты при растворении отсутствуют (ΔН = 0, ΔV = 0; такие растворы принято называть идеальными). Химическая теория рассматривает процесс растворения как образование смеси неустойчивых химических соединений переменного состава, сопровождающееся тепловым эффектом и изменением объема системы (контракцией), что часто приводит к резкому изменению свойств растворенного вещества (так, растворение бесцветного сульфата меди СuSО4 в воде приводит к образованию окрашенного раствора, из которого выделяется не СuSО4, а голубой кристаллогидрат СuSО4·5Н2О). Современная термодинамика растворов основана на синтезе этих двух подходов.
В общем случае при растворении происходит изменение свойств и растворителя, и растворенного вещества, что обусловлено взаимодействием частиц между собой по различным типам взаимодействия: Ван-дер-Ваальсового (во всех случаях), ион-дипольного (в растворах электролитов в полярных растворителях), специфических взаимодействий (образование водородных или донорно-акцепторных связей). Учет всех этих взаимодействий представляет собой очень сложную задачу. Очевидно, что чем больше концентрация раствора, тем интенсивнее взаимодействие частиц, тем сложнее структура раствора. Поэтому количественная теория разработана только для идеальных растворов, к которым можно отнести газовые растворы и растворы неполярных жидкостей, в которых энергия взаимодействия разнородных частиц EA-B близка к энергиям взаимодействия одинаковых частиц EA-A и EB-B. Идеальными можно считать также бесконечно разбавленные растворы, в которых можно пренебречь взаимодействием частиц растворителя и растворенного вещества между собой. Свойства таких растворов зависят только от концентрации растворенного вещества, но не зависят от его природы.
3.1.1 Растворимость газов в газах
Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними. Поэтому газы смешиваются в любых соотношениях (при очень высоких давлениях, когда плотность газов приближается к плотности жидкостей, может наблюдаться ограниченная растворимость). Газовые смеси описываются законом Дальтона:
Общее давление газовой смеси равно сумме парциальных давлений всех входящих в неё газов.
![]() (III.5)
(III.5)
![]() (III.6)
(III.6)
3.1.2 Растворимость газов в жидкостях
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов).
Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0.017 л. азота, 748.8 л. аммиака или 427.8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот. Зависимость растворимости газов от давления выражается законом Генри – Дальтона:
Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
![]() (III.7)
(III.7)
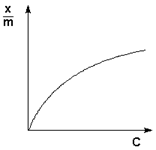
Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются.
Растворимость газов в жидкостях существенно зависит от температуры; количественно данная зависимость определяется уравнением Клапейрона – Клаузиуса (здесь X – мольная доля газа в растворе, λ – тепловой эффект растворения 1 моля газа в его насыщенном растворе):
![]() (III.8)
(III.8)
Как правило, при растворении газа в жидкости выделяется теплота (λ < 0), поэтому с повышением температуры растворимость уменьшается. Растворимость газов в жидкости сильно зависит от концентрации других растворенных веществ. Зависимость растворимости газов от концентрации электролитов в жидкости выражается формулой Сеченова (X и Xo – растворимость газа в чистом растворителе и растворе электролита с концентрацией C):
![]() (III.9)
(III.9)
Похожие работы
... «мицелла» и «мицеллярный раствор». Эти термины были использованы им для обозначения систем, образованных нестехиометрическими соединениями в водной среде. Основная заслуга в становлении коллоидной химии как науки принадлежит Т. Грэму. Как уже отмечалось выше, именно этому ученому принадлежит идея введения термина «коллоид», производного от греческого слова «kolla», обозначающего «клей». Занимаясь ...
... Расстояние, пройденное веществом по сорбенту, прямо пропорционально растворимости данного вещества в пропускаемом растворителе. Даёт возможность полностью разделять вещества, входящие в состав разделяемой смеси. Коллоидная химия Дисперсные системы – это системы, состоящие из множества частиц одной фазы (дисперсной), распределённых в объёме другой фазы – дисперсионной. Дисперсионная среда ...
... и многое другое, без чего немыслима сама жизнь. Все человеческое тело – это мир частиц, находящихся в постоянном движении строго по определенным правилам, подчиняющимся физиологии человека. Коллоидные системы организмов обладают рядом биологических свойств, характеризующих то или иное коллоидное состояние: 2.2 Коллоидная система клеток. С точки зрения коллоидно-химической физиологии ...
... металлов с белками, нуклеиновыми кислотами, липидами. Её практическое применение связано с синтезом фарамакологических препаратов, действие которых обусловленно комплексными ионами металлов. Биоорганическая Химия Изучает связь между строениями органических веществ и их биологическими функциями, использующих в основном методы органической и физической химии, а также физики и математики. ...
0 комментариев