Навигация
Методы получения лиофобных коллоидов
4.2.1 Методы получения лиофобных коллоидов
Коллоидные системы по степени дисперсности занимают промежуточное положение между истинными растворами (молекулярно- или ионно-дисперсными системами) и грубодисперсными системами. Поэтому коллоидные растворы могут быть получены либо путем ассоциации (конденсации) молекул и ионов истинных растворов, либо дальнейшим раздроблением частиц дисперсной фазы грубодисперсных систем.
Методы получения коллоидных растворов также можно разделить на две группы: методы конденсации и диспергирования (в отдельную группу выделяется метод пептизации, который будет рассмотрен позднее). Еще одним необходимым для получения золей условием, помимо доведения размеров частиц до коллоидных, является наличие в системе стабилизаторов – веществ, препятствующих процессу самопроизвольного укрупнения коллоидных частиц.
Дисперсионные методы
Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Процесс диспергирования осуществляется различными методами: механическим размалыванием вещества в т.н. коллоидных мельницах, электродуговым распылением металлов, дроблением вещества при помощи ультразвука.
Методы конденсации
Вещество, находящееся в молекулярно-дисперсном состоянии, можно перевести в коллоидное состояние при замене одного растворителя другим – т.н. методом замены растворителя. В качестве примера можно привести получение золя канифоли, которая не растворяется в воде, но хорошо растворима в этаноле. При постепенном добавлении спиртового раствора канифоли к воде происходит резкое понижение растворимости канифоли, в результате чего образуется коллоидный раствор канифоли в воде. Аналогичным образом может быть получен гидрозоль серы.
Коллоидные растворы можно получать также и методом химической конденсации, основанном на проведении химических реакций, сопровождающихся образованием нерастворимых или малорастворимых веществ. Для этой цели используются различные типы реакций – разложения, гидролиза, окислительно-восстановительные и т.д. Так, красный золь золота получают восстановлением натриевой соли золотой кислоты формальдегидом:
NaAuO2 + HCOH + Na2CO3 ––> Au + HCOONa + H2O
Строение мицеллы данного золя можно представить следующей схемой (см. разд. 4.2.2):
{[Au]m· n AuO2–· (n-x) Na+}x– · xNa+
Аналогичным образом получают золь серебра из разбавленных растворов нитрата серебра. Золь серы может быть получен окислением сероводорода кислородом в водном растворе, действием на сероводород сернистого газа либо разложением тиосерной кислоты:
H2S + O2 ––> S + H2O
H2S + SO2 ––> S + H2O
H2S2O3 ––> H2O + SO2 + S
Строение золя серы можно представить схемой:
{[S]m · n HS– · (n-x) H+}x– · x H+
Золи могут быть получены также в результате реакций ионного обмена, в результате которых выделяется нерастворимая соль, образующая при определенных условиях коллоидный раствор; так получают, например, золь иодида серебра (см. ниже).
Процесс гидролиза различных солей может приводить к образованию коллоидных растворов нерастворимых гидроксидов или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение:
{[Fe(OH)3]m n FeO+ · (n–x)Cl–}x+ x Cl–
4.2.2 Агрегативная устойчивость лиофобных коллоидов.
Строение коллоидной мицеллы
Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения степени дисперсности дисперсной фазы (т.е. объединение частиц в более крупные агрегаты) – коагуляцию золей. Тем не менее золям присуща способность сохранять степень дисперсности – агрегативная устойчивость, которая обусловлена, во-первых, снижением поверхностной энергии системы благодаря наличию на поверхности частиц дисперсной фазы двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания частиц дисперсной фазы, имеющих одноименный электрический заряд.
Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO3 + KI ––> AgI + KNO3
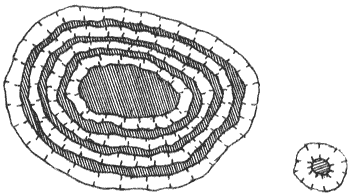
Коллоидная мицелла золя иодида серебра (см. рис. 4.9) образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов Ag+ или иодид-ионов. Если реакция проводится в избытке иодида калия, то кристалл будет адсорбировать иодид-ионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag+. В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы. Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I–, противоионы – ионы К+) может быть изображена следующим образом:
{[AgI]m · nI– · (n-x)K+}x– · x K+
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд:
{[AgI]m · nAg+ · (n-x)NO3–}x+ · x NO3–
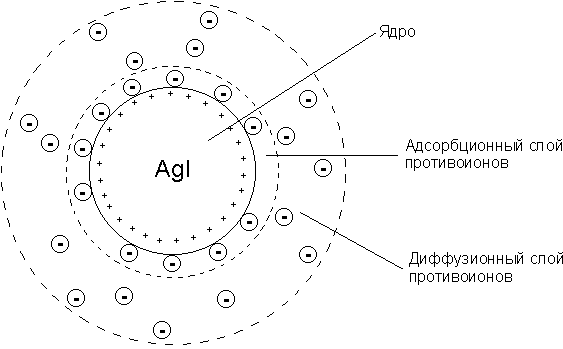
Рис. 4.9. Строение коллоидной мицеллы
Агрегативная устойчивость золей обусловлена, таким образом, рядом факторов: во-первых, снижением поверхностной энергии дисперсной фазы (т.е. уменьшения движущей силы коагуляции) в результате образования двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания имеющих одноименный заряд коллоидных частиц и противоионов. Еще одна причина устойчивости коллоидов связана с процессом гидратации (сольватации) ионов. Противоионы диффузного слоя сольватированы; эта оболочка из сольватированных противоионов также препятствует слипанию частиц.
Похожие работы
... «мицелла» и «мицеллярный раствор». Эти термины были использованы им для обозначения систем, образованных нестехиометрическими соединениями в водной среде. Основная заслуга в становлении коллоидной химии как науки принадлежит Т. Грэму. Как уже отмечалось выше, именно этому ученому принадлежит идея введения термина «коллоид», производного от греческого слова «kolla», обозначающего «клей». Занимаясь ...
... Расстояние, пройденное веществом по сорбенту, прямо пропорционально растворимости данного вещества в пропускаемом растворителе. Даёт возможность полностью разделять вещества, входящие в состав разделяемой смеси. Коллоидная химия Дисперсные системы – это системы, состоящие из множества частиц одной фазы (дисперсной), распределённых в объёме другой фазы – дисперсионной. Дисперсионная среда ...
... и многое другое, без чего немыслима сама жизнь. Все человеческое тело – это мир частиц, находящихся в постоянном движении строго по определенным правилам, подчиняющимся физиологии человека. Коллоидные системы организмов обладают рядом биологических свойств, характеризующих то или иное коллоидное состояние: 2.2 Коллоидная система клеток. С точки зрения коллоидно-химической физиологии ...
... металлов с белками, нуклеиновыми кислотами, липидами. Её практическое применение связано с синтезом фарамакологических препаратов, действие которых обусловленно комплексными ионами металлов. Биоорганическая Химия Изучает связь между строениями органических веществ и их биологическими функциями, использующих в основном методы органической и физической химии, а также физики и математики. ...
0 комментариев