Навигация
Понятие активности растворенного вещества
3.2.6 Понятие активности растворенного вещества
Если концентрация растворенного вещества не превышает 0.1 моль/л, раствор неэлектролита обычно считают разбавленным. В таких растворах взаимодействие между молекулами растворителя существенно преобладает над взаимодействием между молекулами растворителя и растворенного вещества, поэтому последним обычно можно пренебречь. В случае более концентрированных растворов такое приближение неправомерно и для формального учета взаимодействия частиц растворителя и растворенного вещества, а также частиц растворенного вещества между собой, вводится эмпирическая величина, заменяющая концентрацию – активность (эффективная концентрация) а, связанная с концентрацией через коэффициент активности f, который является мерой отклонения свойств реального раствора от идеального:
![]() (III.17)
(III.17)
Как правило, коэффициент активности меньше единицы (при малых концентрациях считают f = 1 и а = С). Необходимо отметить, что активность компонента не прямо пропорциональна его концентрации – коэффициент активности уменьшается с увеличением концентрации.
3.3 РАСТВОРЫ ЭЛЕКТРОЛИТОВ
3.3.1 Теория электролитической диссоциации
Законы Рауля и принцип Вант-Гоффа не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток – растворов электролитов. Обобщая экспериментальные данные, Я.Г. Вант-Гофф пришел к выводу, что растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания, осмотическое давление для них всегда больше, чем вычисленные. Для учета этих отклонений Вант-Гофф внес в уравнение (III.16) для растворов электролитов поправку – изотонический коэффициент i:
![]() (III.18)
(III.18)
Аналогичная поправка вносится в законы Рауля, и изотонический коэффициент определяется следующим образом:
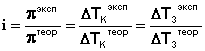 (III.19)
(III.19)
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Для объяснения особенностей свойств растворов электролитов С. Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах:
1. Электролиты в растворах распадаются на ионы – диссоциируют;
2. Диссоциация является обратимым равновесным процессом;
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации α, которая равна отношению числа молекул n, распавшихся на ионы, к общему числу молекул N:
![]() (III.20)
(III.20)
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0.7), средней силы (0.3 < α < 0.7) и слабые (α ≤ 0.3). К сильным электролитам относятся почти все соли (кроме Рb(СН3СОО)2, НgСl2, СdСl2), большинство неорганических кислот и щелочей; к слабым – все органические кислоты, вода, NН4ОН, Н2S и т.д. Электролитами средней силы являются некоторые неорганические кислоты: НF, НСN, Н3PO4.
3.3.2 Слабые электролиты. Константа диссоциации
Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:
АaВb <––> aАx- + bВy+
константа диссоциации выразится следующим соотношением:
![]() (III.21)
(III.21)
Для бинарного (распадающегося на два иона) электролита выражение (III.21) можно переписать в виде (III.21a):
![]() (III.21a)
(III.21a)
Поскольку концентрация каждого иона для бинарного электролита равна произведению степени диссоциации α на общую концентрацию электролита С, выражение (III.21a) в этом случае можно переписать следующим образом:
![]() (III.22)
(III.22)
Для разбавленных растворов можно считать, что (1 – α) = 1. Тогда получаем:
![]() (III.23)
(III.23) ![]() (III.24)
(III.24)
Т.о., степень диссоциации слабого электролита обратно пропорциональна концентрации и прямо пропорциональна разбавлению раствора; выражение (III.24) называют законом разбавления Оствальда. Степень диссоциации слабого электролита можно связать с изотоническим коэффициентом. Будем считать, что из N молекул электролита продиссоциировало n молекул, образовав νn ионов (ν – число ионов, на которое диссоциирует молекула). Поскольку изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации, получаем:
![]() (III.25)
(III.25)
![]() (III.26)
(III.26)
Соотношение (III.26) дает возможность, экспериментально определив изотонический коэффициент раствора, рассчитать степень диссоциации слабого электролита.
Похожие работы
... «мицелла» и «мицеллярный раствор». Эти термины были использованы им для обозначения систем, образованных нестехиометрическими соединениями в водной среде. Основная заслуга в становлении коллоидной химии как науки принадлежит Т. Грэму. Как уже отмечалось выше, именно этому ученому принадлежит идея введения термина «коллоид», производного от греческого слова «kolla», обозначающего «клей». Занимаясь ...
... Расстояние, пройденное веществом по сорбенту, прямо пропорционально растворимости данного вещества в пропускаемом растворителе. Даёт возможность полностью разделять вещества, входящие в состав разделяемой смеси. Коллоидная химия Дисперсные системы – это системы, состоящие из множества частиц одной фазы (дисперсной), распределённых в объёме другой фазы – дисперсионной. Дисперсионная среда ...
... и многое другое, без чего немыслима сама жизнь. Все человеческое тело – это мир частиц, находящихся в постоянном движении строго по определенным правилам, подчиняющимся физиологии человека. Коллоидные системы организмов обладают рядом биологических свойств, характеризующих то или иное коллоидное состояние: 2.2 Коллоидная система клеток. С точки зрения коллоидно-химической физиологии ...
... металлов с белками, нуклеиновыми кислотами, липидами. Её практическое применение связано с синтезом фарамакологических препаратов, действие которых обусловленно комплексными ионами металлов. Биоорганическая Химия Изучает связь между строениями органических веществ и их биологическими функциями, использующих в основном методы органической и физической химии, а также физики и математики. ...
0 комментариев