Навигация
Химия отрасли
Министерство образования И НАУКИ РФ
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
Иркутский государственный технический университет
ХИМИЯ ОТРАСЛИ
Лабораторный практикум
Издательство
Иркутского государственного технического университета
2007
Рецензент: канд. хим. наук, доцент ИрГТУ Е.А.Привалова
Химия отрасли. Лаб. практикум. Составитель Евстафьев С.Н. – Иркутск: Изд-во ИрГТУ. – 2007 – 65 с.
Приведены методики, применяющиеся при технохимическом контроле качества сырья, полуфабрикатов и готовой продукции пивоваренного, ликероводочного, винодельческого и безалкогольного производств.
Практикум предназначен для студентов специальности 260204 «Технология бродильных производств и виноделие» в рамках освоения дисциплины «Химия отрасли».
Печатается по решению редакционно-издательского совета Иркутского государственного технического университета
Введение
Важнейшим элементом в решении задачи выпуска продукции высокого качества является технохимический контроль производства, заключающийся в проверке исходного сырья и материалов при поступлении на производство, в период хранения и переработки, а также в оценке качества готовой продукции.
Технохимический контроль направлен на улучшение качества продукции, внедрение рациональных технологий, соблюдение норм расхода сырья и материалов, снижение их потерь.
Настоящий практикум является руководством для выполнения лабораторных работ по дисциплине «Химия отрасли», проводимых с целью закрепления теоретических знаний и приобретения практических навыков в проведении необходимых анализов по контролю производства.
Лабораторный практикум по характеру и содержанию работ подразделяется на пять разделов: контроль качества сырья, контроль качества пива, контроль качества водки, контроль качества вина и виноматериалов, контроль качества безалкогольных напитков и минеральных вод. Он охватывает основные разделы дисциплины «Химия отрасли» и включает 14 лабораторных работ.
В начале раздела или перед началом лабораторной работы дается введение, в котором поясняется сущность данного этапа контроля, а также излагаются основные теоретические положения, необходимые для выполнения работы. Приводится цель работы, необходимое оборудование и реактивы, методика проведения работы и контрольные вопросы.
Порядок выполнения лабораторных работ
Студенту необходимо заблаговременно подготовиться к выполнению работы, глубоко изучить соответствующий теоретический материал по лекциям или учебникам, а также по лабораторному практикуму, познакомиться с нормативно-технической документацией по теме.
При этом студент должен усвоить состав и свойства изучаемого объекта, сущность биохимических и физико-химических превращений в ходе технологических процессов его переработки или получения; цель работы, важность определяемых в работе показателей и их влияние на качество перерабатываемого сырья, полуфабрикатов и готовой продукции, методику проведения работы и принципы, положенные в основу определения того или иного показателя, устройство прибора или установки.
Вопросы, возникающие при самостоятельной подготовке к работе, студент должен выяснить у преподавателя, ведущего лабораторный практикум.
В начале занятия преподаватель путем опроса выясняет подготовленность студентов к работе.
Студенты, допущенные к работе, приступают к ее выполнению в соответствии с методикой, изложенной в практикуме.
Работая в лаборатории, студенты обязаны неукоснительно соблюдать правила техники безопасности, правила личной и производственной гигиены. К работе приступают, надев санитарную одежду (халат). На всех рабочих местах должен быть порядок. По окончании лабораторного занятия посуду необходимо немедленно вымыть, приборы отключить, реактивы поставить на соответствующее место.
Все данные, получаемые в ходе работы (показания приборов, расчеты и др.) заносятся в рабочую тетрадь, обрабатываются и заносятся в сводную итоговую таблицу, после анализа которых делаются соответствующие выводы.
На следующем занятии студент сдает преподавателю оформленный отчет (в рабочей тетради) по выполненной работе.
В отчете должны быть указаны цель работы, краткое описание устройства приборов или установки, подробный расчет определяемых величин, анализ полученных данных и соответствующие выводы. Каждую выполненную и оформленную работу студент защищает у преподавателя и получает зачет.
Раздел I. КОНТРОЛЬ КАЧЕСТВА СЫРЬЯ
Лабораторная работа № 1
Определение содержания крахмала в ячмене
Крахмал самая важная составная часть экстракта ячменя, определяющая его производственную и экономическую ценность. Хороший пивоваренный ячмень должен содержать 58–65 % крахмала. Обычно, чем больше в ячмене содержится крахмала, тем выше выход экстракта. Разница между содержанием крахмала в ячмене и его экстрактивностью находится в пределах 10–20 %.
Основным методом, применяемым для определения содержания крахмала, является поляриметрический метод Эверса, суть которого заключается в гидролизе крахмала до сахаров при кипячении в растворе соляной кислоты. Одновременно происходят образование декстринов и частичный переход в раствор оптически активных веществ, таких как пентозаны и белки. После осаждения белков с помощью молибдата аммония раствор сахаров поляризуют. Точность определения крахмала зависит от степени измельчения зерна.
Приборы: сахариметр; водяная баня; широкогорлая колба на 100 см3; пипетки на 1 и 25 см3; весы технические; лабораторная мельница.
Реактивы: 1,124 % –ный раствор соляной кислоты: 24,9 см3 соляной кислоты относительной плотности 1,19 разбавляют дистиллированной водой до 1 дм3; 14,5 %-ный раствор молибдата аммония.
Ход анализа. Навеску 5 г тонко измельченного зерна (помол должен проходить через сито с отверстиями 0,5 мм; на сите может оставаться лишь небольшое количество шелухи) помещают в широкогорлую мерную колбу емкостью 100 см3 с 25 см3 раствора 1,124 %-ной соляной кислоты. Перемешиванием достигают полного смачивания муки, комков допускать нельзя. Доливают еще 25 см3 того же раствора соляной кислоты, смывая им частицы муки со стенок горла колбы. Колбу помещают на кипящую водяную баню, причем первые 3 минуты содержимое колбы размешивают круговым движением. Колба должна быть погружена в баню до самого горлышка.
Через 20 минут нагревания из содержимого колбы берут пробу на анализ содержания крахмала (йодная проба). В случае положительного результата нагревание продолжают в течение 15 минут. После чего, вынув колбу из водяной бани, вливают в нее 35–40 см3 холодной дистиллированной воды и содержимое колбы охлаждают до 20 °С, затем добавляют 2 см3 14,5 %-ного раствора молибденовокислого аммония, колбу доливают до метки водой, энергично взбалтывают и фильтруют через складчатый фильтр в сухую колбу, первые порции фильтрата перефильтровывают.
Поляризацию надо производить немедленно. Отсчет делают не менее 3–х раз, для вычислений берут среднее арифметическое.
Содержание крахмала (С, в % на воздушно-сухое вещество) рассчитывают по формуле:
| V. α. 100 C = –––––––––– , [α]D. l . S |
где: V – объем колбы, взятой для анализа (100 см3);
α – угол вращения, град.;
[α]D – удельное вращение испытуемого вещества (181,5 для ячменя);
l – длина поляризационной трубки (0,94 дм);
S – навеска ячменя, г.
При использовании поляриметра с линейной шкалой формула приобретает следующий вид:
| V. α. 100 C = ––––––––– . 0,3468 , [α]D. l . S |
где: 0,3468 – коэффициент перехода от линейной шкалы поляриметра к круговой.
Содержание крахмала (С1, в % на сухое вещество) рассчитывают по формуле:
| С . 100 С1 = ––––––– , 100 – w |
где: С – содержание крахмала на воздушно-сухое вещество, %;
w – влажность зерна, %.
Контрольные вопросы:
1. Крахмал. Его строение, состав и свойства.
2. Кислотный гидролиз крахмала. Недостатки метода.
3. Крахмалистость ячменя, значения этого показателя для производства солода и пива.
4. Принципы поляриметрического метода определения крахмалистости ячменя.
Лабораторная работа № 2
Определение пленчатости зерна
Пленчатостью называют количество мякинной оболочки, выраженное в процентах от общей массы зерна.
Толщина (количество) мякинной оболочки ячменя, кроме чисто химического влияния на состав полученного сусла и пива, оказывает влияние на рентабельность переработки того или другого сорта ячменя. Чем меньше оболочка, тем больше выхода экстракта можно ожидать от ячменя. Тонкокожие ячмени содержат 6 –7 % мякинной оболочки, толстокожие – 10 % и выше. Кроме того, толстая пленка содержит больше дубильных и горьких веществ, понижающих качество пива.
Мякинная оболочка ячменя прочно приклеена к ядру пектиновыми веществами и, чтобы снять их, нужно сначала растворить эти вещества. Для определения пленчатости пользуются методами Омарова (обработка горячей щелочью) и Люффа (обработка слабым раствором аммиака).
Метод Люфа
Приборы и реактивы: конические колбы на 100–150 см3; водяная баня; стеклянная или фарфоровая чашка; 5 %-ный раствор аммиака.
Ход анализа. Взвешивают на аналитических весах 50 зерен ячменя, переносят их в толстостенную склянку емкостью 100–150 см3, снабженную хорошо притертой стеклянной или плотной резиновой пробкой, приливают 10см3 5%-ного раствора аммиака, завязывают пробку тонкой проволокой или шпагатом и помещают склянку в водяную баню, нагретую до 80 °С, так глубоко, чтобы вода снаружи склянки стояла несколько выше внутреннего уровня. Температуру 80 °С поддерживают 1 час, после чего сливают аммиачный раствор с зерен.
Зерна высыпают в стеклянную или фарфоровую чашку и осторожно сдирают с них оболочку, сначала прилегающую к зародышу спинную часть, а затем брюшную. Оболочку высушивают при 105 °С в течение 3 часов и взвешивают. При пересчете необходимо иметь в виду, что во время обработки аммиаком оболочка теряет в среднем 1/12 часть своего веса.
Расчет пленчатости в % на воздушно–сухое вещество ведут по формуле:
|
|
где: а – масса сухих пленок, г;
m – масса 50 зерен ячменя.
Расчет пленчатости в % на сухое вещество ведут по формуле:
|
|
где: w – влажность ячменя, %.
Контрольные вопросы:
1. Строение зерна ячменя;
2. Оболочка зерна, ее состав;
3. Влияние пленчатости на качество ячменя и пива.
Лабораторная работа № 3
Определение содержания пентозанов в зерне
Пентозаны относятся к высшим углеводам, которые при гидролизе дают пентозы (арабинозу, ксилозу). В ячмене содержание пентозанов колеблется от 7 до 12 %. Значение пентозанов в технологии пивоварения очень большое – из этого резерва черпаются вещества для повышения выходов экстракта.
Определение основано на образовании фурфурола при действии соляной кислоты на пентозаны (метод Толленса).
Оборудование: установка для атмосферной перегонки; двугорловая круглодонная колба на 300–500 см3; цилиндр, мерная коническая колба на 500 см3, делительная воронка.
Реактивы: 12 %-ный раствор соляной кислоты, смесь анилина и уксусной кислоты (3 : 2), флороглюцин, дистиллированная вода.
Ход анализа: Собирают установку для атмосферной перегонки. В качестве перегонной колбы используют двугорловую круглодонную колбу, к которую вставлена делительная воронка с двумя метками 30 и 60 см3. В качестве приемника служит мерный цилиндр с метками 30 и 60 см3.
В перегонную колбу отвешивают 2,8–3,2 г размолотого ячменя, приливают 100 см3 12 %-него раствора соляной кислоты и нагревают колбу до 140–150°С. Нагревание обычно рекомендуется вести в чашках со сплавом Вуда или Розе, но можно вести его просто на асбестовой сетке при кипении жидкости с таким расчетом, чтобы в течение 10–15 минут в приемнике скопилось 30 см3 дистиллята.
Как только в приемнике накопится 30 см3 дистиллята, приемник освобождают, сливая дистиллят в приемную колбу с меткой 400 см3, и закрывают ее пробкой. В перегонную колбу через делительную воронку приливают порцию соляной кислоты в количестве 30 см3. Повторяют операцию, примерно, десять раз и прекращают дистилляцию, когда капля дистиллята перестанет окрашивать в малиновый цвет кусочек фильтровальной бумаги, смоченной смесью анилина и уксусной кислоты, взятых в пропорции 3:2.
К дистилляту прибавляют растворенный в нескольких миллилитрах 12 %-ного раствора соляной кислоты флороглюцин, которого берут двойное количество (по весу) от предполагаемого по расчету количества фурфурола (0,3г). Содержимое приемной колбы доливают 12 %-ным раствором соляной кислоты до метки 400 и хорошо размешивают. Через 3 часа проверяют полноту осаждения по реакции с уксуснокислым анилином; окрашивания не должно быть, в противном случае добавляют еще некоторое количество флороглюцина, через 3 часа вновь определяют полноту осаждения и оставляют отстаиваться в течение ночи.
Выпавший зеленовато-черный осадок собирают на высушенном и взвешенном фильтре, промывают, примерно, 150 см3 дистиллированной воды (операцию фильтрования и промывания можно вести при некотором разрежении). Отфильтрованный осадок, поместив его с фильтром в бюкс, высушивают при 98–100 °С в течение 3,5 – 4 часов и после охлаждения в эксикаторе взвешивают.
По полученной массе осадка, пользуясь диаграммой Приложения 1, находят количество пентозанов во взятой навеске и пересчитывают его на 100 г сухого вещества.
Контрольные вопросы:
1. Дайте характеристику пентозанам: строение, состав, свойства.
2. Какие моносахариды получаются при гидролизе пентозанов?
3. Напишите уравнения химических реакций превращения пентозанов в фурфурол.
Лабораторная работа № 4
Определение аминного азота в мелассе
Аминный азот представлен в растительном сырье аминокислотами, пептидами и белками, которые являются источником азотного питания дрожжей, и содержание их в процессе брожения заметно снижается. В результате их превращений под действием дрожжей образуются высшие спирты. При термической обработке аминокислоты и пептиды, вступая во взаимодействие с сахарами, образуют меланоидины, альдегиды и другие продукты, оказывающие существенное влияние на качество конечной продукции.
Химизм процесса при определении аминного азота медным способом сводится к следующему. При взаимодействии натриевой соли аминокислоты с суспензией фосфата меди образуется окрашенная в синий цвет хорошо растворимая комплексная медная соль аминокислоты:
|
|
Фосфорная кислота связывается боратным буфером, и реакция идет до конца.
В фильтрате после отделения избытка фосфата меди оказываются лишь медные соли аминокислот (за исключением цистина, медная соль которого нерастворима), и, следовательно, по количеству меди, перешедшей в фильтрат, можно определить содержание аминокислот.
При добавлении к фильтрату концентрированной уксусной кислоты, последняя вытесняет из медной соли более слабую аминокислоту:
![]() (H2N - СН2 - СОО)2Сu + 2СН3СООН 2H2N - СН2 - СООН + (СН3СОО)2 Сu
(H2N - СН2 - СОО)2Сu + 2СН3СООН 2H2N - СН2 - СООН + (СН3СОО)2 Сu
Под действием йодоводородной кислоты, образовавшейся из йодида калия в кислой среде, ион меди со степенью окисления +2 восстанавливается, образуется нерастворимый йодид меди (I) и свободный йод:
![]()
![]() 2(СН3СОО)2Сu + 4 HI 2CuI + 4СН3СООН + 12
2(СН3СОО)2Сu + 4 HI 2CuI + 4СН3СООН + 12
Вследствие нерастворимости йодида меди (I) в слабокислой среде этот процесс также идет до конца. Таким образом, количество выделившегося свободного йода эквивалентно количеству медных солей аминокислот. Концентрацию свободного йода определяют титрованием выделившегося йода раствором гипосульфита:
![]() 2Na2S2O3 + I2 2NaI + Na2S4O6
2Na2S2O3 + I2 2NaI + Na2S4O6
гипосульфит тетратионат натрия
По уравнению реакции 0,5 моль выделившегося йода соответствует 1 мо–ль меди, который в свою очередь эквивалентен 28 г аминного азота. С другой стороны, 0,5 моль йода реагирует с одним грамм-эквивалентом гипосульфита. Следовательно, один грамм-эквивалент гипосульфита соответствует 28 г аминного азота. Отсюда 1 см3 0,01н раствора гипосульфита отвечает 0,28 мг аминного азота. Умножением величины 0,28 мг на затраченный объем 0,01н раствора гипосульфита (минус контроль) получают количество миллиграммов аминного азота во взятом, объеме (10 см3) испытуемого раствора. После этого делают пересчет на весь объем раствора в колбе и сравнивают найденное количество аминного азота с тем, что должно быть в 2 см3 исследуемого раствора мелассы:
| 0,28 . V . 12.5 С = –––––––––––– , m |
где: V – объем гипосульфита, пошедший на титрование;
12,5 – коэффициент разбавления;
m – масса мелассы на 100 г раствора.
Оборудование: фильтры бумажные, колбы мерные на 25 см3 (2 шт.), пипетки с меткой на 1, 2 и 10 см3, бюретки прямые с краном на 25 или 50 см3, воронки для фильтрования, колбы конические на 100 см3 (4 шт.), цилиндр мерный с носиком на 10 см3.
Реактивы: раствор хлорида меди (II): 27,3 г в 1 дм3 раствора; раствор фосфата натрия: 68,5 г Na3PO4 ·12H2O в 1 дм3 раствора или 64,5 г Na2HPO4·12H2O растворяют в 500 см3 дистиллированной воды, из которой кипячением удален СО2, и добавляют 7,2 г NaOH с последующим доведением объема раствора до 1 дм3 дистиллированной водой; боратный буферный раствор; 28,6 г тетрабората натрия растворяют в 750 см3 воды, добавляют 50см3 1н раствора соляной кислоты и доводят водой до 1 дм3; рН=8,8; суспензия фосфата меди: смешивают один объем раствора хлорида меди (II) с двумя объемами раствора фосфата натрия и приливают два объема боратного буфера, суспензию готовят только перед работой в необходимом объеме; тимолфталеин: 0,25 %-ный в этиловом спирте (50 %-ом); 0,1н раствор Na2S2O3·5H2O (из этого раствора разбавлением готовится 0,01 н раствор, титр которого устанавливают по точному раствору 0,01 н йода калия); крахмал (1 %-ный), йодид калия (10 %-ный), уксусная кислота (конц.), гидроксид натрия (0,5 н), меласса (13 %-ный раствор).
Ход анализа. В мерную колбу на 25 см3 берут 2 см3 исследуемого раствора мелассы, добавляют 2 капли тимолфталеина и по каплям 0,5н раствор гидроксида натрия до слабоголубого окрашивания (рН раствора 10,2). После этого добавляют 10 см3 суспензии фосфата меди, хорошо перемешивают. При исчезновении осадка следует добавить еще 5 см3 суспензии. Раствор в колбе доводят до метки водой, тщательно перемешивают многократным переворачиванием колбы и отфильтровывают избыток фосфата меди через плотный фильтр. Фильтрат должен быть совершенно прозрачным. Этого добиваются многократным фильтрованием. Из фильтрата пипеткой берут две пробы по 10см3 в конические колбы для титрования, подкисляют 0,4 см3 концентрированной уксусной кислоты, добавляют 6–8 см3 10%-ного раствора йодида калия и выделившийся йод титруют 0,01н раствором гипосульфита. Крахмал в количестве 1–2 см3 (20–40 капель) на 100 см3 раствора добавляют в тот момент, когда титруемый раствор примет соломенно-желтую окраску. Титрование продолжают до исчезновения появившейся после добавления раствора крахмала синей окраски.
Ставят контрольное определение, в котором вместо мелассы берут такой же объем воды. Количество гипосульфита, затрачиваемое на контрольный раствор, вычитают из такового в опыте.
Контрольные вопросы:
1. Белки. Их строение состав и свойства;
2. Содержание азотистых веществ в ячмене. Их роль в пивоварении;
3. Химизм процесса определения аммиачного азота медным способом.
Раздел 2. КОНТРОЛЬ КАЧЕСТВА ПИВА
Завершающим этапом технологического контроля производства пива является оценка качества готового продукта, которая осуществляется по органолептическим и физико–химическим показателям.
Главнейшими показателями качества пива как напитка являются прозрачность, цвет, вкус, аромат, хмелевая горечь, пенообразование. Все эти свойства пива определяются в процессе дегустации.
К физико–химическим показателям пива относят массовую долю сухих веществ в начальном сусле, массовую долю спирта и действительного экстракта, кислотность, цветность, массовую долю двуокиси углерода (для бутылочного пива), стойкость пива, время дображивания.
Лабораторная работа № 5
Определение горьких веществ в пиве
Вкус пива относят к органолептическим показателям. Горький вкус пива вызван в основном горькими веществами хмеля, а также дубильными веществами как хмеля, так и оболочки солода и несоложенных злаков. Горькие вещества хмеля представлены мягкими и твердыми смолами. Мягкие смолы – это α–кислота (гумулон), β–кислота (лупулон), мягкие α– и β–смолы, γ–кислота (гумулион), σ–кислота (гулупон), а также β–фракция (сумма β–кислот и мягких смол). Твердые смолы разделяют на γ– и σ–смолы.
Среди горьких веществ наибольшая доля приходится на α–кислоту. При сушке и хранении хмеля она окисляется и полимеризуется с образованием мягкой α–смолы, а при более глубоком окислении – твердой смолы. При кипячении сусла α–кислота превращается в изо–α–кислоту, обладающую большей горечью и растворимостью в воде.
В составе β–кислот преобладает лупулон, который при кипячении сусла остается в хмелевой дробине. При окислении превращается в β–смолы, растворимые в сусле и пиве.
| | |
| α-кислоты | изо–α-кислота |
| R: изобутил (гумулон); изопропил (когумулон); втор–бутил (адгумулон) | |
Растворимость мягких смол в сусле выше, чем кислот, из которых они образованы.
Твердые смолы, образующиеся при окислении кислот, обладают незначительной горечью, только σ–твердая смола имеет грубую горечь и хорошо растворима в сусле и пиве.
В процессе получения пива часть горьких веществ теряется из–за их адсорбции на дрожжах и при всплытии на пузырьках СО2. Лишь 20–40 % исходных горьких веществ присутствует в пиве.
Растворителем горьких веществ в пиве также, как и в сусле, служит хлороформ, причем надо отметить, что из всего комплекса горьких веществ α-горькая кислота (гумулон) при рН пива обладает наибольшей растворимостью и во много раз превосходит в этом отношении β-горькую кислоту (лупулон).
Оборудование: колбы на 75, 100 и 1000 см3, делительные воронки на 100 и 1000 см3, центрифуга, пипетка, бумажный фильтр, эксикатор, сушильный шкаф.
Реактивы: раствор серной кислоты, хлороформ, безводный сернокислый натрий.
Ход анализа: Пиво предварительно освобождают от главной массы углекислоты взбалтыванием и фильтрованием. Для чего пиво в количестве 250-400 см3 наливают в колбу емкостью около 1 дм3 и при комнатной температуре взбалтывают его, закрыв горло сосуда ладонью и приоткрывая сосуд, время от времени, пока прекратиться ощущение давления изнутри. Непрозрачное пиво следует отфильтровать.
400 см3 (V) пива помещают в колбу со стеклянной притертой пробкой емкостью 750 – 1000 см3, подкисляют их 5 см3 разведенной серной кислоты и добавляют 50 см3 хлороформа. Колбу устанавливают в «трясучку» и содержимое подвергают энергичному встряхиванию в течение 30 минут, после чего переливают его в делительную воронку емкостью 500—750 см3 и дают в течение нескольких часов отслоиться водной части от хлороформенной. Образовавшуюся хлороформенную эмульсию для разрушения подвергают центрифугированию в течение 10 – 15 минут при 2000 – 3000 об/мин. Водную часть в центрифужных пробирках тщательно декантируют, а прозрачный хлороформенный экстракт, отстоявшейся на дне пробирок, отсасывают пипеткой, просовывая копчик ее через слой светло-серой массы, скопившейся над хлороформом, и собирают его в делительную воронку на 80 – 100 см3.
После 5–10-минутного отстаивания хлороформенный слой собирают в колбочку емкостью 100 – 150 см3 с притертой стеклянной пробкой. В колбочку предварительно помещают около 15 г безводного сернокислого натра для сушки хлороформенного экстракта. Содержимое колбочки в течение 5 – 10 минут перемешивают, после чего хлороформенный экстракт фильтруют через небольшой бумажный фильтр.
30 см3 (V1) фильтрата отбирают пипеткой в предварительно взвешенную круглодонную колбочку емкостью около 75 см3. Хлороформ отгоняют под вакуумом на кипящей водяной бане до полного его удаления. Колбочку с остатком выдерживают 1 час в эксикаторе (лучше в вакуум-эксикаторе с водоотнимающим веществом) и взвешивают. Допускается отгонка хлороформа без вакуума на водяной бане при 65–70 °С, а остаток в круглодонной колбе можно подвергать сушке в сушильном шкафу при 70 °С в течение 1 часа. Содержание горьких веществ (Х) в граммах в 1 дм3 пива находится по формуле:
|
|
где: m – вес остатка в колбе после отгонки хлороформа, в г;
V – объем пива, взятого для анализа, в см3;
V1– объем фильтрата для анализа, в см3
Нормально в пиве содержится около 0,03-0,09 г горьких веществ в 1 дм3.
Контрольные вопросы:
1. Чем обусловлен горьких вкус пива?
2. Горькие вещества хмеля и их превращения в процессе получения пива;
3. Перечислите свойства α–кислот;
4. Сущность метода определения содержания α–кислот.
Лабораторная работа № 6
Определение спирта, действительного экстракта и
расчет сухих веществ в начальном сусле
Содержание массовой доли спирта и действительного экстракта находят дистилляционным или рефрактометрическим методами. Дистилляционный метод основан на отгонке спирта из навески пива и определении относительной плотности дистиллята и остатка пива после отгонки.
Оборудование: весы аналитические с наибольшим пределом взвешивания 200 г; баня водяная; шкаф сушильный; пикнометр, установка для атмосферной перегонки.
Реактивы: калия бихромат; кислота серная; спирт этиловый ректификованный; хромовая смесь: 1,2 г бихромата калия растворяют в 100 см3 серной кислоты.
Освобождение пива от двуокиси углерода. 250-300 см3 пива наливают в колбу вместимостью 1000 см3, доводят температуру до 20 °С, затем встряхивают, закрыв колбу ладонью, периодически приоткрывая ее, до тех пор, пока прекратится ощущение давления изнутри. Встряхивание повторяют два-три раза с интервалом в 5 мин. Непрозрачное пиво фильтруют через бумажный фильтр.
Похожие работы
... — молодежи меньше, чем стариков, т.е. для России характерно состояние демографического старения. Средняя продолжительность жизни в РФ - 64г (у мужчин - 59 лет, у женщин 68). В РФ 24% населения - пенсионеры, 11,6% от экономически активного населения- безработных (ноябрь 98г). Женское население составляет - 53%. В настоящее время нац. состав меняется. Последняя перепись (89г) отметила рост жителей ...
... розничного центра «Санвэй». Деятельность этого центра позволяет организации привлекать как розничных, так и мелкооптовых покупателей, что дает организации дополнительную прибыль. 3.1 Анализ ситуации на рынке бытовой химии Российский рынок CMC (синтетические моющие средства) практически заполнен, тем не менее на нем продолжают развиваться качественные изменения: доля простейших CMC снижается ...
... , сверхпрочные, имеющие физическую память, селективные мембраны Химическая промышленность настроена на вытеснения традиционных производителей конструкционных материалов. 2 Современное состояние химической и нефтехимической промышленности в Российской Федерации 2.1 Химия и нефтехимия в России Минувший 2004 год закончился для крупнейших химических компаний более чем удачно — доходы здесь ...
... предмета. Такие идеи для естествознания весьма удачно сформулировали в двадцати фразах современные американские физики Роберт Хейзен и Джеймс Трефил. Первые семь из них общие для естествознания, а остальные относятся к его отраслям. Вот эти великие научные истины. · Вселенная регулярна и предсказуема. · Все движения можно описать одним набором законов (имеются в виду три закона Ньютона ...
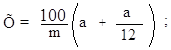
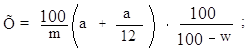
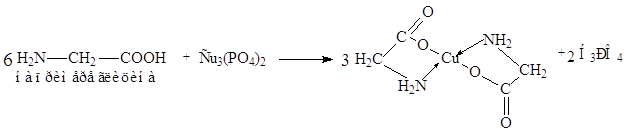
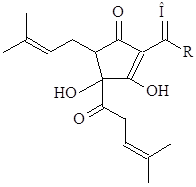
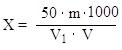

0 комментариев