Навигация
Выделение органических кислот из вина с помощью
12.1. Выделение органических кислот из вина с помощью
анионообменных смол
Оборудование. Колонка стеклянная, снабженная краном.
Реактивы: анионообменная смола вофатит 100-200 меш или АВ-17-8; 4-5% раствор (NH4)2CO3 или NH4HCO3; нитрат серебра, 0,1 М раствор; уксусная кислота, раствор 1 : 4: на 1 часть ледяной уксусной кислоты добавляют 4 части воды; уксусная кислота, 0,5, 6 и 30 % растворы; сульфат натрия, 0,5 М раствор: 71 г безводного Na2SO4 или 161 г Na2SO4 ·10 Н2О растворяют в мерной колбе объемом 1 дм3 и доводят водой до метки.
Подготовка колонки с ионообменной смолой. Органические кислоты выделяют из вина с помощью анионообменной смолы вофатит 100-200 меш или АВ-17-8 в уксуснокислой форме. Препарат анионита в С1–-форме промывают 4-5% раствором (NH4)2CO3 или NH4HCO3, потом водой до исчезновения реакции на хлорид-ионы (добавление к 1 см3 промывной воды 1-2 капель 0,1М AgNO3 не должно вызывать помутнения). Анионит промывают 2-3 раза водой, потом теплым (40-50°С) раствором уксусной кислоты 1:4 до исчезновения вспенивания. Для перевода анионита в уксуснокислую форму к 100 г смолы приливают 200 см3 30 %-ной уксусной кислоты и оставляют в контакте не менее суток при периодическом перемешивании. Смолу хранят в растворе 6% уксусной кислоты.
Ионообменные стеклянные колонки (высотой 15 см, диаметром 0,8-1,0см) заполняют анионитом (высота слоя 5-6 см). Для предупреждения возможного вытекания суспензии смолы или ее взмучивания на дно колонки помещают ватный тампон и таким же тампоном прикрывают слой смолы сверху.
Следят за тем, чтобы смола в колонке все время находилась под слоем жидкости.
Ход работы. Заполненную колонку 3-4 раза промывают 0,5 % раствором уксусной кислоты порциями по 10 см3, пропускают через нее 10 см3 исследуемой пробы (сусло или вино) со скоростью 1 см3/мин и снова промывают 10 см3 0,5 % раствора уксусной кислоты и 7 раз по 10 см3 дистиллированной воды (скорость вытекания жидкости 2 см3/мин). Адсорбированные кислоты элюируют 0,5 М раствором Na2SO4. Элюат собирают в мерную колбу объемом 50 см3 до метки, тщательно перемешивают и используют для определения массовой концентрации кислот: винной (п.12.2 ), молочной (п.12.3) и яблочной (п.12.4).
12.2. Колориметрический метод определения массовой концентрации
винной кислоты
Оборудование: Спектрофотометр.
Реактивы: Метаванадат аммония 2%-ный раствор: 10 г NH4VO3 растворяют в 150 см3 1 М NaOH в мерной колбе объемом 500 см3, добавляют 200 см3 27% раствора ацетата натрия и доводят водой до метки; 1 М (2 н) и 0,05 М (0,1 н) растворы серной кислоты; 0,05 М раствор йодной кислоты (НIO4-2Н2О); 10% раствор глицерина; стандартный раствор винной кислоты (0,5 мг/см3): 250 мг винной кислоты растворяют в мерной колбе объемом 500 см3.
Ход анализа. По 10 см3 элюата, полученного в работе п. 12.1, помещают в 2 колбы объемом 50 см3. В колбу I добавляют 1 см3 1 М раствора H2SO4, 2,5 см3 0,05 М раствора H2SO4 и 0,5 см3 раствора глицерина. В колбу II (контрольный раствор) помещают 1 см3 1 М раствора H2SO4, 2,5 см3 йодной кислоты, дают постоять 15 мин до полного разрушения винной кислоты, добавляют 0,5 см3 10 %-ного раствора глицерина для удаления избытка периодата и оставляют на 2 мин. Добавляют сначала в колбу II, а потом в колбу I по 2,5 см3 раствора метаванадата аммония и измеряют ровно через 90 с оптическую плотность раствора в колбе I против контрольного раствора при длине волны 490 нм в кювете толщиной 5 мм.
Концентрацию винной кислоты определяют по калибровочному графику с учетом разбавления при обработке анионитом (разбавление в данных условиях определения равно 5).
Построение калибровочного графика. 10, 20, 30, 40 и 50 см3 стандартного раствора винной кислоты пропускают через ионообменные колонки, собирая по 50 см3 элюата. Растворы содержат винной кислоты соответственно 0,1, 0,2; 0,3; 0,4; 0,5 г/дм3. Отбирают 2 раза по 10 см3 каждого из элюатов и анализируют, как указано выше. Строят график зависимости оптической плотности от концентрации винной кислоты.
Контрольные вопросы:
1. Дайте характеристику строения и свойств изомеров винной кислоты.
2. Роль винной кислоты и ее солей в виноделии.
3. На чем основан калориметрический метод определения содержания винной кислоты?
12.3. Определение массовой концентрации молочной кислоты
Молочная кислота НООС–СНОН–СН3 относится к одноосновным алифатическим оксикислотам винограда и вина. Основное количество молочной кислоты образуется в процессе яблочно-молочного брожения, которое позволяет смягчить резкий вкус «зеленой» кислотности молодых вин. Малокислотные столовые вина с остаточным сахаром, а также крепкие и десертные вина иногда подвергаются молочнокислому брожению, которое сопровождается повышением содержания молочной и летучих кислот. Заболевание вина сопровождается появлением «квашенных» тонов и вкуса молочной сыворотки, иногда «мышиного» привкуса. Концентрация молочной кислоты в белых винах может достигать 2,5 г/дм3, в красных - 4,5 г/дм3.
Принцип метода. Метод основан на окислении молочной кислоты сульфатом церия (IV) в ацетальдегид, который, реагируя с пиперидином и нитропруссидом натрия, дает окрашенный продукт, определяемый колориметрически.
Оборудование. Фотоэлектроколориметр, пробирки с притертой пробкой объемом 25 см3; водяная баня с термостатом на 65°С.
Реактивы. Сульфат церия Ce(SO4)2 4H2O, 0,1 М раствор в серной кислоте: ![]() 40,431 г Ce(SO4)2 · 4H2O растворяют в 350 см3 1 М (2 н) H2SO4 в мерной колбе объемом 1 дм3 и доводят до метки; пиперидин: 200 см3 пиперидина разбавляют водой до 1 дм3 (готовят за 3-4 дня до применения); нитропруссид натрия, 0,4% раствор: 1 г реактива растворяют в воде в мерной колбе объемом 250 см3 (готовят перед применением); молочная кислота, 1 М раствор.
40,431 г Ce(SO4)2 · 4H2O растворяют в 350 см3 1 М (2 н) H2SO4 в мерной колбе объемом 1 дм3 и доводят до метки; пиперидин: 200 см3 пиперидина разбавляют водой до 1 дм3 (готовят за 3-4 дня до применения); нитропруссид натрия, 0,4% раствор: 1 г реактива растворяют в воде в мерной колбе объемом 250 см3 (готовят перед применением); молочная кислота, 1 М раствор.
Ход анализа. К 5 см3 элюата, полученного в работе 12.1, наливают в пробирку объемом 25 см3, добавляют 5 см3 раствора сульфата церия, закрывают и оставляют на 90 мин при комнатной температуре. Затем добавляют 5 см3 раствора пиперидина, размешивают, фильтруют через складчатый фильтр. К 5 см3 фильтрата добавляют 5 см3 раствора нитропруссида натрия. Размешивают и переносят сразу в кювету толщиной 1 см для колориметрирования. Интенсивность окраски определяют при длине волны 570 нм в кювете толщиной 0,5 см против воды. Максимальная окраска достигается через 60-90 с. За это время делают 2-3 замера оптической плотности. Из значения максимальной плотности окраски вычитают значение оптической плотности контрольного опыта (вместо 5 см3 элюата берут 5 см3 раствора сульфата натрия, анализируют в тех же условиях, что и элюат).
Содержание молочной кислоты (в г/дм3) определяют по калибровочному графику с учетом разбавления пробы при обработке (разбавление равно 5).
Построение калибровочного графика. В мерную колбу объемом 100 см3 наливают 1 см3 1 М раствора молочной кислоты и доводят 7,1% раствором сульфата натрия до метки (рабочий раствор). В мерные колбы объемом 50 см3 помещают по 2,5; 5,0; 7,5; 10,0; 12,5 и 15 см3 рабочего раствора и доводят раствором сульфата натрия до метки. Концентрация молочной кислоты в растворах составляет 0,045; 0,090; 0,135; 0,180; 0,225; 0,270 г/дм3. Из каждой колбы отбирают по 5 см3 и анализируют, как описано ранее. Строят график зависимости оптических плотностей от концентраций.
Примечание. Вина, содержащие более 250 мг/дм3 диоксида серы, могут содержать некоторое количество альдегидсернистой кислоты, которая определяется так же, как молочная кислота. В этом случае в результат определения необходимо внести поправку. Для этого 15 см3 элюата смешивают в пробирке с притертой пробкой с 5 см3 ацетата натрия массовой концентрации 27 г/100 см3 и 2 см3 раствора H2SO4 (77,5 мл H2SO4 доводят до 100 см3 водой). Затем добавляют 5 см3 раствора нитропруссида натрия (2 г/100 см3) и 5 см3 10% раствора пиперидина. После смешивания измеряют оптическую плотность при соблюдении условий, описанных для измерения молочной кислоты. По этой величине на калибровочном графике находят концентрацию В (г/дм3) молочной кислоты совместно с альдегидсернистой кислотой. Если L' - содержание молочной кислоты в вине без корректировки, то реальное содержание молочной кислоты (L, г/дм3) составит
| L = L' – 0,4 В. |
Контрольные вопросы:
1. Источники образования молочной кислоты в винах;
2. Роль молочной кислоты в виноделии;
3. На чем основан метод определения содержания молочной кислоты?
12.4. Определение массовой концентрации яблочной кислоты
Яблочная кислота относится к многоосновным оксикислотам, содержит асимметрический углеродный атом. В процессе созревания винограда количество ее уменьшается и в период физиологической зрелости ягод составляет 2–5 г/кг. В процессе спиртового брожения концентрация яблочной кислоты снижается вследствие ее потребления дрожжами. Молочнокислые бактерии сбраживают яблочную кислоту в молочную, при этом происходит снижение содержания титруемых кислот и повышение рН, формирование мягкого гармоничного вкуса вин. Концентрация яблочной кислоты в винах не превышает 5 г/дм3.
Значительное количество яблочной кислоты содержат незрелые ягоды: до 15 г на 1кг винограда. Яблочная кислота участвует в дыхательных процессах и к моменту достижения технической зрелости ее содержание снижается до 2–5 г на 1кг. В северных районах виноградарства, а также при холодной погоде осенью в южных районах виноград может быть излишне кислым из-за избытка яблочной кислоты. Столовые вина из такого винограда имеют привкус так называемой "зеленой кислотности". Под действием дрожжей и бактерий при благоприятных условиях происходит биологическое кислотопонижение, связанное с превращением яблочной кислоты в слабо диссоциированную молочную кислоту. Применяют также химические методы нейтрализации избыточного количества яблочной кислоты в виноградном сусле или вине.
Принцип метода. Метод основан на реакции взаимодействия яблочной кислоты с хромотроповой и серной кислотами, вследствие чего образуется комплекс желто-зеленого цвета, интенсивность окраски которого определяется колориметрически.
Оборудование. Фотоэлектроколориметр, пробирки с притертой пробкой объемом 25 см3.
Реактивы. Серная кислота концентрации 96% мас. и 86% мас; динатриевая соль хромотроповой кислоты (хромотроповая кислота – это 1,8–ди–оксинафталин–3,6–дисульфокислота), 5% водный раствор (готовят непосредственно перед определением, хранят в темной склянке); стандартный раствор DL- или L- яблочной кислоты (1 мг/см3): 500 мг яблочной кислоты растворяют в мерной колбе объемом 500 см3; сульфат натрия, 7,1%-ный раствор.
Техника определения. 1 см3 элюата, полученного в работе 12.1, помещают в пробирку с притертой пробкой, добавляют 1 см3 раствора соли хромотроповой кислоты и 10 см3 96% H2SO4, размешивают и погружают в кипящую водяную баню на 20 мин. Быстро охлаждают до 20°С и точно через 90 мин определяют оптическую плотность раствора. Все операции с момента прибавления динатриевой соли хромотроповой кислоты следует проводить в затемненном месте. Колориметрируют при длине волны 420 нм в кювете толщиной 10 мм.
Раствор сравнения готовят так же, заменяя 1 см3 элюата на такое же количество 7,1%-ного раствора Na2SO4 и 96% серную кислоту - на 86%.
Концентрацию яблочной кислоты определяют по калибровочному графику. Полученный результат умножают на разбавление (в данных условиях разбавление равно 5).
Построение калибровочного графика. Через 6 ионообменных колонок, заполненных анионитом, пропускают 5, 10, 15, 20, 25 и 30 см3 стандартного раствора яблочной кислоты и выполняют все операции по промывке и элюированию. По 1 см3 элюатов отбирают в пробирки и анализируют, как указано ранее. Строят график зависимости оптической плотности от концентрации яблочной кислоты. Концентрация элюатов соответствует концентрации яблочной кислоты 0,1; 0,2; 0,3; 0,4; 0,5; 0,6 г/дм3 .
Контрольные вопросы:
1. Источники образования яблочной кислоты в винах;
2. Роль яблочной кислоты в виноделии;
3. На чем основан метод определения содержания яблочной кислоты?
12.5. Определение массовой концентрации лимонной кислоты
Лимонная кислота НООС–СН2–С(СООН)(ОН)–СН2–СООН относится к группе многоосновных оксикислот. Содержится в небольших количествах (0,2–0,5 г/кг) в ягодах винограда, а также образуется как вторичный продукт при спиртовом брожении. Содержание в винах составляет до 0,3 г/дм3. В виноделии разрешено использовать лимонную кислоту для исправления низкокислотных виноматериалов: увеличения содержания титруемых кислот и обеспечения требуемых кондиций, а также обеспечения стабильности к микробиальным помутнениям. Для этой цели лимонная кислота вводится в вино в количестве, не превышающем 2 г/дм3.
Введение лимонной кислоты в вина, в которых идет процесс яблочно-молочного брожения, нецелесообразно, так как бактерии ее ассимилируют.
Лимонная кислота применяется также для предотвращения железного касса, поскольку образует стойкий растворимый комплекс с ионами трехвалентного железа.
Принцип метода. Лимонную кислоту фиксируют вместе с другими органическими кислотами вина на анионообменной смоле. Затем проводят фракционное элюирование, которое позволяет отделить ее от лимонно-яблочной кислоты. Лимонная кислота с помощью щадящего окисления переводится в ацетон, который отделяют дистилляцией. Уксусный альдегид, отгоняемый вместе с ацетоном, окисляется до уксусной кислоты, после чего ацетон определяют иодометрическим методом.
Оборудование: анионообменная колонка, установка для атмосферной перегонки.
Реактивы: Смола Дауэкс 1×2 (50-100 меш.); уксусная кислота, растворы 4 М и 2,5 М; гидроксид натрия, раствор 2 М; серная кислота (р20=1,84 г/см3), разбавленная 1:5 и 1:3 по объему; буферный раствор рН 3,2-3,4: 150 г дигидро-фосфата калия КН2РО4, 5 см3 фосфорной кислоты (р20= 1,70 г/см3) доводят водой до 1 дм3; сульфат марганца, раствор массовой концентрации 50 г/дм3; пемза; перманганат калия, растворы 0,01 М и 0,4 М; сульфат железа (II) FeSO4∙7H2O, раствор массовой концентрации 40г/100 см3; гидроксид натрия, 5 М раствор; йод, 0,01 М раствор; тиосульфат натрия Na2S2O3, 0,02 М раствор; раствор крахмала.
Подготовка анионообменной колонки: в бюретку объемом 25 см3 с краном помещают тампон из стекловаты и наливают 20 см3 смолы Дауэкс 1×2. Вначале подвергают смолу двум полным циклам регенерации с попеременным пропусканием растворов 1 М соляной кислоты и гидроксида натрия. Ополаскивают 50 см3 воды (пропускание раствора гидроксида натрия вызывает уплотнение с последующим набуханием при промывании водой, что мешает стеканию). Как только первые миллилитры воды начинают проходить через колонку, рекомендуется взбалтывать смолу, чтобы поднять ее со дна бюретки. Переводят смолу в ацетатную форму, пропуская 250 см3 4 М раствора уксусной кислоты; промывают 100 см3 воды.
Анализируемый образец пропускают через колонку в соответствии с описанием, приведенным далее. После элюирования кислот промывают смолу 50 см3 дистиллированной воды и производят снова насыщение смолы 4 М раствором уксусной кислоты. Ополаскивают 100 см3 дистиллированной воды.
Ход анализа:
Отделение лимонной и лимонно-яблочной кислот. Пропускают 25 см3 вина через анионообменную колонку Дауэкс 1×2 в ацетатной форме со скоростью 1,5 см3 в мин. Ополаскивают колонку 20 см3 дистиллированной воды в три приема. Элюируют кислоты 200 см3 2,5 М раствора уксусной кислоты, пропуская элюат с той же скоростью. В этой фракции элюата содержатся кислоты: янтарная, молочная, галактуроновая, лимонно-яблочная и почти вся яблочная. Затем производят элюирование лимонной и винной кислот, пропуская через колонку 100 см3
Похожие работы
... — молодежи меньше, чем стариков, т.е. для России характерно состояние демографического старения. Средняя продолжительность жизни в РФ - 64г (у мужчин - 59 лет, у женщин 68). В РФ 24% населения - пенсионеры, 11,6% от экономически активного населения- безработных (ноябрь 98г). Женское население составляет - 53%. В настоящее время нац. состав меняется. Последняя перепись (89г) отметила рост жителей ...
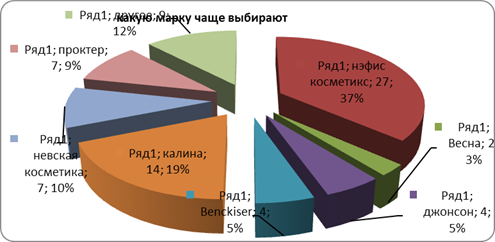
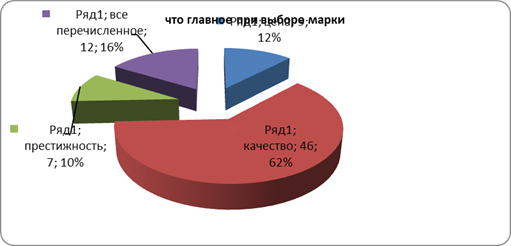
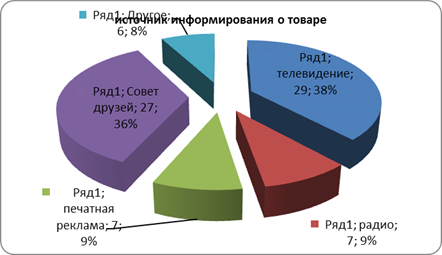
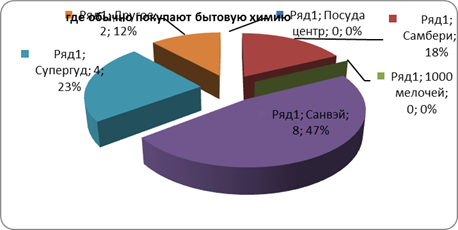
... розничного центра «Санвэй». Деятельность этого центра позволяет организации привлекать как розничных, так и мелкооптовых покупателей, что дает организации дополнительную прибыль. 3.1 Анализ ситуации на рынке бытовой химии Российский рынок CMC (синтетические моющие средства) практически заполнен, тем не менее на нем продолжают развиваться качественные изменения: доля простейших CMC снижается ...
... , сверхпрочные, имеющие физическую память, селективные мембраны Химическая промышленность настроена на вытеснения традиционных производителей конструкционных материалов. 2 Современное состояние химической и нефтехимической промышленности в Российской Федерации 2.1 Химия и нефтехимия в России Минувший 2004 год закончился для крупнейших химических компаний более чем удачно — доходы здесь ...
... предмета. Такие идеи для естествознания весьма удачно сформулировали в двадцати фразах современные американские физики Роберт Хейзен и Джеймс Трефил. Первые семь из них общие для естествознания, а остальные относятся к его отраслям. Вот эти великие научные истины. · Вселенная регулярна и предсказуема. · Все движения можно описать одним набором законов (имеются в виду три закона Ньютона ...

0 комментариев