Навигация
Изучение амилоидных фибрилл in vitro
2.4. Изучение амилоидных фибрилл in vitro
Первоначально, амилоидные фибриллы изучали, выделяя их из пораженных амилоидных отложений. В настоящее время для изучения амилоидных фибрилл, а также амилоидогенеза их формируют in vitro. Открытие того, что амилоидные фибриллы формируют не только белки, связанные с амилоидозами, значительно расширило эту область исследования (Dobson, 1999). Было показано, что при подходящих условиях образовывать амилоидные фибриллы in vitro могут многие белки, такие как лизоцим, миоглобин, Аβ пептид, амилин, тау-белок, хангтингтин, мышечная ацилфосфатаза и др. (Uversky & Fink 2004).
Отмечено, что амилоидогенные белки обладают различными способностями к формированию амилоидов, что отражается также в различной скорости этого процесса. Например, мышечная ацилфосфатаза человека способна формировать аморфные агрегаты после первых часов инкубации и только через 45 дней появляются пучки фибрилл (Chiti et al., 1999) (рис. 6). Аβ(1-40)-пептид после 4 часов инкубации образует аморфные агрегаты, и только после 48 часов – длинные фибриллы (Qahwash et al., 2003), а образование фибрилл α-лактальбумина занимает несколько дней (Goers et al., 2002).
За скоростью амилоидогенеза наблюдают с помощью классического амилоидного красителя тиофлавина Т, который специфически взаимодействует с амилоидными фибриллами (Krebs et al., 2005). При взаимодействии тиофлавина Т с амилоидными фибриллами происходит увеличение интенсивности флуоресценции красителя при спектрофлуорометрических измерениях и наблюдается желто-зеленая флуоресценция при флуоресцентно-микроскопических исследованиях. Молекула красителя состоит из бензтиазольного и аминобензольного колец свободно вращающихся вокруг общей С–С связи. Кребс и соавторы показали, что молекула тиофлавина Т связывается с амилоидными фибриллами специфически (Krebs et al., 2005). Они предположили, что связывание происходит в "каналах", которые тянутся вдоль β-слоев (рис. 7). Более того, тиофлавин Т связывается с амилоидными фибриллами так, что их молекулы параллельны друг другу и расположены вдоль длинной оси фибриллы (Krebs et. al., 2005). Было показано, что причиной возрастания интенсивности флуоресценции тиофлавина Т при его связывании с амилоидными фибриллами является жесткость окружения, препятствующая повороту бензтиазольного и аминобензольного колец молекулы друг относительно друга в возбужденном состоянии (Воропай и др., 2003).
Другой амилоидный краситель Конго красный также специфически взаимодействует с амилоидными фибриллами (Klunk et al., 1989). Конго красный – сульфонированый азокраситель с гидрофобной центральной частью, состоящей из бифенильной группы, расположенной между отрицательно заряженными концами молекулы красителя (рис. 8). При связывании Конго красного с амилоидными фибриллами наблюдается зеленое двойное лучепреломление в поляризационном микроскопе, и это свойство делает Конго красный наиболее используемым красителем для диагностики амилоидов. В спектральных исследованиях регистрируется сдвиг спектра поглощения Конго красного в состоянии, связанном с амилоидными фибриллами, в длинноволновую область спектра, а именно от ~490 нм к ~500 нм.
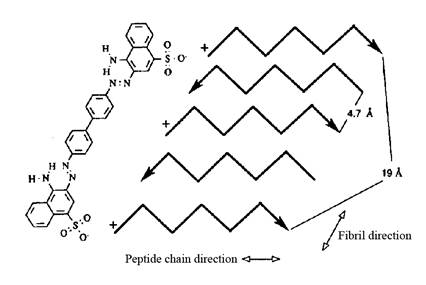
Рис. 8. Модель связывания Конго красного с амилоидными фибриллами. Показан антипараллельный слой, где каждая пятая цепочка белка имеет одинаковое N–C направление. Поэтому, молекула Конго красного может связываться с таким же типом аминокислоты в обеих полипептидных цепях (первой и пятой, как указано на рисунке). Следующая молекула красителя сможет связаться с третьей и седьмой цепочкой и т.д. (Klunk et al., 1989).
Связывание амилоидных фибрилл с Конго красным зависит от структуры амилоидных фибрилл, а именно от наличия β-складчатой структуры с отдельными β-слоями. Кланк и соавторы предложили модель связывания амилоидных фибрилл с Конго красным посредством связей между двумя отрицательно заряженными сульфоновыми группами Конго красного и двумя положительно заряженными аминокислотными остатками двух отдельных белковых молекул, которые определенным образом ориентированы в β-складчатой структуре фибрилл, образованной посредством бок о бок расположенных отдельных молекул (Klunk et al., 1989). Это означает, что белковые цепочки расположены на расстоянии 4.7 Å. Более того, каждая пятая цепочка расположена от первой на расстоянии 19 Å. Это, приблизительно, соответствует расстоянию между сульфоновыми группами КК (рис. 8). Данная модель показывает специфичность взаимодействия Конго красного с амилоидными фибриллами.
2.5. Патологические проявления амилоидозов
К настоящему времени выделяют следующие формы амилоидозов (Мягкова, 2000):
1) первичный (идиопатический) амилоидоз – развивается вследствие невыясненных причин;
2) вторичный (приобретенный) амилоидоз – развивается как осложнение после хронических заболеваний, при которых происходит распад тканей (туберкулез, бронхоэктатическая болезнь, хронический остеомиелит и др.);
3) наследственный (генетический, семейный) амилоидоз – врожденное нарушение белкового обмена;
4) старческий амилоидоз.
С другой стороны, амилоидоз разделяют на системный и локальный. Однако классификация системного амилоидоза основана на специфичности основного амилоидного белка.
Внешний вид органов при амилоидозе зависит от степени развития процесса. Если амилоидные отложения небольшие, внешний вид органа изменяется мало и амилоидоз обнаруживается лишь при гистологическом исследовании. При выраженном амилоидозе орган увеличивается в объеме, становиться очень плотным и ломким, а на срезе имеет своеобразный восковидный или сальный вид.
До сих пор остается нерешенным вопрос, касающийся механизма действия амилоидных фибрилл на органы и ткани. Исследования последних лет показали, что амилоидные агрегаты разных белков и пептидов вызывают нарушение жизнедеятельности клеток и их гибель. Как оказалось, цитотоксические свойства проявляют все амилоидные белки (Hashimoto et al., 2003; Qahwash et al., 2003; Sirangelo et al., 2004; Lee et al., 2006), однако неизвестно, чем обусловлена цитотоксичность этих агрегатов – механическим повреждением клеток, связанным с накоплением амилоидных отложений или особым молекулярным механизмом их взаимодействий внутри клетки.
цель исследования
Выяснение способности саркомерных белков семейства тайтина формировать амилоидные фибриллы in vitro.
задачи исследования
1. Изучить агрегационные свойства саркомерных белков семейства тайтина (тайтин, Х-, С- и Н-белки) in vitro.
2. Изучить агрегационные свойства Аβ(25-35)-пептида в сравнении с агрегацией молекул Х-белка.
3. Проверить амилоидную природу агрегатов, образуемых исследуемыми белками, поляризационной, флуоресцентной микроскопией и спектральными методами.
4. Изучить скорость образования амилоидных фибрилл.
Глава 3. Материалы и методы исследования
3.1. Экспериментальный и клинический материал
Экспериментальный материал: скелетные мышцы и миокард кролика.
Клинический материал: образцы миокарда пациента при ДКМП, взятые при проведении операции по пересадке сердца. Образцы миокарда человека были предоставлены ФГУ НИИ трансплантологии и искусственных органов Росздрава (г. Москва).
3.2. Выделение и очистка белковых препаратов
3.2.1. Очистка С-белка, Х-белка и Н-белка
Х-белок, С-белок и Н-белок очищали по методу (Offer et al., 1973). Фракции Х-, С- и Н-белков, полученные при хроматографической очистке миозина скелетных мышц на колонке с носителем DEAE-Sephadex А-50, концентрировали сульфатом аммония до степени насыщения 2.08 М и осаждали центрифугированием в течение 1 часа при 3000 g. Осадок растворяли в буфере, содержащем 0.3 M KCl, 4.8 мM K2HPO4, 5.2 мM KH2PO4, 0.1 мM ДТТ, 0.1 мM NaN3, pH 7.0, и диализовали против этого буфера до полного удаления сульфата аммония. Разделение белков проводили на колонке с гидроксиапатитом, уравновешенным в этом же буфере, для снятия белков с колонки использовали фосфатный градиент. Такая же процедура очистки применялась и для С-белка миокарда кролика и человека.
Похожие работы
... эффект ?-сон индуцирующего пептида при гипокинетическом стрессе // Укр.биохим.-1991.-63.-№1.-С.34-37. 118.Механизмы развития стресса // Сб.статей.- Кишинев: Штиинца.- 1987.-222с. 119.Митюшина Н.В. Влияние энкефалинов на активность ферментов обмена регуляторных пептидов в головном мозге и периферических тканях крыс // дис. на соиск. степени.канд.биол.наук.- Пенза.-1999 120.Наркевич В.Б. ...
... крови в мокроте больного в период стихания процесса не является противопоказанием к назначению массажа по предлагаемой методике. Продолжая поиски возможностей более эффективного применения массажа при этой патологии, О.Ф-.Кузнецов (1979, 1980) предложил для больных хронической пневмонией, бронхиальной астмой и хроническим бронхитом новую методику и обосновал ее большую эффективность при равнении ...
... , асцита, печеночной энцефалопатии). 5. Методом выбора при фульминантной форме ОАГ, а также у некоторых больных с алкогольным циррозом печени может быть трансплантация печени при условии минимум 6-месячной абстиненции [13]. 8. Клиническая фармакология гепатопротекторов В целом, ассортимент лекарственных средств, применяемых в комплексной терапии заболеваний печени и желчевыводящих путей, ...
... изучить влияние вышеуказанных препаратов на морфологические, иммуно-биохимические и гемастазиологические параметры крови и течение послеродового периода высокопродуктивных молочных коров. 2.2.4 Профилактическая эффективность фитопрепаратов при патологии послеродового периода у высокопродуктивных молочных коров Патология родов и послеродового периода у коров широко распространена в молочном ...


0 комментариев