Навигация
Метод флуоресцентного анализа
3.7.2. Метод флуоресцентного анализа
Исследование амилоидной природы фибрилл, а также исследование скорости амилоидообразования было проведено с использованием классического флуоресцентного красителя амилоидных структур тиофлавина Т (ТТ). Измерения флуоресценции проводили в растворе красителя (250 мкл) и суспензии фибрилл (250 мкл) в соответствующем буфере (буфер указан в подписях под рисунками в изложении результатов). Молярное соотношение белка к красителю составляло 2:1. Интенсивность флуоресценции раствора регистрировали с помощью спектрофлуориметра PERKIN-ELMER - 44B при длине волны 488 нм и при длине волны возбуждения 420 нм. Ширина щели при возбуждении 5 нм, а при регистрации 10 нм. Из полученных значений интенсивности флуоресценции тиофлавина Т в буфере в присутствии белка вычитали значения интенсивности флуоресценции ТТ в буфере в отсутствие белка, получая интенсивность флуоресценции ТТ, связанного с белком.
3.7.3. Спектрофотометрический метод
Для подтверждения амилоидной природы фибрилл был также использован специфический краситель Конго красный (КК). Суспензию фибрилл (250 мкл) добавляли к раствору КК (250 мкл) в соответствующем буфере (буфер указан в подписях под рисунками в изложении результатов). Молярное соотношение белка к красителю составляло 2:1. Спектры поглощения КК в отсутствие и в присутствии белка регистрировали при 450–650 нм с помощью спектрофотометра SPECORD M 40.
III. Результаты и обсуждение
Глава 4. образование амилоидных фибрилл белками семейства тайтина
4.1. Электронно-микроскопическое изучение агрегационных свойств молекул тайтина, Х-белка, С-белка и Н-белка скелетных мышц кролика
Изучение амилоидогенеза разных белков in vitro проводят в условиях, которые часто не совместимы с условиями in vivo. Для образования амилоидных фибрилл белками семейства тайтина мы использовали условия, близкие к физиологическим. С помощью электронной микроскопии было показано, что исследуемые белки способны формировать разные амилоидные агрегаты, как и другие известные амилоидогенные белки (Chiti et al., 1999; Goldsbury et al., 2000; O'Nuallain et al., 2004; Uversky & Fink, 2004; см. рис. 5, 6).
Результаты электронно-микроскопических исследований представлены на рис. 9–14. Мы показали, что в растворе, содержащем 30 мМ KCl, 10 мМ имидазола, рН 7.0 Х-белок образует спирально скрученные ленточные фибриллы с осевой периодичностью ~60–70 нм, шириной ~40 нм и длиной более 1 мкм (рис. 9 А). Мы обнаружили, что такие же структуры Х-белок образует и в растворе, содержащем 0.15 М глицин-КОН, рН 7.5 (рис. 9 Б). Кроме этого Х-белок, а также С-белок и Н-белок образуют аморфные агрегаты, протофибриллы, линейные фибриллы и пучки линейных фибрилл в растворах: 50 мM NaCl, 10 мM Hepes, pH 7.0; 25 мМ NaCI, 10 мМ Hepes, pH 7.0; 50 мM MgCl2, 10 мM имидазола, pH 7.0; 30 мМ MgCI2, 10 мМ имидазола, pH 7.0; 0.15 М глицин-KOH, рН 7.5 (рис. 10–13).
На рис. 14 представлены электронные микрофотографии пучка линейных фибрилл тайтина скелетных мышц кролика в растворе 0.15 М глицин-KOH, рН 7.5. В этих условиях тайтин образует плотные пучки линейных фибрилл длиной ~3 мкм, шириной до 500 нм и аморфные агрегаты. Мы наблюдали, что аморфные агрегаты, протофибриллы длиной 100–200 нм и диаметром ~3 нм, линейные фибриллы диаметром ~7 нм и пучки линейных фибрилл длиной более 3 мкм и шириной до 500 нм могут присутствовать в одном и том же образце. Это, по-видимому, отражает разные стадии фибриллогенеза, характерные для формирования амилоидов (Kelly, 1998; Chiti et al., 1999; Goldsbury et al., 2000).
Для подтверждения амилоидной природы фибрилл тайтина, Х-белка, С-белка и Н-белка наши дальнейшие исследования были направлены на сравнение агрегатов, образуемых белками семейства тайтина, с агрегатами известных амилоидогенных белков и, в частности, Аβ-пептида, играющего важную роль в патогенезе болезни Альцгеймера.
4.2. Электронно-микроскопическое изучение агрегационных свойств Аβ(25-35)-пептида в сравнении с агрегацией молекул Х-белка
Для сравнения спирально скрученных фибрилл Х-белка с другими амилоидными фибриллами мы изучили агрегационные свойства Аβ(25-35)-пептида. Мы показали, что Аβ(25-35)-пептид, инкубированный в течение 24 ч при 37˚С образует подобно Х-белку (рис. 15 А) спирально скрученные ленты несколько микрон длиной и диаметром 25–27 нм с вариабельным осевым периодом 170–250 нм (рис. 15 Б, В).
Ленты построены из нескольких длинных и узких фибрилл диаметром 3–5 нм. На микрофотографиях они лучше видны, если смотреть вдоль ленты. Обнаруживаются также листовые агрегаты (рис. 15 Г), сформированные за счет боковой агрегации более коротких узких фибрилл. Такие агрегаты достигают в ширину ~50 нм. Таким образом, с помощью электронной микроскопии нами было установлено морфологическое сходство фибрилл Х-белка с амилоидами Aβ-пептида, найденными в мозге при болезни Альцгеймера.
4.3. Подтверждение амилоидной природы агрегатов, образуемых белками семейства тайтина (тайтина, Х-белка, С-белка и Н-белка) при их взаимодействии со специфическими красителями на амилоиды
Конго красным и тиофлавином Т
Основным методом выявления амилоидной природы фибрилл, образуемых разными белками, является их способность взаимодействовать со специфическими красителями Конго красным и тиофлавином Т (Klunk et al., 1989; LeVine, 1993, 1995; Krebs et al., 2005). Именно эти красители используют в клинической практике для определения амилоидных отложений in vivo и для исследования амилоидогенеза in vitro разными белками.
При окрашивании Конго красным фибриллярных структур, формируемых исследуемыми белками, мы наблюдали двойное лучепреломление в поляризационном микроскопе, а при окрашивании их тиофлавином Т – желто-зеленую флуоресценцию в люминесцентном микроскопе. На рис. 16 представлены данные связывания Х-фибрилл, сформированных в растворе, содержащем 30 мМ KCl, 10 мМ имидазола, рН 7.0, с красителями Конго красным и тиофлавином Т.
При спектральных исследованиях интенсивность флуоресценции тиофлавина Т в присутствии фибрилл Х-, Н- и С-белков и тайтина возрастала в ~10, ~9, ~7 и ~5 раз соответственно по сравнению с интенсивностью флуоресценции красителя в присутствии этих белков в молекулярной форме (рис. 17). Незначительное увеличение интенсивности флуоресценции тиофлавина Т наблюдается и в присутствии молекулярных форм тайтина, Х-, С- и Н-белков, что согласуется с литературными данными для белков, содержащих β-складчатую структуру (LeVine, 1993; 1995).
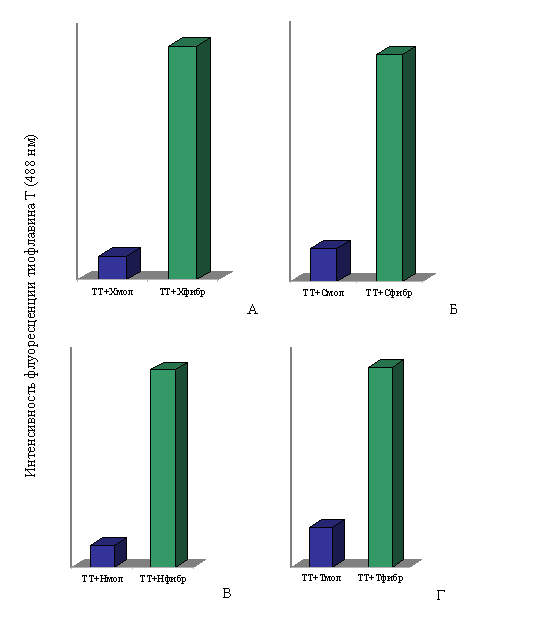
Рис. 17. Интенсивность флуоресценции тиофлавина Т (TT): А – в присутствии молекулярного X-белка (в растворе, содержащем 0.3 M KCl, 10 мМ К-фосфат, рН 7.0) и в присутствии фибрилл X-белка (0.15 М глицин-KOH, рН 7.5); Б – в присутствии молекулярного С-белка (0.3 M KCl, 10 мМ К-фосфат, рН 7.0) и в присутствии фибрилл С-белка (0.15 М глицин-KOH, рН 7.5); В – в присутствии молекулярного Н-белка (0.3 M KCl, 10 мМ К-фосфат, рН 7.0) и в присутствии фибрилл Н-белка (0.15 М глицин-KOH, рН 7.5); Г – в присутствии молекулярного тайтина (0.6 М KCl, 30 мМ KH2PO4, рН 7,0) и в присутствии фибрилл тайтина (0.15 М глицин-KOH, рН 7.5). Молярное соотношение красителя и белка 1:2.
При измерении спектральных характеристик раствора Конго красного в присутствии фибрилл тайтина, Х-, С- и Н-белков наблюдался сдвиг спектра поглощения красителя в длинноволновую область от ~490 нм к ~500 нм (рис. 18), что также является характерной чертой при связывании амилоидных фибрилл с Конго красным (Klunk et al., 1989).
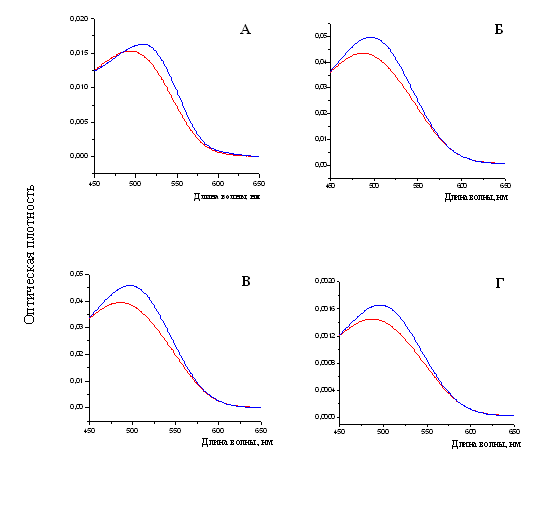
Рис. 18. Спектры поглощения свободного красителя показаны линиями красного цвета. Спектры поглощения красителя Конго красного (линия синего цвета): А – в присутствии фибрилл X-белка (в растворе, содержащем 0.15 М глицин-KOH, рН 7.5); Б – в присутствии фибрилл С-белка (0.15 М глицин-KOH, рН 7.5); В – в присутствии фибрилл Н-белка (0.15 М глицин-KOH, рН 7.5); Г – в присутствии фибрилл тайтина (0.15 М глицин-KOH, рН 7.5). Молярное соотношение красителя и белка 1:2.
Проведенные исследования указывают на специфичность связывания красителей с фибриллярными агрегатами, образуемыми белками семейства тайтина, подтверждая их амилоидную природу.
Похожие работы
... эффект ?-сон индуцирующего пептида при гипокинетическом стрессе // Укр.биохим.-1991.-63.-№1.-С.34-37. 118.Механизмы развития стресса // Сб.статей.- Кишинев: Штиинца.- 1987.-222с. 119.Митюшина Н.В. Влияние энкефалинов на активность ферментов обмена регуляторных пептидов в головном мозге и периферических тканях крыс // дис. на соиск. степени.канд.биол.наук.- Пенза.-1999 120.Наркевич В.Б. ...
... крови в мокроте больного в период стихания процесса не является противопоказанием к назначению массажа по предлагаемой методике. Продолжая поиски возможностей более эффективного применения массажа при этой патологии, О.Ф-.Кузнецов (1979, 1980) предложил для больных хронической пневмонией, бронхиальной астмой и хроническим бронхитом новую методику и обосновал ее большую эффективность при равнении ...
... , асцита, печеночной энцефалопатии). 5. Методом выбора при фульминантной форме ОАГ, а также у некоторых больных с алкогольным циррозом печени может быть трансплантация печени при условии минимум 6-месячной абстиненции [13]. 8. Клиническая фармакология гепатопротекторов В целом, ассортимент лекарственных средств, применяемых в комплексной терапии заболеваний печени и желчевыводящих путей, ...
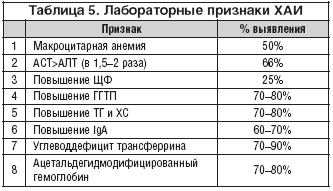
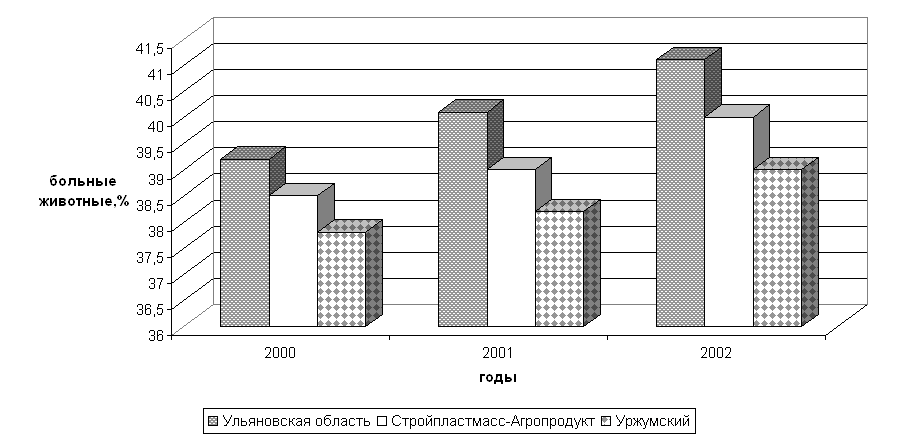
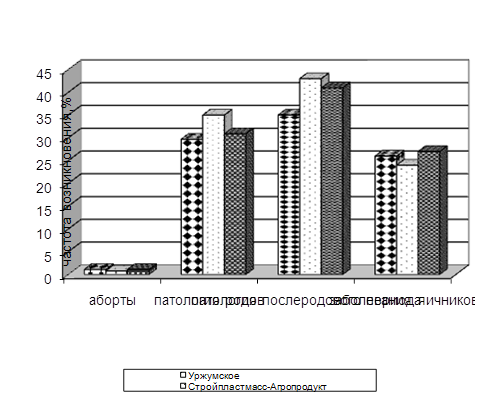
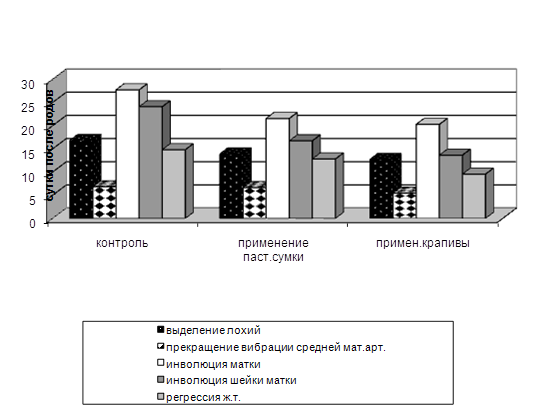
... изучить влияние вышеуказанных препаратов на морфологические, иммуно-биохимические и гемастазиологические параметры крови и течение послеродового периода высокопродуктивных молочных коров. 2.2.4 Профилактическая эффективность фитопрепаратов при патологии послеродового периода у высокопродуктивных молочных коров Патология родов и послеродового периода у коров широко распространена в молочном ...


0 комментариев