Навигация
Выделение тайтина из скелетных мышц
3.2.2. Выделение тайтина из скелетных мышц
Тайтин из скелетных мышц кролика выделяли по методу (Soteriou et al., 1993) с модификациями. Мышцы гомогенизировали в 3-х кратном (по отношению к массе мышц) объеме раствора, содержащего 50 мМ KCl, 5 мM ЭГТА, 1 мM NaHCO3,, 1 мM ДТТ, 0.1 мM NaN3, pH 7.0. Для уменьшения деградации тайтина в процессе выделения в раствор добавляли набор ингибиторов протеаз: 1 мM PMSF, 20 мкг/мл ингибитора трипсина, 10 мкг/мл леупептина.
Полученный мышечный гомогенат центрифугировали в течение 5–10 минут при 2500 g. Супернатант отбрасывали, а процедуру промывки повторяли 5–6 раз. К промытому осадку добавляли 2-х кратный объем экстрагирующего раствора, содержащего 0.9 М KCl, 2 мM MgCl2, 2 мM ЭГТА, 0.5 мM ДТТ, 0.1 мM NaN3, 1 мM PMSF, 10 мM имидазола-HCl, pH 7.0. Раствор также содержал 40 мкг/мл соевого ингибитора трипсина и 20 мкг/мл леупептина.
Экстракция проводилась на льду при 4˚С в течение 10–15 минут при непрерывном перемешивании. Экстракт осветляли в течение 40 минут при 14000 g и супернатант разбавляли в 3 раза охлажденной бидистиллированной водой, содержащей 0.1 мM ДТТ и 0.1 мM NaN3, для преципитации актомиозина (конечная ионная сила ~0.2). Через 1 час супернатант осветляли в течение 60 минут при 20000g. Для осаждения тайтина супернатант разбавляли в 5 раз (конечная ионная сила ~0.05) охлажденной бидистиллированной водой, содержащей 0.1 мM ДТТ и 0.1 мM NaN3. Через 40–60 минут осадок, содержащий преимущественно тайтин, собирали центрифугированием в течение 30 минут при 15000 g. Осадок растворяли в минимальном объеме буфера, содержащего 0.6 М KCl, 30 мM KH2PO4, 1 мM ЭГТА, 0.1 мM ДТТ, 0.1 мM NaN3, pH 7.0, и осветляли в течение 60 минут при 20000 g. Тайтин очищали методом гель-фильтрации на колонке с носителем Sepharose–CL2B, уравновешенным в этом же буфере.
3.3. Определение концентрации белковых препаратов
Концентрацию белков определяли спектрофотометрически с помощью спектрофотометра SPECOD UV VIS, используя следующие значения коэффициентов экстинции (Е2801 мг/мл): 0.543 для доколоночного миозина (Kielley & Harrington, 1960); 0.52 для колоночного миозина (Godfrey & Harrington, 1970); 1.08 для актина (Rees & Young, 1967); 1.37 для тайтина (Trinick et al., 1984); 1.09 для Х-белка, С-белка и Н-белка (Starr & Offer, 1982).
3.4. Проверка чистоты белковых препаратов
Чистоту выделенных препаратов миозина и актина скелетных мышц кролика проверяли с помощью ДСН-гель-электрофореза в 13% полиакриламидном геле по методу (Laemmli, 1970).
Чистоту тайтина, Х-белка, С-белка и Н-белка проверяли с помощью ДСН-гель-электрофореза по методу (Fritz et al., 1989) с модификациями. Согласно нашей методике, разделяющий гель содержал 7% полиакриламида вместо 15%, а также 0.75 М трис-HCl буфер, pH 8.8, 0.1% ДСН, 10% глицерина, 0.05% тетраметилэтилендиамина и 0.05% персульфата аммония. Кроме этого, вместо концентрирующего геля с содержанием полиакриламида 5% согласно (Fritz et al., 1989) применялся концентрирующий гель по методу (Laemmli et al., 1970), содержащий 2.6–2.8% полиакриламида (соотношение акриламида к бис-акриламиду 36.5:1). Эти модификации способствовали лучшему фокусированию белковых полос в геле. Концентрирующий гель также содержал 0.125 М трис-HCl буфер, pH 6.8, 0.1% ДСН, 0.05% тетраметилэтилендиамина и 0.05% персульфата аммония. Модифицированный нами метод ДСН-гель-электрофореза позволил проводить электрофоретическое разделение белков с молекулярным весом от 3 МДа до 100 кДа, что дало возможность исследовать совместное поведение тайтина, Х-белка, С-белка и Н-белка.
Электродный буфер при проведении электрофореза содержал 0.192 М глицина, 0.025 М трис и 0.1% ДСН, рН 8.3. Электрофорез проводили при токе 3–5 мА первые 30–60 минут, после этого поднимали напряжение до 12–15 мА. По окончании электрофореза гели фиксировали в растворе, содержащем 10% этанола и 10% уксусной кислоты, в течение 20–30 минут. Затем гели окрашивали в течение 30–40 минут в растворе, содержащем 0.1% кумасси G-250 и R-250 (смешанных в пропорции 1:1), 45% этанола и 10% уксусной кислоты. Отмывка окрашенных гелей проводилась в 7% уксусной кислоте при постоянном перемешивании на качалке в течение 40–50 мин.
3.5. Условия формирования амилоидных фибрилл
Амилоиды формировали диализом растворов белков в течение 20 часов при 4-37°С против растворов, содержащих: 30 мМ KCl, 10 мМ имидазола, рН 7.0; 0.15 М глицин-КОН, рН 7.0; 0.15 М глицин-KOH, рН 7.5; 25 мМ NaCI, 10 мМ Hepes, pH 7.0; 50 мM NaCl, 10 мM Hepes, pH 7.0; 30 мМ MgCI2, 10 мМ имидазола, pH 7.0; 50 мM MgCl2, 10 мM имидазола, pH 7.0.
Для исследования скорости амилоидообразования раствор Х-белка диализовали против буфера, содержащего 30 мМ KCl, 10 мМ имидазола, рН 7.0 при температуре 4˚С. Через определенные промежутки времени отбирали пробы для электронно-микроскопических и спектральных исследований. Для экспериментов по исследованию цитотоксичности амилоидных образований Х-белок также инкубировали в растворе, содержащем 30 мМ KCl, 10 мМ имидазола, рН 7.0 при температуре 4˚С.
3.6. Микроскопические исследования
3.6.1 Электронная микроскопия
Для приготовления электронно-микроскопических образцов использовали препараты белков с концентрациями 0.1 мг/мл. Каплю раствора или суспензии белка наносили на медные сетки, покрытые коллодиевой пленкой (2% коллодий в амилацетате фирмы SPI-CHEM, USA), укрепленной углеродом. После удаления избытка суспензии полоской фильтровальной бумаги образцы окрашивали 2% водным раствором уранилацетата.
Электронно-микроскопические исследования проводили на микроскопе JEM-100В при ускоряющем напряжении 80 кВ и увеличении 30000х. Увеличение микроскопа было тестировано по паракристаллам парамиозина с периодичностью 14.5 нм.
3.6.2. Поляризационная и флуоресцентная микроскопия
Исследуемые образцы, наносились на предметные стекла и высушивались на воздухе. Образовавшиеся белковые пленки окрашивались 1% водным раствором Конго красного (фирма SIGMA, USA) и затем исследовались на поляризационном микроскопе МКУ-1. Образцы также окрашивались 1% водным раствором тиофлавина Т (фирма SIGMA, USA) и исследовались с помощью люминесцентного микроскопа ЛЮМАМ-И 3.
3.7. Спектральные методы
3.7.1. Метод кругового дихроизма
Исследование вторичной структуры белка проводили методом кругового дихроизма. Спектры кругового дихроизма исследуемых белков, до и после образования ими фибрилл, регистрировали на спектрополяриметре Jasco J-600, используя кварцевые кюветы с оптической длиной 0.1 см. Спектры КД были измерены в области 200–250 нм. Обсчет спектров КД в далекой ультрафиолетовой области производился с использованием программы CONTINLL (http://lamar.colostate.edu/~sreeram/CDPro/).
Похожие работы
... эффект ?-сон индуцирующего пептида при гипокинетическом стрессе // Укр.биохим.-1991.-63.-№1.-С.34-37. 118.Механизмы развития стресса // Сб.статей.- Кишинев: Штиинца.- 1987.-222с. 119.Митюшина Н.В. Влияние энкефалинов на активность ферментов обмена регуляторных пептидов в головном мозге и периферических тканях крыс // дис. на соиск. степени.канд.биол.наук.- Пенза.-1999 120.Наркевич В.Б. ...
... крови в мокроте больного в период стихания процесса не является противопоказанием к назначению массажа по предлагаемой методике. Продолжая поиски возможностей более эффективного применения массажа при этой патологии, О.Ф-.Кузнецов (1979, 1980) предложил для больных хронической пневмонией, бронхиальной астмой и хроническим бронхитом новую методику и обосновал ее большую эффективность при равнении ...
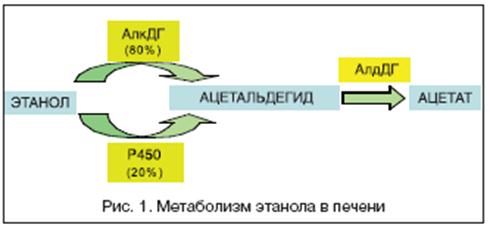
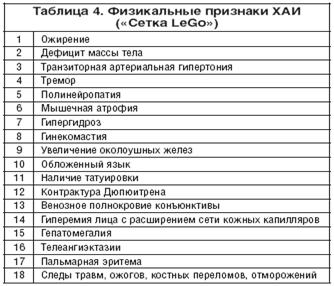
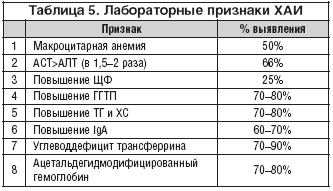
... , асцита, печеночной энцефалопатии). 5. Методом выбора при фульминантной форме ОАГ, а также у некоторых больных с алкогольным циррозом печени может быть трансплантация печени при условии минимум 6-месячной абстиненции [13]. 8. Клиническая фармакология гепатопротекторов В целом, ассортимент лекарственных средств, применяемых в комплексной терапии заболеваний печени и желчевыводящих путей, ...
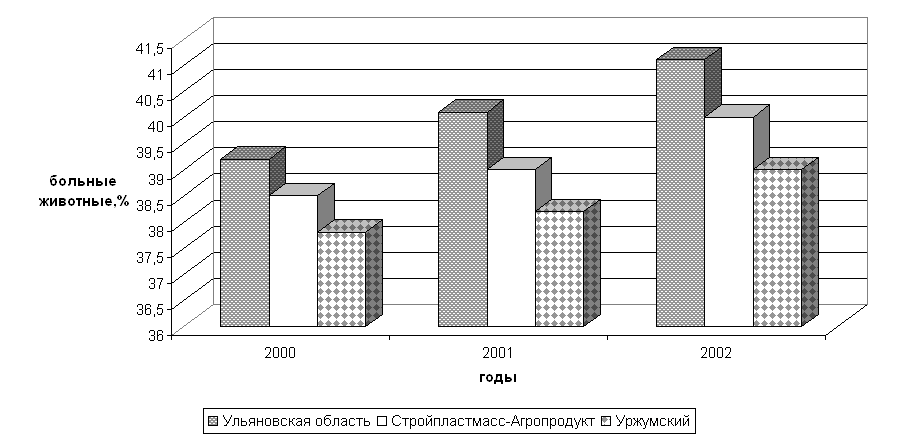
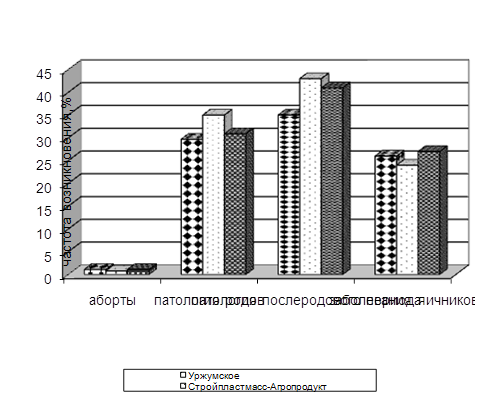
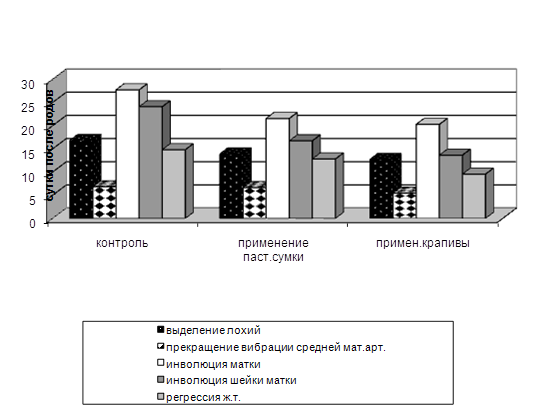
... изучить влияние вышеуказанных препаратов на морфологические, иммуно-биохимические и гемастазиологические параметры крови и течение послеродового периода высокопродуктивных молочных коров. 2.2.4 Профилактическая эффективность фитопрепаратов при патологии послеродового периода у высокопродуктивных молочных коров Патология родов и послеродового периода у коров широко распространена в молочном ...


0 комментариев