Навигация
Работа аппарата в режиме УИВЛ
1 Работа аппарата в режиме УИВЛ
1.1 Работа аппарата в режиме УИВЛ с нулевым давлением конца выдоха.
ЭМК 3.7 открыт постоянно. ЭМК 3.4 в открытом положении сообщает при вдохе легкие пациента с генератором вдоха 2. ЭМК 3.10 в открытом положении сообщает при выдохе легкие пациента с атмосферой. ЭМК 3.7 и самодействующий клапан 3.6 обеспечивает возможность дополнительного вдоха пациента непосредственно из блока подачи кислорода 1, минуя генератор вдоха 2. Во время вдоха газовая дыхательная смесь из мешка 1.5 блока подачи кислорода 1 засасывается воздуходувкой 2.2 генератора вдоха 2, нагнетается в линию вдоха блока пациента и через дроссель-регулятор 3.3, открытый ЭМК 3.4, увлажнитель 5, отстойник 8. шланг вдоха 9 и тройник пациента 10 вдувается в легкие пациента. Избыток газовой смеси из линии нагнетения воздуходувки 2.2 сбрасывается через стабилизатор 2.1 в линию всасывания. Переключение аппарата с вдоха на выдох происходит по времени (по частоте). При этом ЭМК 3.4 закрывается, ЭМК 3.10 открывается, происходит выдох. Пациент через тройник 10, шланг выдоха 11, отстойник 13, самодействующий клапан 3.9, ЭМК 3.10, клапан УДВ 3.12 и клапан 16.3 выдыхает в атмосферу.
2. Работа аппарата в режиме УИВЛ с ПДКВ.
В момент выдоха, когда давление в дыхательном контуре равно установленному ПДКВ; ЭР 3.14 соединяет мембранную камеру управления клапана УДВ 3.12 через ЭР 3.13 и фильтр 3.1 с линией нагнетания генератора вдоха 2. Постоянный дроссель 3.15 на входе ЭР 3.14 обеспечивает поступление в линию управления клапана УДВ 3.12 заданного расхода газа из линии нагнетания генератора вдоха 2 и клапан УДВ 3.12 закрывается. Выдох прекращается,
3. Работа аппарата в режиме УИВЛ с паузой вдоха.
В момент вдоха, когда оставшееся до конца вдоха время равно установленной паузе, ЭМК 3.4 закрывается, и вдувание прекращается. ЭНК 3.4 остается также закрытым до истечения времени вдоха, определяемого установленной частотой вентиляции и долей вдоха от времени цикла. По истечении времени вдоха ЭМК 3.10 открывается и происходит выдох.
4. Работа аппарата в режиме УИВЛ с АВ.
В фазе выдоха ЭМК 3.7 закрыт, сжатый газ от внешнего источника питания под давлением 400 кПа (4 кгс/см2) через обратный клапан 3.18, ЭР 16.4 и эжектор 16.2 истекает в атмосферу. При этом создается разрежение в линии выдоха, под действием которого газ отсасывается из дыхательных путей пациента, одновременно разрежение через ЭР 3.14 и 3.13 поступает в камеру управления клапана УДВ 3.12 и поддерживает его в открытом состоянии. Изменение значения разрежения осуществляется поворотом рукоятки регулятора 16.1. Обратный клапан 16.3 осуществляет быстрый сброс давления в дыхательном контуре в начале фазы выдоха.
5. Работа аппарата в режиме УИВЛ с ограничением максимального давления конца вдоха.
В момент вдоха, когда давление в дыхательном контуре становится равным заданному значению Рмакс. ЭМК 3.4 закрывается. ЭМК 3.10 продолжает быть закрытым, и вдувание прекращается до истечения заданного времени вдоха, определяемого установленной частотой вентиляции и долей длительности вдоха в дыхательном цикле.
6. Работа аппарата в режиме УИВЛ с помощью пульта дистанционного управления (ПДУ).
При проведении ИВЛ с помощью ПДУ нажатие и удержание клавиши ПДУ переводит аппарат в состояние выдоха. ЭМК 3.4 закрыт, ЭМК 3.10 открыт. Дополнительное нажатие кнопки ПДУ вызывает на время ее нажатия переключение аппарата в фазу вдоха; ЭМК 3.4 открыт, ЭМК 3.10 закрыт. Как только оператор выпускает ПДУ из рук (отпуская тем самым клавишу), аппарат включается в автоматический режим.
7. Работа аппарата в режиме УИВЛ с распылением аэрозоле лекарственных средств. В фазе выдоха сжатый газ под давлением 40 кПа (4 кгс/см2) поступает на вход регулятора 3.21, с выхода которого сжатый газ под давлением 140 кПа (1,4 кгс/см2) через ЭР 3.22 поступает на вход распылителя 6. Аэрозоль распыляется со шланга вдоха 9. В фазе вдоха аэрозоль из шланга вдоха 9 выносится потоком дыхательного газа в легкие пациента через тройник 10.
Работа аппарата в режиме ВИВЛЭМК 3.7 закрыт постоянно. В момент конца выдоха ЭМК 3.4 закрыт, ЭМК 3.10 открыт. При попытке вдоха пациент создает разрежение в линии, ограниченной с одной стороны клапаном 3.9, а с другой – закрытыми ЭМК 3.4 и 3.7. Созданное разрежение через фильтр 3.5 поступает в электропневмопреобразователь 7.2 блока управления 7 и далее на преобразователь деления 7.3. В блоке управления 7 происходит сравнение создаваемого пациентом разрежения с заданным. Когда разрежение в линии становится равным заданному, происходит переключение аппарата в положение вдоха. При этом ЭМК 3.4 открывается, ЭМК 3.10 закрывается. Переключение с вдоха на выдох происходит по давлению. Когда давление в легких достигает заданного значения (сравнение производится в блоке управления 7), ЭМК 3.4 закрывается, ЭМК 3.10 открывается, происходит выдох и аппарат остается в положении выдоха до поступления попытки вдоха или до окончания установленного времени ожидания попытки. Если в течение 3 сек давление конца вдоха не станет равным заданному, переключение на выдох произойдет автоматически по времени. Такое явление может произойти при неправильном назначении скорости вдувания Q (недостаточном) или при разгерметизации линии пациента. При ВИВЛ также возможно осуществить режим дыхания с ПДКВ. При этом коммутация линии выдоха осуществляется так же, как и при УИВЛ. А разрежение попытки вдоха отсчитывается от уровня давления конца выдоха. При ВИВЛ также возможно распыление аэрозоля лекарственных средств. Оно осуществляется в шланг вдоха 9 во время фазы вдоха.
Работа аппарата в режиме СППВПри СППВ периодически перемежаются два режима вентиляции: самостоятельное дыхание и один цикл ВИВЛ. Генератор вдоха 2 работает. В фазе самостоятельного дыхания ЭМК 3.4, 3.7 и 3.10 открыты. Если самостоятельное дыхание проводится без повышения уровня давления выше атмосферного, то УР 3.13 и 3.14 соединяют камеру управления клапана УДВ 3.12 через клапан 16.3 с атмосферой. Дроссель-регулятор вентиляции 3.3 перекрыт ИД 3.12. Поток из линии нагнетания генератора вдоха 2 через стабилизатор 2.1 сбрасывается в линию всасывания генератора вдоха 2. Пациент через клапан 3.6, ЭМК 3.7 и клапан 3.17 делает вдох из мешка 1.5 блока додачи кислорода 1 и выдыхает через клапан 3.9, ЭМК 3.10, клапан УДВ 5.12 и клапан 16.3 в атмосферу. Если самостоятельное дыхание ведется под постоянным положительным давлением, то нажатием кнопки «Установка величины потока G» воздействуют на ШД 3.2, и он открывает дроссель-регулятор вентиляции 3.3. В дыхательный контур поступает постоянный поток газа с генератора вдоха 2, камера управляющего клапана УДВ 3.12 через 3.13, 3.14. Фильтр 3.1 соединяется с линией нагнетания генератора вдоха 2, а через ЭР 3.11 с предохранительным клапаном 3.6 и регулятором давления 7.1, поворотом рукоятки регулятора 7.1 на его мембране формируется усилие, обеспечивающее большую или меньшую степень стравливания газа из камеры управления клапана УДВ 3.12 и соответственно уровень давления в ней. Это давление определяет уровень ПДКВ, который составляет при СДПД амплитуду колебаний давления. Средний уровень давления зависит от значения скорости потока 9. Предохранительный клапан 3.8 срабатывает в случае, если уровень давления в дыхательной контуре превышает 4 кПа (400 мм вод. ст). Таким образом, даже при установке (ошибочно) чрезмерных значений G, при которых уровень давления может стать опасным, обеспечивается безопасность пациента. По истечении заданного времени L, в течение которого пациент дышит самостоятельно, аппарат переключается, в положение ожидания попытки вдоха. При этом ЭМК 3.4 и 3.7 закрываются, ЭМК 3.10 остаются открытыми. ШД 3.2 переводит дроссель-регулятор 3.3 в положение, соответствующее установленной скорости вдувания Q. Переключение на выдох происходит либо по достижении заданного давления, либо по истечении 3 сек. При этом ЭНК 3.4 закрывается, ЭНК 3.10 открывается. Если в интервале L было установлено G=0, то ЭР 3.13 остается в положении УИВЛ. ЭР 3.11 закрывается, а ЭР 3.14 в конце вдоха соединяет камеру управления клапана УДВ 3.12 с линией нагнетания генератора вдоха 2, так что в цикле ВИВЛ сохраняется ПДКВ, заданное при самостоятельном дыхании. Если же в L интервале имело место G=0, то ЭР 3.11 остается закрытым, ЭР 3.14 перекрывает линию из генератора вдоха 3 и соединяет камеру управления клапана УДВ 3.12 через клапан 16.3 с атмосферой. Переключение на самостоятельное дыхание после цикла ВИВЛ происходит через 2 с после окончания вдоха. При этом ЭМК открываются, а ЭР переходит в положение, соответствующее выбранному уровню давления, как описано выше. В режиме СППВ возможно распыление аэрозоля лекарственных средств. При этом ЭР 3.22 соединяет распылитель с источником питания на все время самостоятельного дыхания и в фазе вдоха цикла ВИВЛ.
Работа аппарата в режиме СДПД
В режиме СДПД схема работает так же, как в фазе СДПД в режиме СППВ. Возможно одновременное проведение распыления лекарственных средств, которое производится в этом режиме непрерывно.
Работа аппарата в режиме САМД
При самостоятельном дыхании САДМ генератор вдоха 2 не работает, ЭМК 3.4, 3,7, 3.10 открыты. Пациент вдыхает свежую смесь из мешка 1.5 блока подачи кислорода 1 через самодействующие клапаны 3.17, 3.6 и ЭМК 3.7. Коммутация пациента с линиями вдоха и выдоха в соответствующих фазах дыхательного цикла происходит с помощью самодействующих клапанов 3.6 и 3.9.
При ИВЛ вручную (ВР) (мешком 17) клапан 3.17 обеспечивает заполнение мешка свежей смесью из блока подачи кислорода 1 при его расправлении и предотврашает обратный сброс смеси в блок подачи кислорода 1 при сжатии мешка. Клапан УДВ 3.12 управляется пневматически от мешка 17 и обеспечивает перекрытие линии выдоха при сжатии мешка 17, то есть во время вдоха, и сообщение легких пациента с атмосферой при расправлении мешка 17 во время выдоха. ЭР 3.13 сообщает камеру управление клапана УДВ 3.12 с мешком 17 через бактериальный фильтр 3.16, что предотвращает инфицирование ЭР 3.13.
Описание структурной схемы (рис. 1.2.3) системы управления
Все функции управления аппаратом осуществляет ОМК. Сопроцессор ОМК обеспечивает постоянное сканирование клавиатуры и через основной процессор производит настройку на режимы, задаваемые оператором. Типы режимов, задаваемые параметры и информация о давлении в дыхательном контуре отображаются на двух газоразрядных индикаторах также через сопроцессор ОМК. На один из индикаторов выводятся цифровые значения, задаваемые или вычисленные, на другой – в виде столбиков переменной длины выводится текущее давление в дыхательном контуре и его различные установки. Для быстрой визуализации изменяющегося давления основной процессор ОМК через БИС параллельного ввода / вывода с частотой порядка 100 Гц запускает АЦП, считывает и обрабатывает результаты замера и передает информацию сопроцессору. Через эту же БИС осуществляется управление ЭМК и ЩД 6 в блоке пациента. Системное время ОМК (порядка 10 м с) задается таймером через один из входов контролера прерываний. Другой вход внешнего прерывания используется для дистанционного управления ЭМК вдоха и выдоха вручную. Микроконтроллер (рис. 4) (ОМК) представляет собой плату, на которой размещены два микропроцессора: основной типа КР5800ВМ30Л и сопроцессор типа КР1816ВЕ35 и ряд других БИС. Основной процессор обеспечивает основные функции вычисления и управления, а сопроцессор – обслуживание дисплея и клавиатуры. Память основного процессора составляет 16 кбайт, а сопроцессора – 2 кбайта, основной процессор дополнен двумя БИС параллельного ввода / вывода (частично одно из них используется для связи двух процессоров), БИС последовательного интерфейса контроллера прерываний, двумя программируемыми таймерами, а также оперативной памятью 2 кбайта и схемами интерфейсов системной шины И 4.1. Сопроцессор дополнен экспандером параллельного интерфейса.
1.3 Медико-биологические аспекты 1.3.1 Влияние ИВЛ на некоторые функции организмаИскусственной вентиляцией легких называют обеспечение газообмена между окружающим воздухом (или специально подобранной смесью газов) и альвеолярным пространством легких искусственным способом.
Основным и, пожалуй, единственным методом ИВЛ в настоящее время является метод вдувания газа в дыхательные пути. При этом либо в последние вводится определенный объем газовой смеси, либо она вдувается в легкие в течение определенного времени с заданной скоростью, либо подается до тех пор, пока давление в системе больной – респиратор не повысится до определенного уровня. В любом случае ИВЛ заменяет (протезирует) естественный акт внешнего дыхания путем создания положительного давления в начале дыхательных путей.
В комплексе интенсивной терапии основными задачами ИВЛ являются обеспечение адекватного газообмена в легких и освобождение больного от работы дыхания. Ликвидируя гипоксемию, а иногда и гиперкапнию, искусственное дыхание предотвращает развитие в органах необратимых изменений. Вторая задача не менее важна, чем первая, хотя не всегда учитывается в клинической практике. При ряде патологических процессов, особенно при нарушении проходимости дыхательных путей, резко возрастает «энергетическая цена» дыхания. Здоровый организм расходует на работу дыхательных мышц 1 –3% потребляемого кислорода. Включение ряда компенсаторных механизмов может увеличивать этот расход до 35 –50% от Vо2 [Долина О.А., 1975; Bjork V. О. et al» 1964; Marini J.J. et al., 1985]. ИВЛ, снимая нагрузку с дыхательной мускулатуры, освобождает больного от непосильной для него в данный момент работы и способствует перераспределению кислорода в организме, улучшает оксигенацию жизненно важных органов [Неговский В.А., 1971].
Однако наряду с несомненным благоприятным влиянием на жизнедеятельность организма ИВЛ может оказать побочное отрицательное действие. Начиная с конца 40-х годов изучению этих вредных эффектов посвящаются многочисленные исследования. Все же многие вопросы остаются спорными и не до конца решенными.
1.3.2 Влияние ИВЛ на гемодинамикуЛучше всего изучены гемодинамические эффекты ИВЛ. Известно, что внутригрудная гемодинамика во многом зависит от дыхательного цикла. При спонтанном дыхании во время вдоха давление в плевральных полостях снижается до –10 см вод. ст. При этом происходит «присасывание» крови к правому предсердию из полых вен, а также снижается давление в легочных капиллярах, что облегчает приток крови в систему малого круга кровообращения (рис. 1.3.1, а). В норме кровоток в легком во время выдоха составляет 6%, а во время вдоха – 9% от объема циркулирующей крови [Watrous W.G. et al., 1950]. В результате во время вдоха увеличивается систолический выброс (ударный объем) сердца (УОС).
При ИВЛ во время вдувания газовой смеси в трахею внутрилегочное давление повышается до 15 –20 см вод. ст. (иногда выше), а внутриплевральное до 5 –10 см вод. ст. Это приводит к уменьшению притока крови к правому предсердию (рис. 1.3.1, б). Раздуваемые изнутри альвеолы передавливают легочные капилляры, повышается давление в артериях малого круга кровообращения и ухудшается приток крови к легким из правого желудочка. Вследствие этого во время искусственного вдоха снижается УОС [Дворецкий Д.П. и др., 1984, и др.].
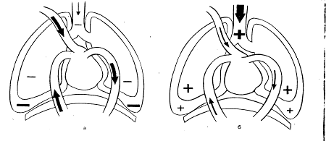
Рис. 1.3.1 Давление в дыхательных путях, альвеолах и плевральных полостях во время спонтанного (а) и искусственного (б) вдоха.
Компенсация снижения венозного притока к сердцу осуществляется за счет повышения периферического венозного давления, что приводит к уменьшению физиологического градиента давлений между артериолами и венулами [Astrup P., Neykirch A., 1959]. В результате в паренхиматозных органах может наступить уравновешивание этих давлений, ведущее к капиллягжому стазу и снижению продукции альбуминов в печени. Это в свою очередь вызывает падение онкотического давления плазмы, выход жидкости из капилляров в ткани, сгущение и увеличение вязкости крови, отечность тканей и азотемию.
Многими авторами показано, что отрицательное влияние ИВЛ на внутригрудную гемодинамику зависит от объема циркулирующей крови. При гиповолемии оно проявляется намного сильнее. Большое значение имеет также максимальное и среднее давление в трахее, создающееся при искусственном дыхании. С. A. Hubay (1955), J. С, Рагker и соавт. (1984) в эксперименте показали, что при максимальном давлении 50 см вод. ст. и среднем давлении 6,5 мм вод. ст. блокируется легочное кровообращение и резко повышается проницаемость капиллярной стенки.
Средним давлением называют отношение интегралов кривой давления вдоха и кривой давления выдоха в пределах дыхательного цикла. Среднее давление может быть определено и без графической регистрации – по показаниям сильно демпфированного манометра.
Общепринятым является мнение, что уменьшение вредного влияния ИВЛ на гемодинамику может быть достигнуто путем снижения среднего давления, для чего предложен ряд методов. В первую очередь это укорочение, фазы вдоха [Максимов Б.П., 1978; Berneus В., Carlston A., 1955, и др.]. Рекомендуется проводить ИВЛ при соотношении вдох: выдох не более 1: 1,5. Другим методом является активный выдох [Maloney J.V., Handford S.W., 1954, и др,]. Считается, что включение субатмосферного давления увеличивает венозный возврат к сердцу на 33% (а при сниженном объеме циркулирующей крови – на 100%), уменьшает отек мозга при его травмах и заболеваниях. По мнению ряда авторов, активный выдох особенно необходим у больных с гиповолемией и сердечной недостаточностью, у детей и при хронических заболеваниях легких, сопровождающихся снижением бронхиальной проходимости. В противовес этим представлениям многие исследователи показали, что отрицательное давление во время выдоха не улучшает гемодинамику и отрицательно сказывается на газообмене в легких и их механических свойствах.
С целью снижения среднего давления С.Т. Gray (I960) предложил проводить ИВЛ малыми дыхательными объемами, но с большей частотой (40–60 циклов в минуту). Этот метод нашел сторонников [Малышев В.Д., 1967, и др.], но в настоящее, время применяется крайне редко. В.С. Гигаури (1966) и Т.М. Дарбиняном (1966) предложен метод асинхронного дыхания, т.е. попеременного вдувания воздуха в левое и правое легкое для снижения среднего давления. Указанный метод не нашел распространения, хотя отечественной промышленностью некоторое время выпускался специально предназначенный для этой цели респиратор.
Остановимся на принципиальном отношении к вопросу о влиянии ИВЛ на гемодинамику. Хотя, как сказано выше, практически все авторы находили ту или иную, степень вредного воздействия искусственного дыхания на внутри грудное кровообращение, заметим, что подавляющее большинство исследовании сделано в эксперименте или во время общей анестезии у больных с нормальными легкими. С другой стороны, многолетний клинический опыт показывает, что на практике вредное влияние ИВЛ можно обнаружить и крайне редко. Более того, применение ИВЛ в режиме ПДКВ, при котором внутрилегочное давление повышается до значительного уровня, у большинства больных с острой дыхательной недостаточностью приводит не к снижению, а к увеличению сердечного выброса.
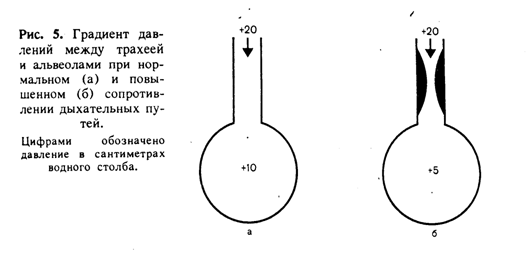
По нашим наблюдениям, даже очень высокое давление в трахее (60–70 см вод. ст.) во время искусственного вдоха у больных со сниженной бронхиальной проходимостью не оказывало сколько-нибудь заметного влияния на, гемодинамику [Кассиль В.Л., 1974, и др.]. Как было показано ранее [Кассиль В.Л., Рябова Н.М., 1977], при высоком сопротивлении дыхательных путей градиент давлений между трахеей и альвеолами (рис. 5) значительно увеличивается. Причина этого явления – увеличение постоянной времени (τ), которая равна произведению растяжимости легких на сопротивление дыхательных путей (С • R). Примерно 95% от давления, создаваемого в трахее, передается в альвеолы за время, равное Зτ [Nor-lander О. R., 1964, и др.]. При увеличении постоянной времени за счет возрастания R выравнивание давления между трахеей и альвеолами происходит гораздо медленней, чем у здорового человека.
Пример. Если С = 0,25 л/см вод. ст., а R = 5 см вод. ст./ (л • с-1), то τ = 0,25 • 5 = 1,25 с. При частоте дыхания 18 в минуту и соотношении вдох: выдох 1:2 продолжительностью вдоха (Твд) равна 1,1 с. Тогда в конце фазы вдоха давление в альвеолах:
Ра= (95%·Твд (с)) /Зτ (с) = (95·1,1) /3,75 = 27,9% от давления, созданного в конце вдоха в трахее.
Если же R возрастает вдвое, то постоянная времени соответственно увеличивается до 2,5 с. Тогда при тех же условиях:
Р А1 = (95·1,1) /7,5=13,9% от давления, созданного в трахее.
В этих условиях даже существенное повышение трахеального давления не сопровождается выраженным нарастанием давления в альвеолах. Этим можно объяснить крайне редкое проявление вредного влияния ИВЛ на кровообращение при острой дыхательной недостаточности, которая почти всегда сопровождается нарушением бронхиальной проходимости.
В связи с изложенным широко распространенное в литературе мнение относительно существенного вредного воздействия повышенного трахеального давления при ИВЛ на гемодинамику представляется нам обоснованным главным образом для анестезиологической практики, где у большинства больных нет выраженных острых изменений в легких. При интенсивной терапии тяжелобольных со значительными изменениями механических свойств легких эти опасения, на наш взгляд, во многом преувеличены. По нашему мнению, стремление к обязательному снижению среднего давления в течение дыхательного цикла, которое считается более физиологичным, далеко не всегда целесообразно. Исключение составляют больные с выраженной гиповолемией.
1.3.3 Влияние ИВЛ на функции легкихМногими авторами показано, что при ИВЛ появляется несоответствие между распределением воздуха и кровотока в легких [Зильбер А.П., 1971, 1978; Дворецкий Д.П., 1984; Rehder К. et al., 1972, и др.]. В результате этого увеличивается физиологическое мертвое пространство и шунтирование крови справа налево, повышается альвеолоартериальный градиент по кислороду. Нарушения вентиляционно-перфузионных отношений усиливаются с увеличением скорости газового потока (более 0,4 л/с) и частоты дыхания. Монотонный дыхательный объем способствует поступлению воздуха в одни и те же наиболее растяжимые участки легких. Возрастает опасность баротравмы альвеол. В менее растяжимых, участках отмечается склонность к ателектазированию.
По-видимому, ИВЛ значительно изменяет нормальное движение воздуха в легких. Согласно математической модели Шика–Сидоренко (рис. 1.3.3, а), при спокойном вдохе конвекционное движение воздуха по дыхательным путям замедляется по мере разветвления бронхиального дерева и на уровне кондуктивной зоны прекращается. В бронхиолах и альвеолах перемешивание воздуха осуществляется только за счет диффузии газов – броуновского движения молекул. В связи с большей скоростью газового потока при ИВЛ должны происходить смещение зоны конвекционного движения в сторону альвеол и уменьшение зоны диффузионного газообмена (рис. 1.3.3, б). Кроме того, при самостоятельном дыхании в большей степени вентилируются периферические участки легких, которые прилегают к движущейся диафрагме и грудной стенке. При ИВЛ, наоборот, наибольшая вентиляция происходит в перибронхиальных и медиастинальных участках, где в первую очередь создается положительное давление во время искусственного вдоха.
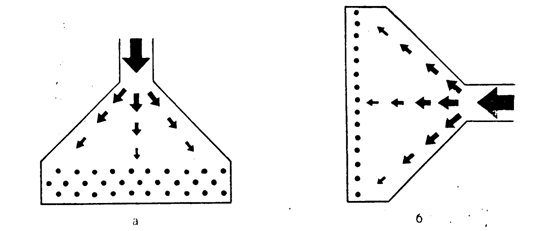
Рис. 1.3.3
С конца 40-х годов в литературе дискутируется вопрос: влияет ли на газообмен и гемодинамику форма кривых давления и газового потока? В 1947 г. A. Cournand и соавт. предложили свою «идеальную кривую давления», a J. Stoffregen (1956) – «улучшенную идеальную кривую
Для обеих характерно быстрое снижение давления в дыхательных путях после конца вдоха. А.С. Сметнев и В.М. Юревич (1984) также считают, что выдох должен начинаться немедленно после конца вдоха и положительное давление в легкие необходимо поддерживать только во время введения в легкие требуемого дыхательного объема. Считается, что это уменьшает вредное влияние ИВЛ на гемодинамику.
С. G. Engstrom и О.Р. Norlander (1962) теоретически обосновали другую форму кривой, на которой имеется плато – статическая фаза после окончания вдоха и перед началом выдоха. По их мнению, такая инспираторная пауза способствует наилучшему распределению воздуха внутри легких.
Ряд авторов считают, что вентиляционно-перфузионные отношения в легких улучшаются, если скорость газового потока нарастает к концу вдоха [Гейронимус Т.В., 1975; Максимов Б.П., 1978; Engstrom С. G., 1963; Johansson N., 1975, и др.]. С другой стороны имеются данные, говорящие в пользу постоянной [Гальперин Ю.С., 1972; Burchardi H., 1974] или даже снижающейся [Baker A.A. et al., 1977; Brychta О. et al., 1980; Danzmann E. et al., 1980; Al-Saady N., Bennett E., 1985; Felton C.R. et al., 1984] скорости потока во время вдоха. Наконец, имеются серьезные сомнения в том, что форма кривых давления и скорости в дыхательных путях оказывает существенное влияние на газообмен в легких [Кассиль В.Л., 1981; Fuleihan S.F. et al., 1976, и др.].
Существуют также разногласия по вопросу о воздействии различных соотношений времени вдоха и выдоха на распределение воздуха в легких и отношение мертвого пространства к дыхательному объему.
Большинство исследователей считают, что ИВЛ значительно ухудшает механические свойства легких: их эластическое и аэродинамическое сопротивление вдоху возрастает. Увеличению последнего способствует турбулентность газового потока при ИВЛ. Что касается снижения растяжимости легких, то механизм его не совсем ясен, так как показано, что оно наступает буквально через несколько минут после начала ИВЛ [Mundeleer P., 1978].
Все же нам кажется, что влияние ИВЛ на газообмен и механику дыхания зависит прежде всего от исходного состояния легких и всего аппарата внешнего дыхания. Если вентиляционно-перфузионные отношения в легких до ИВЛ не были нарушены, то искусственное дыхание может существенно изменять их в отрицательную сторону. Но если ИВЛ начинают при острой дыхательной недостаточности, при которой обязательно нарушается отношение Уа/Qт, то результат скорее всего оказывается обратным. Увеличивая число вентилируемых альвеол, ИВЛ способствует уменьшению шунтирования крови в легких, снижая тем самым D (А-а) о2. В том, что это происходит, сомнений нет, так как нередко ИВЛ начинают при D (А-а) о2 более 450 мм рт. ст. в условиях самостоятельного дыхания 100% кислородом (FIО2=1,0). При этом PaО2 после начала ИВЛ, как правило, увеличивается, т.е. альвеолярно-артериальный градиент по кислороду значительно снижается. При этом сдвиг вентиляционно-перфузионных отношений в сторону увеличения Vа происходит не за счет дополнительных энергозатрат больного; наоборот, работа дыхания у него практически сводится к нулю.
То же можно сказать об увеличении отношения VD/Vт. В условиях самостоятельного дыхания увеличение физиологического мертвого пространства снижает эффективность вентиляции легких и требует от больного дополнительных затрат энергии на работу дыхания. При ИВЛ эту работу выполняет респиратор, а увеличивая дыхательный объем, легко можно уменьшить VD/VT до нормальной величины, т.е. обеспечить необходимый уровень альвеолярной вентиляции.
Более существенное значение, на наш взгляд, имеет неравномерность вентиляции в плане опасности баротравмы и ателектазирования отдельных участков легких. Этот неблагоприятный эффект ИВЛ должен быть по мере возможности устранен.
В последние годы большое внимание уделяется влиянию ИВЛ на недыхательные функции легких. Установлено, что искусственное дыхание неблагоприятно сказывается на дренажной функции трахеобронхиального дерева. В связи с выключением нормального кашлевого механизма после интубации трахеи или трахеостомии кашель либо отсутствует, либо становится неэффективным даже при хорошей функции экспираторных мышц и достаточном резервном объеме вдоха. Поступление в дыхательные, пути недостаточно согретого и увлажненного воздуха, повышенное содержание кислорода в газовой смеси нарушают работу ресничек бронхиального эпителия и местный иммунитет дыхательной системы [Можаев Г.А., Носов В.В., 1985; Bilnenstock J., 1980, и др.]. Задержка, бронхиального секрета, изменение его реологических свойств вызывают резкое падение коллатеральной вентиляции – закрываются поры Кона. Вследствие лимфостаза происходит сужение мелких бронхов и бронхиол. Указанные изменения приводят к нарушению механических свойств легких, в первую очередь – к повышению сопротивления дыхательных путей. Обеспечение полноценного дренирования трахеобронхиального дерева – одна из первоочередных задач при проведении длительной ИВЛ.
Большое значение имеет влияние ИВЛ на распределение воды в легких. Необходимо напомнить некоторые сведения из физиологии.
Согласно современным представлениям, перемещение воды из внутрисосудистого в интерстициальное пространство и обратно зависит от перепада между гидродинамическим давлением внутри капилляра и гидростатическим вне его, а также от градиента коллоидно-осмотических давлений между плазмой и интерстициальной жидкостью. По закону Старлинга поток жидкости (Q) выражается следующим уравнением:
Q = Кф[(Рвс – Рпв) –σ (Пвс-Ппв)],
где Кф – коэффициент фильтрации; σ – коэффициент отражения для белков; Рвс – внутрисосудистое гидродинамическое давление; Рпв – периваскулярное гидростатическое давление; Пвс – коллоидно-осмотическое давление плазмы (внутрисосудистое); Ппв – коллоидно-осмотическое давление интерстициальной жидкости (периваскулярное).
В легких Рпв соответствует альвеолярному давлению (РА) и, так же как Рвс, меняется в течение дыхательного цикла.
В артериальной части капилляра, где гидродинамическое давление преобладает над периваскулярным гидростатическим и коллоидно-осмотическим, жидкость фильтруется в интерстиций (рис. 1.3.4). В венозной части, где периваскулярное коллоидно-осмотическое давление выше гидродинамического, происходит резорбция жидкости. Та часть жидкости, которая не подверглась резорбции, удаляется с лимфой.
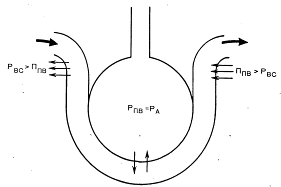
Рис. 1.3.4
Однако взаимоотношения между РА, давлением в артериальном (Ра) и венозном (Pv) участках капилляра зависят от положения различных участков легкого по, отношению к сердцу. Согласно J. В. West (1974) и G.Y. Gibson (1984), при вертикальном положении тела в легких можно различать четыре зоны, определяемые гравитационным фактором (рис. 1.3.5).
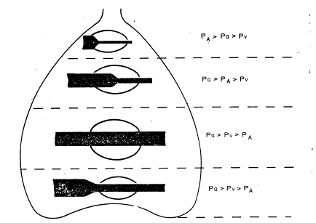
В верхней зоне (верхушки легких) среднее альвеолярное давление во время дыхательного цикла преобладает над артериальным, которое в свою очередь выше венозного:
РА > Ра > Pv.
Здесь в норме легочный кровоток осуществляется только во время вдоха, когда РА становится ниже атмосферного.
В средней зоне артериальное давление становится выше альвеолярного, но последнее преобладает над венозным или равно ему:
Pa > РА > Pv.
Здесь легочный кровоток осуществляется не за счет разницы (Ра – Pv), а благодаря градиенту (Ра – Рд).
В третьей зоне среднее альвеолярное давление в течение дыхательного цикла ниже артериального и венозного:
Ра > Pv > РА.
Именно здесь легочное кровообращение осуществляется с наибольшей интенсивностью.
Наконец, в четвертой зоне (базальные отделы легких) существуют те же отношения:
Ра > Pv >РА,
но перфузия снова снижается из-за местного увеличения интерстициального давления на прекапиллярные сосуды.
Следовательно, в нижних зонах легких Рвс всегда выше Рпв (поскольку Рпв = РА) и фильтрация жидкости происходит наиболее интенсивно. Нижние отделы легких, составляющие всего 25 –30% их общей массы, продуцируют около 50% лимфы, оттекающей по правому лимфатическому протоку [Dembling R.N., 1975].
ИВЛ, существенно изменяя регионарные взаимоотношения между альвеолярным, артериальным и венозным давлением [Зильбер А.П., 1978] (рис. 1.3.6), в значительной степени нарушает процесс обмена воды в легких. А.В. Бобриков и соавт. (1981) показали в эксперименте, что постоянное повышение внутрилегочного давления уже через 3 ч вызывает накопление жидкости в легких. При ИВЛ лимфоток из легких снижается [Caldini P., Leitz DJ., 1975; Schad H. et al., 1978, и др.].
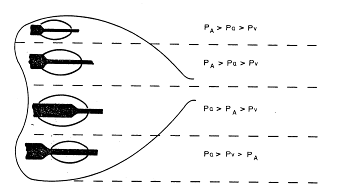
Рис. 1.3.6
Повышенное внутригрудное давление сдавливает правый лимфатический проток, затрудняя отток лимфы из легких. Кроме того, при высоком альвеолярном давлении во время искусственного выдоха может наступить сдавление легочных капилляров. Это значительно усиливает процесс фильтрации воды из артериальной части капилляра в интерстиций, особенно из экстраальвеолярных сосудов, где давление выше, чем в легочных капиллярах. Указанные процессы могут привести к образованию периваскулярных скоплений жидкости в виде муфт, окружающих капилляры. Задержка воды в легких особенно выражена при увеличении РАсо. Гипокапния несколько уменьшает опасность развития интерстициального отека [Schad H. et al., 1978, и др.]. Наконец, в условиях длительной ИВЛ может возникать гипопротеинемия из-за недостаточного снабжения организма энергией и пластическим материалом (азот). Это приводит к снижению коллоидно-осмотического давления плазмы, в результате чего могут развиваться отеки как в ткани легких, так и на периферии.
Приведенные выше данные показывают значение своевременного устранения метаболических нарушений у тяжелобольного в процессе ИВЛ. Сегодня чаще всего бывает трудно диагностировать и устранить задержку воды в легких, но несомненно, что работа в этом направлении должна быть продолжена.
Неблагоприятное влияние длительной ИВЛ на легочное кровообращение и метаболизм может привести к снижению активности и продукции сурфактанта, чему способствуют еще два фактора: высокое FiО2, и увеличение продукции антиальвеол при их растяжении большими дыхательными объемами. При повышении поверхностного натяжения в альвеолах возрастает эластическое сопротивление дыханию [Зильбер А.П., 1978, и др.].
Однако нельзя согласиться с тем, что длительная ИВЛ всегда вызывает снижение растяжимости легких. Как было показано ранее [Кассиль В.Л., 1974], этот процесс зависит не столько от самой ИВЛ, сколько от состояния легких в процессе искусственного дыхания. При развитии бронхолегочных осложнений (трахеобронхит; пневмония, ателектазы и др.) растяжимость легких прогрессивно снижается. По мере улучшения состояния больного растяжимость, как правило, постепенно увеличивается, становясь выше, чем до начала ИВЛ [Кассиль В.Л., Рябова Н.М., 1977].
1.3.4 Влияние на некоторые другие функции организмаВ литературе описаны и другие неблагоприятные эффекты ИВЛ, в частности увеличение продукции антидиуретического гормона гипофизом, что приводит к повышению реабсорбции воды в канальцах почек и олигурии. Однако на практике мы никогда не наблюдали существенного отрицательного влияния ИВЛ на функцию почек. Наоборот, у больных с начинающейся почечной недостаточностью в результате длительной гипоксии, например при массивной кровопотере, экламптической коме, на фоне ИВЛ часто развивалась полиурия как фаза выхода из состояния почечной недостаточности. Факторами, способствующими восстановлению функции почек, являются устранение гипоксии, повышенного содержания катехол-аминов в крови и спазма артериол. Если у тяжелобольного возникла олигурия, то, как правило, это было вызвано какой-то другой причиной (интоксикация при перитоните, длительная гипотензия при травматическом шоке и т.д.).
Считается, что гипервентиляционный режим ИВЛ нарушает микроциркуляцию, вызывает сдвиг кривой диссоциации оксигемоглобина влево, что приводит к гипоксии тканей. Но это предположение также противоречит клинической практике. Применение ИВЛ у больных с острой дыхательной недостаточностью в значительной степени улучшает функцию паренхиматозных органов.
Проведение длительной ИВЛ может сопровождаться развитием ряда осложнений. Однако эти осложнения гораздо чаще возникают у больных, которым искусственное дыхание начинают слишком поздно, когда длительная гипоксия вызвала тяжелые, подчас неустранимые изменения в органах и тканях, а также при неправильном выборе параметров ИВЛ и плохом уходе за больным. Кроме того, ИВЛ является очень важным, но далеко не единственным методом лечения в системе интенсивной терапии. Нередко осложнения могут развиться из-за недостаточного питания больного, неправильного подбора антибактериальной терапии, несвоевременного устранения волемических и метаболических нарушений.
В табл. 1.3.1 представлены сводные данные о влиянии ИВЛ на некоторые функции организма в зависимости от условий, в которых она применяется.
| Функция организма | При кратковремен – ной ИВЛ и здоровых легких в условиях наркоза | При длительной ИВЛ в условиях острой дыхательной недостаточности |
| Сердечный выброс | Может уменьшать- ся, особенно при гиповолемии | Не изменяется или увеличивается |
| Равномерность вентиляции легких | Ухудшается | Улучшается |
| Внутри легочный шнур справа на лево | Увеличивается | Уменьшается |
| D (А-а)О2 | Увеличивается | Уменьшается |
| VD / VТ | Увеличивается, но это не имеет большого значения | |
| Механические свойства легких | Ухудшаются | Могут улучшаться по мере ликвидации патологических процессов в легких |
| Дренажная функция дыхательных путей | Существенно не нарушается | Нарушается |
| Распределение воды в легких | Не нарушается (не успевает) | Нарушается |
| Периферическая микро циркуляция | Может ухудшаться | Улучшается |
ИВЛ не является полноценной заменой нормального самостоятельного дыхания. С точки зрения физиологии последнее всегда лучше. Однако возникает вопрос: нормальное или нарушенное самостоятельное дыхание? Если оно нормальное и не требует от больного чрезмерных энергозатрат, тогда это положение вполне справедливо. Другое дело, когда собственное дыхание больного нарушено, когда оно не способно обеспечить организм необходимым ему в данный момент количеством кислорода, поддержать Расо2, на оптимальном в данный момент уровне, осуществляется с большим расходом энергии. При таких обстоятельствах ИВЛ становится абсолютно необходимой и польза от нее значительно превышает вредные эффекты.
Общепринято мнение, что следует выбирать наиболее «физиологичные» параметры искусственного дыхания, т.е. наиболее приближающиеся к параметрам спонтанного дыхания у здорового человека. Последняя рекомендация, может быть и справедливая для условий анестезии, когда ИВЛ чаще всего проводят человеку без дыхательных нарушений, на наш взгляд, не подходит к условиям интенсивной терапии. Мы уже упоминали, что большая часть данных о вредных эффектах ИВЛ получена в эксперименте или в наблюдениях за людьми со здоровыми легкими. Однако то, что плохо для здорового организма, может оказаться весьма полезным для больного. Как показано ниже, некоторые неблагоприятные эффекты ИВЛ, например повышенное внутри легочное давление, с успехом используются в лечебных целях. Некоторые «антифизиологичные» режимы ИВЛ оказывают благоприятное воздействие на гемодинамику и вентиляционно-перфузорные отношения в легких, если в результате тяжелого заболевания или травмы эти процессы оказались грубо нарушенными. На наш взгляд, следует стремиться не к «физиологичности» ИВЛ, ориентируясь при этом на нормальные константы здорового человека, а к соответствию параметров искусственного дыхания потребностям больного в каждый момент.
Однако в намерения автора вовсе не входит убеждать читателя, что неблагоприятными эффектами ИВЛ можно пренебрегать. Наоборот, как показано выше, надо не только помнить о них, но и применять ряд профилактических мероприятий, способствующих устранению их опасных последствий. Четкое представление о патофизиологии ИВЛ наряду со строгим учетом клинических данных позволяет значительно повысить эффективность искусственного дыхания и избежать тяжелых осложнений.
1.3.5 Общие показания к ИВЛНесмотря на многочисленные работы, посвященные показаниям к ИВЛ при интенсивной терапии и многолетнее изучение вопроса, его нельзя признать окончательно решенным. Этот вопрос первостепенной важности, так как от своевременности начала во многом зависит эффективность искусственного дыхания. Одна из самых частых ошибок при лечении больных с острой дыхательной недостаточностью – позднее начало ИВЛ.
Ретроспективный анализ показывает, что среди наиболее тяжелого контингента больных с острой дыхательной недостаточностью (массивная кровопотеря, разлитой перитонит, послеродовая эклампсическая кома, критическая черепно-мозговая травма, тяжелая множественная травма, множественный перелом ребер, механическая асфиксия), которым потребовалось длительное проведение ИВЛ, летальность составляла в среднем 55,2%. Но если ИВЛ начинали в пределах первых 3 ч от момента появления дыхательной недостаточности, то летальность равнялась 37,1%, в промежутке от 3 до б ч – 52,5%, позже 6 ч – 80,6% [Кассиль В.Л., 1981]. Однако общеизвестно, что далеко не каждый больной с признаками дыхательной недостаточности нуждается в ИВЛ. Установление точных критериев, позволяющих начать искусственное дыхание своевременно, когда оно становится действительно необходимым, имеет большое практическое значение. Это позволит избежать фатальной потери времени, когда все лечебные мероприятия делаются малоэффективными или бесполезными из-за развития необратимых процессов в органах и тканях вследствие длительной гипоксии.
Показания к ИВЛ следует устанавливать с учетом характера основного патологического процесса, вызвавшего дыхательную недостаточность, патогенеза последней и индивидуальных особенностей больного. Больные различного возраста, с разными заболеваниями и травмами неодинаково переносят гипоксию (и гиперкапнию), по-разному реагируют на нее и имеют неодинаковые компенсаторные возможности. Так, сопротивление дыхательных путей может быть значительно увеличено у больных с хроническими обструктивными заболеваниями легких, но им далеко не всегда показана ИВЛ. У ряда больных с преобладанием рестриктивных процессов и хронически сниженной растяжимостью легких, уменьшенной альвеолярном вентиляцией, постоянно сохраняется гиперкапния. Это само по себе тоже не свидетельствует о необходимости применять ИВЛ во всех случаях. Следовательно, существуют частные показания к искусственному дыханию.
Здесь мы остановимся на общих показаниях к ИВЛ, которые можно условно разделить на две группы: чисто клинические и выявляемые инструментальными методами исследования.
1.3.6 Клинические показания к ИВЛВ экстренных ситуациях, когда тяжесть состояния больного или отсутствие необходимого оснащения делают невозможным его детальное обследование, показаниями к ИВЛ являются:
1) отсутствие самостоятельного дыхания (апноэ);
2) остро развившиеся нарушения ритма дыхания, патологические ритмы, дыхание агонального типа;
3) учащение дыхания более 40 в минуту, если это не связано с гипертермией (температура тела выше 38,5 °С) или выраженной не устраненной гиповолемией;
4) клинические проявления нарастающей гипоксемии и (или) гиперкапнии, если они не исчезают после проведения консервативных мероприятий: обезболивания, восстановления проходимости дыхательных путей, кислородной терапии, ликвидации опасного для жизни уровня гиповолемии и грубых нарушений метаболизма.
Первые два пункта представляют собой абсолютные показания к ИВЛ (естественно, речь не идет о больных с инкурабельными злокачественными процессами). Остро возникшие нарушения ритма дыхания – свидетельство глубоких нарушений центральной регуляции дыхания. Исключение составляют больные с диффузным атеросклеротическим поражением головного мозга и сердечной недостаточностью. У них нередко возникает дыхание типа Чейна – Стокса, которые удается ликвидировать фармакологическими препаратами.
Учащение дыхания – показание относительное. Цифра 40 является условной, но все же ее можно считать рубежом, после которого может легко наступить декомпенсация самостоятельного дыхания. Тахипноэ приводит к нарушению распределения воздуха в легких и значительному возрастанию отношения VD/VТ, требует большого расхода энергии, истощает силы больного. Если после снижения температуры тела, восстановления объема Циркулирующей крови, устранения грубых нарушений метаболизма тахипноэ сохраняется, а тем более имеет место тенденция к его нарастанию, то необходима ИВЛ, тем более что произвести коррекцию метаболических нарушений в условиях сохраняющейся или углубляющейся гипоксии чаще всего не удается.
Наконец, клинические признаки нарастающей дыхательной недостаточности мы считаем одним из наиболее важных критериев. Динамическое наблюдение позволяет выявить и оценить степень выраженности основных симптомов. Особое значение мы придаем нарушениям психики и сознания, которые свидетельствуют о гипоксической энцефалопатии.
В некоторых наблюдениях эти симптомы могут регрессировать после проведения полноценного обезболивания, восстановления проходимости дыхательных путей, ингаляций кислорода. Но если клиника гипоксии быстро нарастает, то ждать эффекта от консервативных мероприятий не следует, показана ИВЛ.
1.3.7 Показания к ИВЛ на основании данных инструментального исследованияНекоторые авторы считают основным для установления показаний к ИВЛ изучение КОС и газов крови. При этом приводятся величины параметров в весьма широком диапазоне. Так, считается необходимым начинать ИВЛ, если РаО2, снижается до 70–60 мм рт. ст., а РаО2 повышается до 55 –80 мм рт. ст. [Гологорский В.А., 1972; Гейро-нимус Т.В., 1975; Зильбер А.П., 1978; Глумчер Ф. С» 1985; Norlander О., 1968, и др.]. Расхождение в цифрах объясняется разным контингентом больных, находившихся под наблюдением различных исследователей, и неодинаковыми условиями обследования (в первую очередь – при каком FiО2, определяли РаО2). Отметим также, что гиперкапния при острой дыхательной недостаточности развивается достаточно редко, в основном при выраженной обструкции дыхательных путей, сдавлении легкого, нарушениях функций дыхательных мышц. Кроме того, присоединение к гипоксии гиперкапнии свидетельствует о далеко зашедшей дыхательной недостаточности.
По нашему мнению, однократное исследование газов крови вообще мало информативно, если результаты его не сопоставляются с клиническими данными. Кроме того, выраженное снижение Рао, особенно в условиях оксигенотерапии, – поздний признак, свидетельствующий о наступившей декомпенсации. Мы полностью согласны с Н.М. Рябовой (1974), что начинать ИВЛ надо в стадии максимального напряжения компенсаторных механизмов, когда Рао, остается на достаточно высоком уровне и отмечается нарастающая гипокапния или нормокапния на фоне резкого увеличения МОД. Мы не можем согласиться с мнением А.С. Сметнева и В.М. Юревича (1984), что главным (если не единственным) показанием к ИВЛ является «абсолютная» гиповентиляция с повышением РаСО2.
Ряд исследователей справедливо полагает, что показания к ИВЛ должны быть основаны в первую очередь на изучении функционального состояния аппарата внешнего дыхания и его резервных возможностей. Большое значение имеет также энергетическая цена дыхания, т.е. то, какую работу затрачивает организм больного для обеспечения адекватной альвеолярной вентиляции. Считается, что работа дыхания более 1,8 кгм/мин [Peters R. М. et al., 1972] или 3 кгм/мин [Зильбер А.П., 1984] быстро приводит к декомпенсации вентиляторного аппарата. Как видит читатель, здесь также имеется значительное расхождение в цифрах. Кроме того, определение величины работы дыхания является сложной и не всегда доступной задачей. Более просто определить максимальное разрежение, которое способен создать больной при попытке вдоха из замкнутой маски. Если разрежение меньше –25 см вод. ст., то показана ИВЛ. [Гёйронимус Т.В., 1975].
При исследовании функции и механики дыхания информативными тестами являются ЖЕЛ (менее 10 – 15 см3/ кг) и объем форсированного выдоха (менее 10 см3/кг). ИВЛ считается также показанной при снижении растяжимости легких ниже 0,06 л/см вод. ст., сопротивлении дыхательных путей выше 13 –14 см вод. ст./ / (л* с-1) и отношении VD/VТ более 0,6.
Исключительно большое значение придают альвеолярно-артериальному градиенту по кислороду в условиях дыхания 100% кислородом. Увеличение D (А – а)О2, более чем до 350 –450 мм рт. ст. (снова расхождение в цифрах!) является показанием к ИВЛ.
Необходимо еще раз подчеркнуть, что, на наш взгляд, первостепенное значение имеют клинические данные. Если состояние больного позволяет выжидать, а не требует экстренных мероприятий, то ориентироваться следует не столько на абсолютные величины результатов инструментального обследования больного, сколько на их динамику, сопоставляя ее с развитием клиники. Ниже мы приводим общие показания к ИВЛ на основании различных источников и результатов собственных наблюдений.
| Характер дыхания | Апноэ, нарушения ритма дыхания |
| Частота дыхания | Более 40 в минуту |
| Другие клинические признаки | Спутанность сознания, повышенная влажность кожных покровов, цианоз, стойкая тахикардия |
| МОД | Прогрессирующее увеличение |
| ЖЕЛ | Прогрессирующее снижение до 12см3/кг |
| Объем форсированного выдоха | Ниже 10 см3 /кг |
| Разрешение при вдохе из замкнутой маски | Менее – 25 см вод. ст. |
| Растяжимость легких | Менее 0,06 л/см вод. ст. |
| Сопротивление дыхательных путей | Более 13 см вод. ст./(л*с-1) |
| VD/VТ | Более 0,6 |
| РаО2 | Прогрессирующее снижение ниже 70 мм рт. ст., если это сочетается с клиническим проявлением гипоксии |
| РаСО2 | Прогрессирующее снижение ниже 25 мм рт. ст. |
| D (A – а) О2 | Более 400 мм рт. ст. |
Показания к ИВЛ могут возникнуть как при постепенном нарастании, так и при быстром развитии дыхательной недостаточности. В первом случае вопрос о применении респиратора решается на основании совокупности данных, в том числе ряде объективных тестов. Последние играют очень важную роль и позволяют судить, продолжать ли консервативную терапию, или начинать ИВЛ. Однако переоценивать их значение не следует.
Мы не можем согласиться с категорическим утверждением Т.С. Гейронимуса (1975), что, не зная газов крови, ни начинать, ни проводить ИВЛ невозможно. Ситуации, в которых приходится лечить больного с острой дыхательной недостаточностью, весьма различны. Очень многое зависит от опыта и знаний врача, его умения правильно оценивать состояние больного, вовремя распознать и интерпретировать клинические симптомы. Но даже если врач и считает, что ИВЛ показана, он должен реально оценить возможность обеспечить наблюдение и уход за больным. После интубации трахеи или трахеостомии судьба больного во многом зависит от квалификации и добросовестности всего персонала. Если он не имеет достаточного опыта, а показания к ИВЛ относительны, то лучше усилить консервативную терапию. Если же ИВЛ безусловно необходима, следует подумать, не целесообразнее ли перевести больного в другое лечебное учреждение.
Необходимо сделать одно замечание. Нам не раз приходилось присутствовать при весьма эмоциональных спорах (и принимать участие в них) о том, надо ли начинать ИВЛ? Обычно эти дискуссии возникают между реанима-тологами и врачами других специальностей (хирурги, терапевты, инфекционисты и др.), но нередко и среди специалистов в области интенсивной терапии. Считаем, что последнее слово всегда должно оставаться за реаниматологом, если он обладает достаточной квалификацией и способен взять на себя ответственность за принятие решения. Какими бы высокими званиями ни обладали представители других специальностей и администрации лечебных учреждений, они не должны считать себя компетентными в таком сложном вопросе, как проведение ИВЛ.
1.4 Вывод уравнения движения следящей системыВ данном разделе проводится вывод уравнения движения электропривода асинхронного электродвигателя, находящегося в генераторе вдоха. Для более точной работы двигателя, на его выходном валу был установлен тахогенератор, в результате чего получилась следящая система.
Дифференциальное уравнение системы может быть найдено из уравнений ее элементов путем их совместного решения.
Прежде всего запишем уравнения отдельных элементов системы. Для элемента сравнения справедливо соотношение
q=aвх – aвых, (1.4.1)
где q – рассогласование, снимаемое с элемента сравнения;
aвх и aвых – соответственно углы поворота входного и выходного валов системы.
Для преобразователя запишем уравнение
Uq=knq, (1.4.2)
где Uq – измеритель рассогласования (потенциометры);
kn – коэффициент пропорциональности, характеризующий крутизну характеристики Uq=f(q) преобразователя.
Коэффициент пропорциональности можно выразить как kn=Uq/q и измерять в вольтах на градус. Таким образом, этот коэффициент показывает, какое напряжение сигнала ошибки приходится на единицу угла рассогласования.
Для тахогенератора
Um=km![]() ; (1.4.3)
; (1.4.3)
Для усилителя
Ua=kyUвх, (1.4.4)
где Uа – выходное напряжение усилителя, поступающее в цепь якоря исполнительного двигателя;
ky – коэффициент усиления усилителя по напряжению;
Uвх= Uq – Um; (1.4.5)
Для того чтобы вывести дифференциальное уравнение двигателя, рассмотрим протекающие в нем процессы, принимая следующие допущения:
- внутреннее сопротивление выходного каскада усилителя равно нулю;
- коэффициент самоиндукции цепи равен нулю;
- Реакция якоря отсутствует.
Уравнение равновесия э.д.с. для цепи якоря двигателя имеет следующий вид:
Ua=IaRa+Ea, (1.4.6)
где Ua – приложенное к цепи якоря напряжение;
Ia– ток якоря;
Ra – сопротивление якоря;
Ea– противо-э.д.с., возникающая в обмотке якоря при вращении.
На основании закона Фарадея получим
Ea=keФW, (1.4.7)
где ke – коэффициент пропорциональности, характеризующий конструкцию электродвигателя;
Ф – поток возбуждения;
W – скорость вращения ротора.
Подставив (2.4.7) в (2.4.6), получим
Ua=IaRa+ keФW, (1.4.8)
Запишем уравнение равновесия моментов электродвигателя
Мвр=Мст+Мдин, (1.49)
Электромагнитный вращающий момент двигателя Мвр может быть выражен как
Мвр=kмФIa, (1.4.10)
где kм – коэффициент пропорциональности, характеризующий магнитную проводимость магнитопровода электродвигателя.
Статический момент Мст, действующий на валу двигателя, можно представить как
Мст=Мхх+Мн, (1.4.11)
где Мхх – момент холостого хода;
Мн – момент создаваемый нагрузкой.
Динамический момент на валу двигателя Мдин имеет место при изменении скорости вращения и может быть выражен как
Мдин=J![]() , (1.4.12)
, (1.4.12)
где J – момент инерции вращающихся частей;
![]() – ускорение вращения.
– ускорение вращения.
Решим уравнение (2.4.8) относительно тока якоря Ia:
Ia=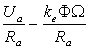 , (1.4.13)
, (1.4.13)
Подставив (2.4.13) в (2.4.10) получим:
Мвр=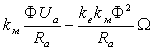 , (1.4.14)
, (1.4.14)
Полученное уравнение (2.4.14) называется уравнением механической характеристики электродвигателя, которая представляет собой зависимость W=f(М) между моментом на валу двигателя и скоростью его вращения.
Для построения механической характеристики найдем точки ее пересечения с осями координат. Если по оси абсцисс откладывать момент Мвр, а по оси ординат – скорость вращения W, то, учитывая, что уравнение (2.4.14) относительно интересующих нас значений Мвр и W является уравнением первой степени, можно представить механическую характеристику двигателя в виде прямой, пересекающей оси координат в двух точках.
Для нахождения точки пересечения характеристики с осью абсцисс положим
W=0. С учетом этого условия из уравнения (2.4.14) получим
Мвр=Мn=![]() , (1.4.15)
, (1.4.15)
где Мn – пусковой момент двигателя, т.е. момент вращения, развиваемый двигателем при пуске, когда W=0.
Для определения точки пересечения характеристики с осью ординат положим Мвр=0 и подставив это условие в уравнение (2.4.14), получим
0=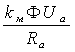 -
- 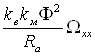 (1.4.16)
(1.4.16)
где Wхх – скорость холостого хода двигателя (при отсутствии нагрузки на его валу).
Решим уравнение (2.4.16) относительно скорости. Получим
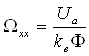 . (1.4.17)
. (1.4.17)
Построим по полученным точкам механическую характеристику двигателя.
Из приведенного графика, а также уравнений (2.4.14) и (2.4.15) вытекает следующее соотношение:
Мвр=Мn-FW, (1.4.18)
где F= называется коэффициентом вязкого трения двигателя и характеризует жесткость его механической характеристики.
называется коэффициентом вязкого трения двигателя и характеризует жесткость его механической характеристики.
Из выражения (2.4.15) можно получить следующее соотношение
![]() , (1.4.19)
, (1.4.19)
где 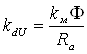 – коэффициент пропорциональности между пусковым моментом двигателя и приложенным к его якорю напряжением.
– коэффициент пропорциональности между пусковым моментом двигателя и приложенным к его якорю напряжением.
Из уравнений (2.4.4), (2.4.3) и (2.4.5) выразим входное напряжение усилителя следующим образом:
Uвх=knq-km![]() ,(1.4.20)
,(1.4.20)
тогда выходное напряжение усилителя
Ua=knkyq-kmky![]() , (1.4.21)
, (1.4.21)
при этом пусковой момент двигателя
Мn=knkykdUq – kmkykdU![]() , (1.4.22)
, (1.4.22)
где К0= knkykdU – передаточный коэффициент системы;
F1= kmkykdU – коэффициент успокоения, вносимого тахогенератором.
Получим
Мn=K0q – F1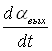 .(1.4.23)
.(1.4.23)
Подставив (2.4.24) в (2.4.18), получим
Мвр=К0q – F1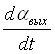 - F
- F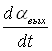
или
Мвр=К0q – (F+F1)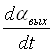 . (1.4.24)
. (1.4.24)
Уравнение равновесия моментов двигателя запишется в следующем виде:
К0q – (F+F1)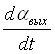 =
= 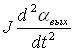 +Мст (1.4.25)
+Мст (1.4.25)
Производя замену aвых=aвх – q, получим
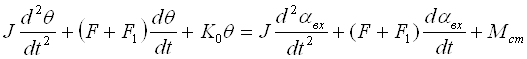
Это выражение представляет собой дифференциальное уравнение движения следящей системы с принимающим тахогенератором.
Важнейшим показателем, характеризующими поведение система, является ошибка слежения q. Получим выражения для статической и динамической установившихся ошибок.
Так как статическая ошибка qст оценивается по окончании движения, т.е. при неподвижных входном и выходном валах, примем ![]() . Из этого следует, что
. Из этого следует, что ![]() . А так как в состоянии покоя системы ее ошибка должна быть постоянна, то
. А так как в состоянии покоя системы ее ошибка должна быть постоянна, то![]() и
и ![]() .
.
Отсюда получим
К0qст=Мст(1.4.26)
откуда
qст=![]() . (1.4.27)
. (1.4.27)
Полагая, что входной и выходной валы движутся с одинаковой постоянной скоростью W=Wуст=const, примем 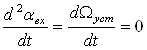 . А так как в установившемся режиме ошибка слежения постоянна, то
. А так как в установившемся режиме ошибка слежения постоянна, то ![]() и
и ![]() . Отсюда получим
. Отсюда получим
К0q=(F+F1)Wуст+Мст, (1.4.28)
но q=qст+ qdy. (1.4.29)
Следовательно,
К0(qст+qdy)=(F+F1)Wуст+Мст,(1.4.30)
отсюда
qст+qdy=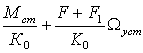 (1.4.31)
(1.4.31)
или, учитывая формулу (2.4.27),
qdy=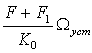 (1.4.32)
(1.4.32)
0 комментариев