Навигация
Электронная структура реагентов и продуктов реакции
1.3.2 Электронная структура реагентов и продуктов реакции
1.3.2.1. Электронная структура этилена
Главным структурным элементом, определяющим реакционную способность этилена, как и всех олефинов, является двойная связь, представляющая собой сочетание σ- и π-связей ( sp2 -гибридизация).
При образовании двойных связей в молекулах ненасыщенных соединений встречают с гибридизацию одной s- и двух р-орбиталей углерода с образованием трех эквивалентных гибридных орбиталей, называемую sp2-орбиталями. Каждая из них имеет цилиндрическую симметрию относительно одной из трех осей, расположенных в плоскости под углом 120°, В реальной молекуле этилена угол Н-С-Н равен 116,7°[16, с.30].
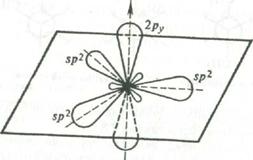
Рис. 1 Схема образования sp2-гибридного состояния электронной оболочки атома углерода
Ось четвертой атомной р-орбитали, не затронутой гибридизацией, расположена под прямым углом к плоскости, в которой лежат три оси sp2-гибридных орбиталей.
Перекрывание трех гибридизованных орбиталей с орбиталями других атомов дает σ-связи. Перекрывание двух негибридизованных p-орбиталей между собой дает так называемую π-связь.
π-Связь менее прочна, чем σ-связь, так как p-электронные орбитали с параллельными осями перекрываются значительно меньше, чем при образовании теми же p-электронами или s-электронами σ -связи (перекрывание по оси орбиталей). Общая прочность (σ + π)-связей в этилене составляет 607,1 кДж/моль, в то время как для σ -связи между двумя углеродными атомами в этане она составляет 350,0 кДж/моль. Разница 257,1 кДж/моль является приблизительной мерой прочности π -связи.
Таким образом, двойная связь представляет собой сочетание σ- и π-связей. Последняя обладает максимальной прочностью, когда молекула имеет пленарную (плоскостную) конфигурацию. Для поворота в молекуле этилена одной группы СН2 относительно другой группы СН2 вокруг оси С - С необходимо приложить энергию, достаточную, чтобы разорвать π-связь и вернуть два электрона на отдельные p-орбитали. Энергия молекулярных столкновений при обычной температуре для этого недостаточна и потому вокруг двойной связи нет свободного вращения[16, с. 31].
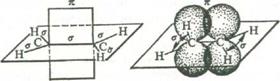
Рис.2 Схематическое изображение строения молекулы этилена
Длина олефиновой связи (σ + π-связь) между двумя ненасыщенными углеродами в алкенах меньше, чем длина простой σ-связи в насыщенных углеводородах (0,154 нм), и составляет 0,134 нм. Это понятно: чем больше концентрируется электронное облако между ядрами, тем более сильно они стягиваются.
При сравнении структурных и энергетических параметров молекул алканов и алкенов видно, что двойная связь значительно короче и прочнее ординарной связи. Однако энергия двойной связи меньше, чем энергия двух ординарных, на 92,1 кДж/моль. Поэтому двойная связь легко переходит в две ординарные σ-связи путем присоединения по месту двойной связи двух атомов или атомных групп.
В реакциях присоединения двойная связь обычно выступает как донор электронов. Поэтому для олефинов характерна реакция электрофильного присоединения. [16, с.79]
1.3.2.2 Электронная структура ацетальдегида
Большинство реакций ацетальдегида обусловлено присутствием активной карбонильной группы. Двойная связь карбонильной группы сходна по физической природе с двойной связью между двумя углеродными атомами (σ-связь + π-связь). Однако в то время как Ес=с < 2Ес-с, энергия связи С=О (749,4 кДж/моль) больше, чем энергия двух простых С-О-связей (2• 358 кДж/моль). С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и потому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода. Дипольный момент карбонильной группы - около 9•10-30 Кл/м (2,7 D). Благодаря такой поляризации углеродный атом карбонильной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Соответственно атом кислорода является нуклеофильным. В реакциях присоединения молекулы всегда направляется к углеродному атому карбонильной группы, в то время как ее положительно поляризованная часть направляется к кислородному атому. [16, с. 166]
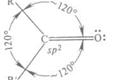
Рис. 3 Схематическое изображение строения молекулы ацетальдегида
1.3.2.3 Электронная структура кислорода
Кислород О имеет электронную конфигурацию невозбужденного атома
![]()
Is-2s22p4:
В молекуле О2 на 8 связывающих электронов приходится 4 разрыхляющих, поэтому порядок связи в ней равен двум. Учитывая парамагнетизм и порядок связи, строение молекулы О2 можно передать следующими структурными формулами:
![]()
Тремя точками обозначены связи, обусловленные двумя πсв- и одним πразр-электроном, что отвечает порядку связи 0,5. Во второй формуле непарные точки означают πразр-электроны. При возбуждении молекула О2 становится диамагнитной. Этому состоянию отвечает структурная формула :О=О:
Вследствие кратности связи межатомное расстояние в О2 (1,207 А ) меньше длины одинарной связи 0—0(1,48 А). По этой же причине молекула О2 весьма устойчива, ее энергия диссоциации равна 494 кдж/моль, в то время как энергия одинарной связи О—О всего 210 кдж/моль. Диссоциация молекул О2 на атомы становится заметной лишь при 2000°С. Диссоциация молекулы О2, на атомы (фотолиз О2) имеет место также при поглощении ультрафиолетового излучения с длиной волны 190 нм (1900 А).[17, с. 337]
1.3.2.4 Электронная структура катализатора PdCl2
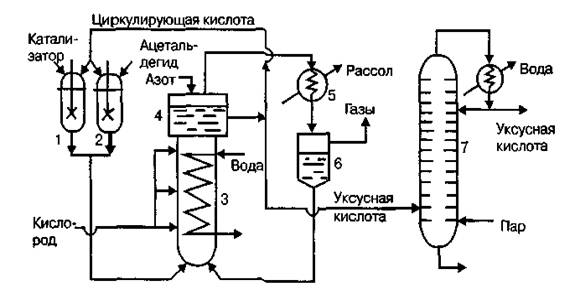
В процессе окисления этилена в ацетальдегид как правило применяется катализатор PdCl2, в качестве промотера применяется CuCl2, либо FeCl3.
Структурной единицей соединений Pd (II) является квадрат. Кристаллы PdCl2 (рис. 4) имеют цепное строение с квадратной структурной единицей PdCl4 [17, с. 649]:
![]()
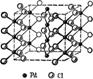
Рис. 4. Структура PdCl2
1.3.3 Химические свойства реагентов и продуктов реакции
1.3.3.1 Химические свойства этилена
1. Гидрирование. Алкены непосредственно молекулярный водород не присоединяют. Эту реакцию можно осуществить только в присутствии гетерогенных (Pd, Pt, Ni) или гомогенных (например, хлортристрифенилфосфин родия RhCl(Ph3P)3) катализаторов. Наиболее часто проводят каталитическое гидрирование на гетерогенных катализаторах:
СН2=СН2 + Н2 ![]() СН3 – СН3; ΔН = – 137.3 кДж/моль.
СН3 – СН3; ΔН = – 137.3 кДж/моль.
2. Галогенирование. Олефины легко присоединяют галогены:
СН2=СН2 + Вг2 ![]() СН2Вг – СН2Вг.
СН2Вг – СН2Вг.
Скорость реакции зависит от природы галогена и строения олефина. Фтор реагирует с воспламенением, иод - медленно на солнечном свету.[16, с.79]
Присоединение происходит по ионному электрофильному механизму. Молекула галогена атакует двойную связь, захватывая электроны и образуя так называемый π-комплекс. Затем отделяется отрицательный ион галогена. К возникающему карбениевому или бромониевому катиону (присоединяется отрицательный ион галогена.
3. Гидрогалогенирование. Олефины присоединяют все галогеноводороды:
CH2 = СН2 + НС1 ![]() СН2Сl-СН3.
СН2Сl-СН3.
Наиболее легко реагирует йодистый водород. Фтористый водород часто (особенно в присутствии влаги) присоединяется с одновременной полимеризацией олефина. С хорошими выходами алкилфториды получаются при действии на алкены растворов HF в третичных аминах (триэтиламин, пиридин) и тетрагидрофуране при О°С. Присоединение хлористого водорода требует обычно нагревания или присутствия катализаторов.
Механизм электрофильного присоединения галогеноводородов двухступенчатый, как и механизм присоединения галогенов, однако π-комплексы в этом случае, вероятно, не образуются: реакции идут через карбениевые ионы и, следовательно, должны быть нестереоспецифичными. Наблюдаемая в ряде случаев стереоспецифичность объясняется тем, что в реакции участвуют не свободные карбениевые ионы, а ионные пары карбениевый ион - анион.[16, с. 81]
4. Гипогалогенирование. Присоединение к олефинам гипогалогенитных кислот и их эфиров осуществляется согласно следующей реакции:
CH2 = СН2 + НОС1 ![]() СН2Сl-СН2ОН.
СН2Сl-СН2ОН.
5. Гидратация. В присутствии катализаторов олефины присоединяют воду, образуя спирты [16, с. 83]:
СН2=СН2 + НОН ![]() CH3-CH2OH
CH3-CH2OH
6. Окисление. Олефины окисляются кислородом воздуха или другими окислителями. Направление окисления зависит от условий реакции и выбора окислителя.
а) Кислородом воздуха в присутствии серебряного катализатора олефины окисляются до органических оксидов:
2СН2=СН2 + О2 ![]() CH2–CH2
CH2–CH2
О
б) Разбавленный раствор перманганата калия (реакция Вагнера) или пероксид водорода в присутствии катализаторов (CrO3, OsO4 и др.) с олефинами образуют гликоли. По месту двойной связи присоединяются два гидроксила:
3СН2=СН2 + 2KMnO4 + H2O![]() 3CH2OH–CH2OH +2MnO2 +2KOH
3CH2OH–CH2OH +2MnO2 +2KOH
СН2=СН2 + H2O2![]() CH2OH–CH2OH
CH2OH–CH2OH
в) При действии концентрированных растворов окислителей (перманганат калия, хромовая кислота, азотная кислота) молекула этилена разрывается по месту двойной связи, образуя муравьиную кислоту:
CH2 = СН2 ![]() 2СНООН.
2СНООН.
д) Прои реакции озонолиза, озон присоединяется по месту двойной связи, образуя нестойкое соединение, озонид, при обработке водой из него образуется пероксид водорода и муравьиный альдегид:
CH2 = СН2 + О3![]()
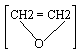
![]()
![]()
![]() 2CH2O +H2O2
2CH2O +H2O2
7. Полимеризация. Одним из наиболее важных для современной техники превращений олефинов является реакция полимеризации. Полимеризация олефинов может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов [16, с. 87].
n CH2=CH2![]() [-CH2-CH2 -]n
[-CH2-CH2 -]n
1.3.3.2 Химические свойства ацетальдегида
1. Гидрирование. Присоединение водорода к происходит в присутствии катализаторов гидрирования (Ni, Со, Си, Pt, Pd и др.). При этом он переходит в этиловый спирт:
CH3CHO + H2![]() C2H5OH
C2H5OH
При восстановлении альдегидов или кетонов водородом в момент выделения (с помощью щелочных металлов или амальгамированного магния) образуются наряду с соответствующими спиртами в незначительных количествах образуются также гликоли:
2 CH3CHO + 2Н![]() CH3 – CH – CH – CH3
CH3 – CH – CH – CH3
ОН ОН
2. Реакции нуклеофильного присоединения
2.1 Присоединение магнийгалогеналкилов [16, с.168]
СН3 – СН2 – MgBr + CH3CHO![]() BrMg – O – CH – C2H5
BrMg – O – CH – C2H5
CH3
2.2 Присоединение синильной кислоты приводит к образованию нитрила α-гидроксипропионовой кислоты:
OH
CH3CHO + HCN ![]() CH3 – CH – CN
CH3 – CH – CN
2.3 Присоединение гидросульфита натрия дает кристаллические вещество – производное ацетальдегида:
OH
CH3CHO + HSO3Na![]() CH3 – C – SO3Na
CH3 – C – SO3Na
H
2.4 Взаимодействие с аммиаком приводит к образованию ацетальдимина [16, 169] :
CH3CHO + NH3![]() CH3–CH=NH
CH3–CH=NH
2.5 С гидроксиламином ацетальдегид, выделяя воду, образует ацетальдоксимоксим:
CH3CHO + H2NOH ![]() H2O + CH3–CH =NOH
H2O + CH3–CH =NOH
2.6 Особый интерес представляют реакции ацетальдегида с гидразином и его замещенными [16, с. 171]:
CH3CHO + H2N – NH2 + OCHCH3 ![]() CH3–CH=N–N=CH–CH3 + 2H2O
CH3–CH=N–N=CH–CH3 + 2H2O
Альдазин
2.7 Ацетальдегид способен присоединять по карбонильной группе воду с образованием гидрата - геминального гликоля. При 20˚С ацетальдегид в водном растворе на 58% существует в виде гидрата
–C– + HOH ![]() HO–C–OH
HO–C–OH
O
2.8 При действии на ацетальдегид спиртов образуются полуацетали:
OH
CH3CHO + HOR ![]() CH3–CH
CH3–CH
OR
В присутствии следов минеральной кислоты образуются ацетали[16, с. 172]
OH OR
CH3 – CH + ROH ![]() CH3 – CH + H2O
CH3 – CH + H2O
OR OR
2.9 Ацетальдегид при взаимодействии с РС15 обменивает атом кислорода на два атома хлора, что используется для получения геминального дихлорэтана:
CH3CHO + РС15![]() CH3CHСl2 + POCl3
CH3CHСl2 + POCl3
Похожие работы
... кислота производилась также пиролизом ацетона через кетен, окислением узких фракций бензина, а также выделением из продуктов окисления твердого парафина. В результате развития синтетических методов производства уксусной кислоты удельный вес их вырос с 50% в 1963 г. до 70% в 1965 г. и до 90% в 1970 г. За эти же годы общий объем производства уксусной кислоты в стране вырос в три раза. В 1963 г. ...
... уксусная кислота применяется в химической, фармацевтической и легкой промышленности, а также в пищевой промышленности в качестве консерванта. Формула СН3СООН. Синтетическая пищевая уксусная кислота выпускается концентрированной (99.7 %) и в виде водного раствора (80 %). По физико-химическим показателям синтетическая пищевая уксусная кислота должна соответствовать следующим нормам: Таблица ...
... , похожих на лед; вследствие этого безводная уксусная кислота получила название ледяной уксусной кислоты. Уксусная кислота имеет большое народнохозяйственное значение. Она широко применяется в самых различных отраслях промышленности и в быту. В химической промышленности уксусная кислота используется для получения винилацетата, ацетата целлюлозы, красителей и многих других веществ. В виде солей ...
... группа в карбоксиле кислот может быть замещена различными атомами или группами (Х); образующиеся при этом вещества обычно называют функциональными производными карбоновых кислот; строение их может быть представлено общей формулой R—C—X II O Мы кратко рассмотрим образование и свойства таких производных кислот, или галогенангидриды, ангидриды, ...




0 комментариев