Навигация
Расчет параметров реактора
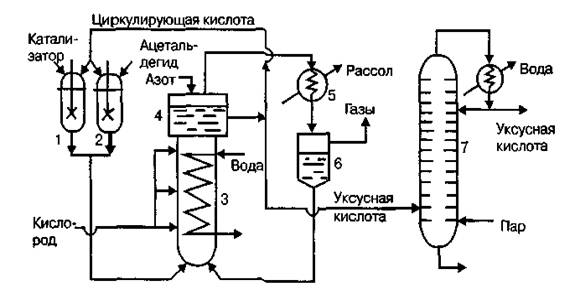
5.2 Расчет параметров реактора
Определим количество катализаторного раствора, необходимое для окисления 50 кг/час этилена. Согласно литературным данным катализаторный раствор содержит 0,3 – 0,5 % PdCl2. Примем содержание PdCl2 равным 0,5 %.
Согласно стехиометрии реакции:
CH2=CH2 +PdCl2 + H2O![]() CH3CHO + Pd + 2HCl;
CH3CHO + Pd + 2HCl;
количество вещества PdCl2 равно:
G PdCl2 = G C2H4 = 1,786 кмоль/час
Тогда масса катализатора m
PdCl2 = G PdCl2 · M PdCl2 = 1,786 · 177 = 316,12 кг/час
Расход катализаторного раствора:
mр = 316,2 · 100/0,5 = 63224,4 кг/час
Плотность раствора 1281,6 кг/м³ [22, с. 106], тогда объёмный расход катализаторного раствора:
Gkt = mр/ρ = 63224,4/1281,6 = 49,33 м³/час
Коэффициент газонасыщения: k = GC2H4/ Gkt = 40/49,33 = 0,81 м³/м³
Пользуясь методикой для расчёта барботажных колонн [23, с. 265], рассчитаем параметры реактора.
Диаметр барботажной колонны:
D = 4Vг/πωг,
где ωг – приведённая скорость (ωг 0,1), примем ωг = 0,01
Vг – расход барботирущего газа, приведённый к рабочим условиям
Vг = Vг,0 TрP0/T0Рр = (40/3600) · (383/298) · (0,1/1,0) = 1,43 · 10-3 м³/с
D = 4 · 1,43 · 10-3/(3,14 · 0,01) = 0,43 м
Примем D = 0,5 м, действительная скорость газа в колонне составит:
ωг =4Vг/πD2 = 4 · 1,43 · 10-3/(3,14 · 0,52) = 0,007 м/с
Плотность этилена при рабочих условиях:
ρ C2H4 = ρ C2H4,0 T0Pр/TрР0 = 1,26 · (298/383) · (1,0/0,1) = 9,80 кг/м3
Объёмное газосодержание системы
φг = 0,4(ρг/ ρж) 0,15 [ωг Δρ/σg ] 0,68 =
0,4 · (9,8/ 1281,6) 0,15 [0,007 · 1272,8/58,6 · 10-3 · 9,8] 0,68 = 0,024
Высота газожидкостной смеси:
Hсм = (Vж – Vдн)4/[ πD2a(1 – φг)]
где Vж – объём жидкости в колонне
Vдн – объём днища
a – коэффициент, учитывающий заполнение колонны
Hсм = (1 – 0,1) · 4/[ 3,14 · 0,52 · 0,9(1 – 0,024)] = 5,2 м
Общая высота колонны:
Hк = Hсм + hц + Hсеп + 2hдн = 5,2 + 0,1 + 0,5 + 2 · 0,3 = 6,4 м
где hц – расстояние от барботёра до днища колонны,
Hсеп – высота сепарационной части колонны,
Hдн – высота крышки днища.
5.3 Определение тепловой нагрузки на реактор
Примем температуру реакции Tк =110°С, а температуру исходных веществ Tн = 30°С.
Для расчёта теплоёмкостей веществ при температуре реакции и начальной температуре веществ-участников реакции воспользуемся уравнениями вида сp=a + bT + cT² + c' T‾². Согласно справочным данным [19] соответствующие коэффициенты в уравнении для веществ будут равны:
| Вещество | a | b·10³ | c·10. | c´·10-5. |
| С2Н4 | 11,32 | 122,01 | –37,9 | – |
| O2 | 31,46 | 3,39 | – | –3,77 |
| СН3СНО | 13,00 | 153,5 | –53,7 | – |
| СН3СООН | 14,82 | 196,7 | –77,7 | – |
| СО2 | 44,14 | 9,04 | – | –8,54 |
| Н2О | 3,00 | 10,71 | – | 0,33 |
| N2 | 27,88 | 4,27 | – | – |
Рассчитаем теплоёмкости исходных веществ и продуктов реакции при заданных температурах:
cp ( C2H4)=11,32 + 122,01·10-3·303 – 37,9·10-·3032 =44,81 кДж/кмоль
cp 8( C2H4)=11,32 + 122,01·10-3·383 – 37,9·10-·3832 =52,49 кДж/кмоль
cp ( О2)=31,46 + 3,39·10-3·303 – 3,77·105·303-2 =28,38 кДж/кмоль
cp 8( О2)=31,46 + 3,39·10-3·383 – 3,77·105·383-2 =24,04 кДж/кмоль
cp 8( CH3СНО)=13,00 + 153,5·10-3·383 – 53,7·10-·3832 =80,46 кДж/кмоль
cp 8( CH3СООН)=14,82 + 196,7·10-3·383 – 77,7·10-·3832 =78,76 кДж/кмоль
cp 8( СО2)=44,14 + 9,04·10-3·383 – 8,54·105·383-2 =41,78 кДж/кмоль
cp 8( Н2О)=30,00 + 10,71·10-3·383 + 0,33·105·383-2 =34,36 кДж/кмоль
cp 0( N2)=27,88 + 4,27·10-3·303 =29,17 кДж/кмоль
cp 8( N2)=27,88 + 4,27·10-3·383 =29,51 кДж/кмоль
Приход тепла
1. Тепло, приходящее с исходными веществами:
Qисх. в-в = ΣGni · cpi · Tн = G C2H4· cp ( C2H4) · Tн + G О2· cp ( О2) · Tн + G N2 · cp 0( N2) · Tн =
=1,786 ·44,81· 303 + 3,376· 28,38· 303 + 12,698· 29,17· 303 = 165511,4 кДж/час
2. Тепло химических реакций:
Qр= Qобркон – Qобрисх
Теплота образования конечных веществ:
Qобркон = Σ(–ΔН°j) · Gnj
Qобр C2H4 = –52,3 · 0,143 · 10 = –7478,9 кДж/час
Qобр CH3СНО = 166,00 · (1,316 + 0,163) · 10 = 245 514 кДж/час
Qобр CH3СООН = 434,84 · 0,049 · 10 = 21307,2 кДж/час
Qобр СО2 = 393,51 · 0,23 · 10 = 90507,3 кДж/час
Qобр Н2О = 241,81 · 0,23 · 10 = 55616,3 кДж/час
Теплота образования исходных веществ:
Qобркон = Σ(–ΔН°i) · Gni
Qобр C2H4 = –52,3 · 1,786 · 10 = –93407,8 кДж/час
Qр=495465,9 – (– 93407,8 ) =498873,3 кДж/час
3. Тепло фазовых переходов.
В условиях реакции фазовых переходов продуктов реакции и реагентов не происходит.
4. Итого, приход тепла:
Qприх = Qисх. в-в + Qр = 165511,4 + 498873,7 = 664385,1 кДж/час
Расход тепла
1. Тепло, уносимое из реактора продуктами реакции и непрореагировавшими веществами:
Qпрод= ΣGnj· cpj · Tк = G C2H4· cp 8( C2H4) · Tк + G О2 · cp 8(О2) · Tк + G N2 · cp 8( N2) · Tк + G СО2 · cp 8( СО2) · Tк + G Н2О · cp 8(Н2О) · Tк = (0,143·52,49 + 2,243·24,04+ 12,698·29,51 + 0,23·41,78 + 0,23·34,36)·383 = 173751,0 кДж/час
2. Тепло, затрачиваемое на подогрев исходных реагентов:
Qнагр = ΣGni· cpi · (Tк – Tн) = [G C2H4· cp (C2H4) + G N2 · cp 0(N2) + G О2· cp ( О2)]· (Tк – Tн) = (1,786·44,81 + 12,698·29,17 + 3,376·28,38) · (383 – 303) = 43699,4 кДж/час
3. Потери тепла:
Δ Q= 0,04·Qприх = 0,04·664385,1 = 26575,4 кДж/час
4. Тепловая нагрузка:
QF = Qприх – Qпрод – Qнагр – Δ Q = = 664385,1– 173751,0 – 43699,4 – 26575,4 = 420 359,3 кДж/час
Таблица теплового баланса:
| Приход тепла | кДж/час | % | Расход тепла, кДж/моль | кДж/час | % |
| Тепло, приходящее с исходными веществами Qисх.в-в | 165511,4 | 24,9 | Тепло, уносимое из реактора продуктами реакции Qпрод | 173751,0 | 26,1 |
| Тепло химических реакций Qр | 498873,7 | 75,1 | Тепло, затрачиваемое на подогрев исходных реагентов Qнагр | 43699,4 | 6,6 |
| Тепло фазовых переходов | – | – | потери Δ Q | 26575,4 | 4,0 |
| Тепловая нагрузка QF | 420 359,3 | 63,3 | |||
| Итого | 664385,1 | 100 | Итого | 664385,1 | 100 |
Поверхность реактора:
Примем разность температур реакционной массы и теплоносителя равной Δtср = 50 К, коэффициент теплопередачи k = 150 вт/м2·К , тогда площадь поверхности реактора составит
F = QF/(k· Δtср) = (420 359,3 · 1000)/(150 · 50 · 3600) = 15,57 м2
Список литературы
1. Соколов Р.С. Химическая технология в 2-х т.: Учебное пособие для вузов Т.2:Металлургические процессы. Переработкам химического топлива. Производство органических веществ и полимерных материалов. - М. «Владос», 2000 - 447 с.
2. Химическая энциклопедия: в 5 т., Т.1 под ред. Кнукянц И.Л., М: Советская энциклопедия, 1988 - 623 с.
3. Тимофеев В.С., Серафимов Л.А. Принципы технологии основного органического и нефтехимического синтеза: Учеб. Пособие для вузов - 2-е изд., перераб. - М.: Высш. шк., 2003. - 536 с.
4. Лебедев Н.Н. Химия и технология основного органического синтеза. - М. Химия, 1988, 582 с.
5. Юкельсон И.И. Технология основного органического синтеза. - М. Химия, 1968 - 848 с.
6. Паушкин Я.Н., Адельсон С.В., Вишнякова Т.П. Технология нефтехимического синтеза. В 2-х ч. Ч.1 Углеводородное сырьё и продукты его окисления. - М.: «Химия», 1973 - 352 с
7. Реферативный журнал «Химия», 1999 №9 Патент 5679870 США МПК6 С07С45/00 Tustin Gerald Charles, Depew Leslie Sharon; Eastman Chemical Co. -- № 619385; Заявл 21.3.96.; Опубл. 21.10.97; НПК 568/489
8. Реферативный журнал «Химия», 2000 №13 Патент 23981 Украина МПК6 С07С47/06 Осiйський Едуард Йосипович, Гомонал Василь Iванович: Ужгород, держ. цн-т – № 961124485. Заявл. от 02.12.1996. Опубл. 31.08.1998 Бюл. №20
9. Реферативный журнал «Химия», 2003 №24. Превращение этиленгликоля до ацетальдегида – дегидратация или согласованный механизм. Ethyleneglycol to acetaldehyde – dehydration or a concered mechanism. Smith William B. (Department of Chemistry, Texas) Texas Christian University, Fort Worth, TX, 76129 USA Tetrahedron, 2002, 58 №11, с. 2091-2094
10.Реферативный журнал «Химия», 2003 №19 Селективное гидрирование уксусной кислоты в ацетальдегид на нанесённых на SBA-15 оксидах железа. Zhang Xue-Zheng, Yue Ying-Hong, Gao Zi Gaodeng xuexiao huahxun xuebao= Chem J. Chin. Univ. 2003 24, № 1, с 121-124
11.Реферативный журнал «Химия», 1998 №7 Влияние концентрации кислорода на выход ацетальдегида при окислении этанола в присутствии оксидов кальция и алюминия. Oxidation of concentration on acetaldehyde yield/Karafyllis J. Phillipponlos C. Grigoroponlon H.//Chem and Biochem – Eng., Quart – 1997 – 11, №3 – с. 121-125
12.Реферативный журнал «Химия», 2002 №2 Different mechanism for the formation of acetaldehyde and ethanol on the Rh-based catalysts. Wang Xi, Luo Hongyuan, Liang Dongbai, Bao Xinhe J Catal, 2000. 190 №1 с.46-55
13.Реферативный журнал «Химия», 2002 №6 Оптимизация процесса производства ацетальдегида. Wu Xuan-chun Nanjing huegong daxue xuebao= J. Nanjing Univ. Chem Technol. 2001 23, №4, с. 47-49
14.О. К. Бабакова, Ю.А. Писаренко, В.С. Тимофеев, А.С. Шувалов Разработка узла гидролиза производства ацетальдегида косвенной гидратацией ацетилена. 2002 Химическая промышленность с. 16-20
15.Краткий справочник по химии под ред. А. Т. Пилипенко, Киев: «Наукова думка», 1987
16.Петров А.А. , Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для ВУЗов.//Под ред. Стадничука М.Д. - 5-е изд., перераб. и доп. - СПб.: «Иван Фёдоров», 2002. - 624 с., ил.
17.Ахметов Н.С. Неорганическая химия. Учебное пособие для вузов. М., «Высшая школа», 1975
18.Физер Л., Физер М.Органическая химия. Углубленный курс. В 2-х т., Т.1/ Пер с англ. Под ред. Вульфсона - М. «Химия», 1966. - 680 с.
19.Краткий справочник физико-химических величин. Под ред. Равделя А.А., Пономарёвой А. М., - Спб.: «Иван Федоров», 1999
20.Попов Ю.В., Но Б.И. Инженерная химия: Учебное пособие / Волгоградский Государственный Технический Университет, Волгоград, 2003.
21.Хенреце-Оливе Г., Оливе С. Координация и катализ. М., «Мир», 1980
22.Краткий справочник физико-химических величин под ред. К.П. Мищенко и А.А. Равделя, Л.: Химия, 1974 г. – 200 стр.
23.Машины и аппараты химических производств: Примеры и задачи. Учеб. пособие для студентов втузов, обучающихся по специальности «Машины и аппараты химических производств» под ред. В.Н. Соколова – Л.: Машиностроение ,1982.
Похожие работы
... кислота производилась также пиролизом ацетона через кетен, окислением узких фракций бензина, а также выделением из продуктов окисления твердого парафина. В результате развития синтетических методов производства уксусной кислоты удельный вес их вырос с 50% в 1963 г. до 70% в 1965 г. и до 90% в 1970 г. За эти же годы общий объем производства уксусной кислоты в стране вырос в три раза. В 1963 г. ...
... уксусная кислота применяется в химической, фармацевтической и легкой промышленности, а также в пищевой промышленности в качестве консерванта. Формула СН3СООН. Синтетическая пищевая уксусная кислота выпускается концентрированной (99.7 %) и в виде водного раствора (80 %). По физико-химическим показателям синтетическая пищевая уксусная кислота должна соответствовать следующим нормам: Таблица ...
... , похожих на лед; вследствие этого безводная уксусная кислота получила название ледяной уксусной кислоты. Уксусная кислота имеет большое народнохозяйственное значение. Она широко применяется в самых различных отраслях промышленности и в быту. В химической промышленности уксусная кислота используется для получения винилацетата, ацетата целлюлозы, красителей и многих других веществ. В виде солей ...
... группа в карбоксиле кислот может быть замещена различными атомами или группами (Х); образующиеся при этом вещества обычно называют функциональными производными карбоновых кислот; строение их может быть представлено общей формулой R—C—X II O Мы кратко рассмотрим образование и свойства таких производных кислот, или галогенангидриды, ангидриды, ...


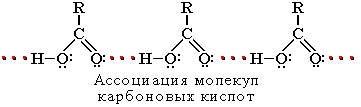


0 комментариев