Навигация
Анализ факторов, влияющих на протекание реакции окисления этилена
3.2 Анализ факторов, влияющих на протекание реакции окисления этилена
3.2.1 Влияние строения субстрата
Вакер-процесс применим для большинства алкенов; в общем случае α-алкены дают метилкетоны и некоторое количество альдегидов:
RCH=CH2![]() RCOCH3
RCOCH3
Замещенные алкены с электроноакцепторными группами (Y = =CN, NO2) непосредственно при двойной связи присоединяют кислород к углероду, удаленному от этой группы:
YCH=CH2 ![]() YCH2CHO
YCH2CHO
Как было сказано наиболее важной стадией вакер-процесса является внедрение алкена в полярную связь Pd+—ОH-. Направление присоединения кислорода предсказывается правилом Марковникова.
Алкены с карбоксильной группой и винилгалогениды теряют заместитель в процессе реакции, давая метилкетоны:
RCH=CH–COOH![]() ROCH3
ROCH3
RCCl=CH2 ![]() RCOCH3
RCOCH3
Циклические алкены, вплоть до циклогептена, дают циклические кетоны:
CH CH2
(CH2)n ![]() (CH2)n
(CH2)n
CH CO
Диеновые углеводороды реагируют с миграцией двойной связи:
CH2=CH – CH=CH2![]() CH3–CH=CH–CHO
CH3–CH=CH–CHO
CH2=CH –CH2–CH=CH2![]() CH3 – CH2–CH=CH=CHO
CH3 – CH2–CH=CH=CHO
Высшие алкены требуют более высоких температур. Они имеют тенденцию давать смесь кетонов (по причине миграции двойной связи)[21, c. 246].
3.2.2 Влияние строения атакующей частицы. Влияние строения уходящей группы
Замещение С1- на ОН- предположительно затрагивает Cl-лиганд в транс-положении по отношению к этилену. С другой стороны, внедрение согласно современным представлениям требует взаимного цис-положения для алкена и ОН-лиганда. Предполагают, что значительная концентрация цис-молекул обеспечивается обратимой изомеризацией, которая идет через образование промежуточного пентакоординационного соединения[21, с. 249]:
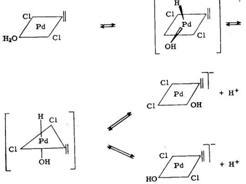
3.2.3 Влияние растворителя
Процесс окисления этилена является гомогенным каталитическим, протекает при действии соли палладия (другие окисляющие агенты , например Fе3+ и К2Сг07, тоже можно в принципе использовать, но все же Сu2+ предпочтительнее из-за легкости окисления Сu+ кислородом). По этой причине проведение превращения требует наличия полярного растворителя, хорошо растворяющего соль палладия.
В промышленности в качестве растворителя применяют воду. Как было показано выше замещение С1- на ОН- в лиганде [PdCl4]2- является одной из стадий процесса. При замене растворителя ион ОН- заменяется на другой. Соответственно применение других растворителей может привести к изменению течения реакции, получению совершенно других продуктов.
Так, Если этилен окислить в уксусной кислоте в качестве растворителя, то получается винилацетат с примесью побочных продуктов[21, с. 246]:
CH3 – COOPd + C2H4![]() CH3 – COOCH2CH2Pd
CH3 – COOCH2CH2Pd![]()
![]() PdH + CH3 – COOCH=CH2
PdH + CH3 – COOCH=CH2
4. Выбор типа реактора
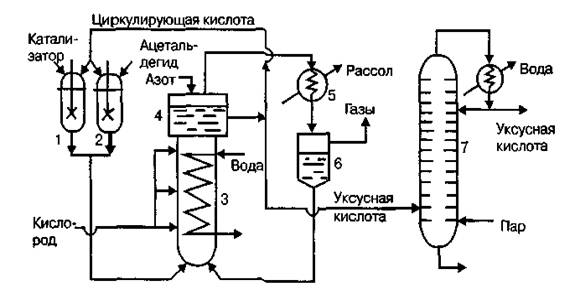
При изучении процесса синтеза ацетальдегида окислением этилена кислородом были выявлены ряд особенностей данного процесса, основываясь на этих особенностях следует выбрать тип аппарата для проведения реакции.
Процесс окисления этилена в ацетальдегид идёт при действии соли палладия, растворённой в воде, то есть он относится к группе гомогенно-каталитических процессов. Для проведения синтеза необходимо пропускать газообразный этилен, либо смесь кислорода и этилена, через раствор катализатора. Это предполагает выбор такого реактора, в котором создаются условия для перехода газообразного этилена в водный раствор, содержащий катализатор. Требуется обеспечить эффективный контакт газа с жидкость, который может обеспечить газораспределительное устройство. Для интенсификации процесса аппарат целесообразно заполнить насадкой.
Раствор катализатора приготовляется с использованием соляной кислоты, поэтому он обладает сильными коррозионными свойствами. В условиях такой агрессивной среды для изготовления корпуса аппарата пригоден не любой материал, а лишь обладающий кислотоупорными свойствами. Таким материалом может быть, например, титан. В случае необходимости применения насадки, при её выборе также следует учесть коррозионную устойчивость её материала. Например, в качестве насадки могут быть выбраны керамические кольца.
Синтез идёт при избыточном давлении 0,8-1,3 МПа, поэтому должно выполняться условие герметичности аппарата. Аппарат должен быть спроектирован таким образом, чтобы выдерживать это давление, особое внимание следует уделять прочности сварных швов.
Процесс ведётся при 100–120°С, в этих условиях, как показывает термодинамический анализ, тепловой эффект реакции синтеза ацетальдегида будет равен –218,6 - –218,68 кДж/моль. То есть реакция идёт со значительным выделением тепла. Величина теплового эффекта влияет на поверхность теплообмена реактора. С другой стороны тепло реакции расходуется на нагрев реагентов и свежих порций катализаторного раствора. В условия проведения реакции катализаторный раствор кипеть не будет, поэтому для отвода избыточного количества тепла необходимо оборудовать реактор рубашкой.
Побочные реакции последовательны, то есть для большей селективности процесса следует как можно быстрее выводить продукт основной реакции из реактора. Реактор следует выбрать из той группы аппаратов, где процесс по гидродинамическому режиму приближен к реактору идеального вытеснения.
Проведению процесса синтеза ацетальдегида окислением этилена кислородом с учётом всех этих особенностей наиболее полно удовлетворяют аппараты барботажного типа. В них создаются оптимальные условия для перехода этилена в раствор катализатора. Гидродинамический режим аппаратов этого типа по газовой фазе приближен к РИВ, по жидкой – к РИС. Как было показано выше, корпус аппарата должен быть выполнен из титана.
5. Расчёт реактора
5.1 Материальный баланс
Проведём расчёт материальных потоков процесса получения ацетальдегида окислением этилена кислородом воздуха.
Основная реакция:
СН2=СН2 + 0,5О2 ![]() СН3СНО (1);
СН3СНО (1);
Побочные:
СН2=СН2 + О2 ![]() СН3СООН (2);
СН3СООН (2);
СН2=СН2 + 3О2 ![]() 2СО2 + 2Н2О (3).
2СО2 + 2Н2О (3).
Производительность реактора по этилену 50 кг/час.
Число дней работы реактора в году n=340.
Технологический выход продукта 89%;
Степень превращения этилена 92%.
Селективность (1) – 90%, (2) – 3%, (3) – 7%.
Состав этилено-воздушной смеси: этилен – 10%, об.; воздух – 90%, об.
Состав воздуха: О2 – 21%, об., N2 и др. инертные примеси – 79%, об.
Приход
1. Производительность реактора по этилену в кмоль/час:
GC2H4= GC2H4/М C2H4=50/28=1,786 кмоль/час
2. Производительность по этаналю согласно стехиометрии реакции:
G'''CH3СНО= GC2H4=1,786 кмоль/час (78,58 кг/час)
С учётом степени превращения этилена:
G''CH3СНО= G'''CH3СНО ·X C2H4= 1,786 · 0,92=1,643 кмоль/час (72,29 кг/час)
С учётом селективности реакции:
G'CH3СНО= G''CH3СНО · Ф CH3СНО= 1,643· 0,9=1,479 кмоль/час (65,08 кг/час)
С учётом технологического выхода:
GCH3СНО= G'CH3СНО ·f CH3СНО=1,479·0,89=1,316 кмоль/час (57,90 кг/час)
Технологические потери ацетальдегида:
Gпотерь = G'CH3СНО – GCH3СНО= 65,08 – 57,90= 7,18 кг/час
3. Этилен, идущий на побочные реакции (согласно стехиометрии):
GC2H4= G''CH3СНО – G'CH3СНО=1,643 – 1,479=0,164 кмоль/час
В том числе на реакцию (2):
GC2H4= [Ф(2)/(Ф(2)+Ф(3))] · GC2H4=[3/10] ·0,164=0,049 кмоль/час
GC2H4= [Ф(3)/(Ф(2)+Ф(3))] · GC2H4=[7/10] ·0,164=0,115 кмоль/час
4. Количество непрореагировавшего этилена (согласно стехиометрии реакции (1)):
G0ст.C2H4= G'''CH3СНО – G''CH3СНО=1,786 – 1,643=0,143 кмоль/час (4,00 кг/час)
5. Количество воздуха:
Gвозд= (G'''CH3СНО·90)/10=(1,786·22,4·90)/10=360,06 м³/час
В том числе азота:
GN2= Gвозд·0,79=360,6·0,79=284,45 м³/час (12,698 кмоль/час; 355,54 кг/час)
кислорода:
GО2= Gвозд·0,21=360,6·0,21=75,61 м³/час (7,367 кмоль/час; 108,02 кг/час)
6. Кислород, расходуемый на химические реакции:
на реакцию (1):
G(1)О2= (ν О2/ ν CH3СНО ) ·G' CH3СНО=(1/2) ·1,479= 0,739 кмоль/час (23,65 кг/час)
на реакцию (2):
G(2)О2= (ν О2/ ν C2H4 ) ·GC2H4=(1\1) ·0,049=0,049 кмоль/час (1,57 кг/час)
на реакцию (3):
G(3)О2= (ν О2/ ν C2H4 ) ·GC2H4=(3\1) ·0,115=0,345 кмоль/час (11,04 кг/час)
Расход
1. Непрореагировавший кислород:
G'О2= GО2 – (GО2+ GО2+ GО2) = 108,03 – (23,65 – 1,57 – 11,04)=71,77 кг/час (2,243 кмоль/час)
2. Количество СН3СНО:
GCH3СООН = (ν CH3СООН/ ν C2H4 ) GC2H4= (1/1) ·0,049 кмоль/час (2,95 кг/час)
3. Количество СО2:
GCО2 = (ν CО2/ ν C2H4 ) GC2H4=(2/1) · 0,115= 0,230 кмоль/час (10,12 кг/час)
4. Количество Н2О:
GН2О = (ν Н2О/ ν C2H4 ) GC2H4=(2/1) · 0,115= 0,230 кмоль/час (4,14 кг/час)
Полученные данные сведём в таблицу материального баланса:
Приход:
| Состав сырья | Кг/час | %,масс | Кмоль/час | %, моль | м³/час | %, об. |
| С2Н4 | 50 | 9,7 | 1,786 | 10 | 40,0 | 10 |
| N2 | 355,54 | 69,2 | 12,698 | 71,1 | 284,45 | 71,1 |
| O2 | 108,03 | 21,1 | 3,376 | 18,9 | 285,61 | 18,9 |
| Итого | 513,57 | 100 | 17,86 | 100 | 400,06 | 100 |
Расход:
| Состав реакц. смеси | Кг/час | %,масс | Кмоль/час | %, моль | м³/час | %, об. |
| С2Н4 | 4,00 | 0,8 | 0,143 | 0,8 | 3,1 | 0,8 |
| N2 | 355,54 | 69,2 | 12,698 | 74,4 | 284,48 | 74,4 |
| O2 | 71,77 | 14,0 | 2,243 | 13,1 | 50,2 | 13,1 |
| СН3СНО | 57,90 | 11,2 | 1,316 | 7,7 | 29,5 | 7,7 |
| потери СН3СНО | 7,18 | 1,4 | 0,163 | 0,9 | 3,6 | 0,9 |
| СН3СООН | 2,93 | 0,6 | 0,049 | 0,3 | 1,1 | 0,3 |
| СО2 | 10,12 | 2,0 | 0,230 | 1,4 | 5,1 | 1,4 |
| Н2О | 4,14 | 0.8 | 0,230 | 1,4 | 5,1 | 1,4 |
| Итого | 513,58 | 100 | 17,072 | 100 | 382,15 | 100 |
Массовые потоки приходной и расходной части совпадают, следовательно материальный баланс составлен верно.
Похожие работы
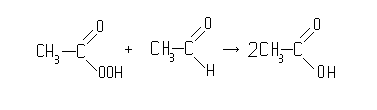
... кислота производилась также пиролизом ацетона через кетен, окислением узких фракций бензина, а также выделением из продуктов окисления твердого парафина. В результате развития синтетических методов производства уксусной кислоты удельный вес их вырос с 50% в 1963 г. до 70% в 1965 г. и до 90% в 1970 г. За эти же годы общий объем производства уксусной кислоты в стране вырос в три раза. В 1963 г. ...
... уксусная кислота применяется в химической, фармацевтической и легкой промышленности, а также в пищевой промышленности в качестве консерванта. Формула СН3СООН. Синтетическая пищевая уксусная кислота выпускается концентрированной (99.7 %) и в виде водного раствора (80 %). По физико-химическим показателям синтетическая пищевая уксусная кислота должна соответствовать следующим нормам: Таблица ...
... , похожих на лед; вследствие этого безводная уксусная кислота получила название ледяной уксусной кислоты. Уксусная кислота имеет большое народнохозяйственное значение. Она широко применяется в самых различных отраслях промышленности и в быту. В химической промышленности уксусная кислота используется для получения винилацетата, ацетата целлюлозы, красителей и многих других веществ. В виде солей ...
... группа в карбоксиле кислот может быть замещена различными атомами или группами (Х); образующиеся при этом вещества обычно называют функциональными производными карбоновых кислот; строение их может быть представлено общей формулой R—C—X II O Мы кратко рассмотрим образование и свойства таких производных кислот, или галогенангидриды, ангидриды, ...


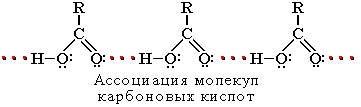


0 комментариев