Навигация
Термодинамический анализ основной реакции
2. Термодинамический анализ основной реакции
2.1 Исходные данные для термодинамических расчётов
Процесс окисления ацетальдегида в ацетилен протекает согласно следующему уравнению химической реакции:
СН2 = СН2 + 0,5О2![]() СН3СНО
СН3СНО
Справочные данные термодинамических величин исходных веществ и продукта реакции имеют следующие значения[19]:
| Вещество | ΔН°f, 298, кДж/моль | S°298, Дж/моль•К | с°р= f(T) | |||
| a | b•103 | c'•10-5 | c•106 | |||
| СН3СНО | -166 | 264,20 | 13,00 | 153,50 | — | -53,70 |
| С2Н4 | 52,30 | 219,45 | 11,32 | 122,01 | — | -37,90 |
| О2 | 0 | 205,04 | 31,46 | 3,39 | -3,77 | — |
2.2 Расчёт термодинамических функций
Установим зависимость изменения теплоёмкости от температуры Δср= f(T):
Δср=Δa + ΔbT + Δc'T-2 + ΔcT2
Δa=Σ(υa)j – Σ(υa)i = –14,05
Δb= Σ(υb)j – Σ(υb)i = 29,79•10-3
Δc'= Σ(υc')j – Σ(υc')i = 1,88•105
Δc= Σ(υc)j – Σ(υc)i = –15,8•10-6
Стандартные значения изменений термодинамических величин:
ΔН°298 = Σ(υ ΔН°f, 298)j – Σ(υ ΔН°f, 298)i = –218,3 кДж/моль
ΔН°298<0, следовательно реакция экзотермична
ΔS°298 = Σ(υ S°298)j – Σ(S°298)i = –57,77 Дж/моль•К
Согласно уравнению Гиббса-Гельмгольца
ΔG°298 = ΔН°298 – T• ΔS°298 = –201,08 кДж/моль
ΔG°298 <0, следовательно при стандартных условиях реакция может протекать в прямом направлении.
Определим зависимость ΔН°T= f(T), подставив Δср= f(T) в уравнение Кирхгофа:
ΔН°T= ΔН°298 + Δc°pdt = ΔН°298 + Δa(T – 298) + Δb(T2 – 2982)/2 – Δc'(T-1 – 298-1)+ Δc(T3 – 2983)
Подставив в полученную зависимость значения температур в интервале 25 – 175°С, найдём характер изменения зависимости ΔН°f= f(T):
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔН° Т , кДж/моль | 218,37 | 218,43 | 218,49 | 218,55 | 218,57 | 218,63 | 218,68 | 218,74 | 218,82 | 218,86 |
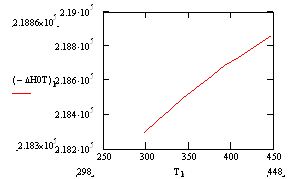
Рис.5 Зависимость теплового эффекта реакции –ΔН°от температуры.
Определим зависимость ΔS°= f(T)
ΔS°T= ΔS°298 + Δc°pdt/T = ΔS°298 + Δa(lnT – ln298) + Δb(T – 298) –
–Δc'/2(T-2 – 298-2)+ + Δc/2(T2 – 2982)
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔS° Т , Дж/моль | 57,98 | 58,19 | 58,37 | 58,54 | 58,60 | 58,75 | 58,89 | 59,03 | 59,22 | 59,32 |
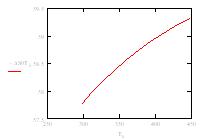
Рис.6 Зависимость изменения энтропии ΔS° от температуры
Пользуясь уравнением Гиббса-Гельмгольца:
ΔG°T = ΔН°T – T • ΔS°T,
рассчитаем значения ΔG° при соответствующих температурах:
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔG° Т , кДж/моль | 200,22 | 199,35 | 198,47 | 197,59 | 197,30 | 196,42 | 195,54 | 194,65 | 193,18 | 192,29 |
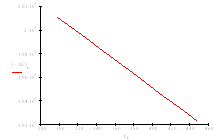
Рис.7 Зависимость изменения энергии Гиббса ΔG от температуры
Пользуясь уравнением изотермы Вант-Гоффа:
ΔG = – RT•lnkp,
вычислим значения констант равновесия:
lnkp = – ΔG /(RT)
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| lnkp | 76,9388 | 73,1007 | 69,5973 | 66,3866 | 65,7352 | 62,5208 | 59,8453 | 57,3843 | 53,6606 | 51,6252 |
| kp | 2,59•1033 | 5,59•1031 | 1,68•1030 | 6,78•1028 | 2,47•1028 | 1,39•1027 | 9,78•1025 | 8,35•1024 | 2,02•1023 | 2,63•1022 |
Сведём полученные данные в таблицу термодинамических функций реакции:
| Т, КТ, К | 298 | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔН° Т кДж/моль | 218,3 | 218,37 | 218,43 | 218,49 | 218,55 | 218,57 | 218,63 | 218,68 | 218,74 | 218,82 | 218,86 |
| –ΔS° Т Дж/моль | 57,77 | 57,98 | 58,19 | 58,37 | 58,54 | 58,60 | 58,75 | 58,89 | 59,03 | 59,22 | 59,32 |
| –ΔG° Т кДж/моль | 201,08 | 200,22 | 199,35 | 198,47 | 197,59 | 197,30 | 196,42 | 195,54 | 194,65 | 193,18 | 192,29 |
| kp | 1,77•1035 | 2,59•1033 | 5,59•1031 | 1,68•1030 | 6,78•1028 | 2,47•1028 | 1,39•1027 | 9,78•1025 | 8,35•1024 | 2,02•1023 | 2,63•1022 |
Выводы
1. Выполненные расчёты термодинамических функций показывают, что реакция окисления этилена в ацетальдегид идёт с выделением теплоты. Причём с увеличением температуры реакционной массы абсолютное значение ΔН°Т немного увеличивается. Согласно принципу Ле-Шателье для увеличения выхода продукта реакции, идущей с выделением теплоты, необходимо осуществлять отвод тепла от реакционной смеси.
2. Изменение энтропии для данной реакции во взятом интервале температур отрицательно. То есть в изолированной системе самопроизвольное протекание данной реакции в прямом направлении невозможно. Значение ΔS° Т с повышением температуры возрастает, следовательно возрастают и термодинамические трудности протекания процесса. Однако на практике имеют дело с неизолированными системами и этот параметр в нашем случае не может служить критерием направленности химической реакции.
3. О направленности химической реакции в изобарно-изотермических условиях судят по значению изменения свободной энергии Гиббса ΔG° Т. Расчёт показывает, что ΔG° Т во всём изученном интервале температур отрицательно, следовательно в пределах этих температур возможно самопроизвольное протекание реакции в прямом направлении. При увеличении температуры абсолютное значение изменения свободной энергии Гиббса уменьшается, значит с увеличением температуры возникают трудности для протекания процесса в прямом направлении. Следовательно при проведении процесса необходимо отводить тепло, выделяющееся в ходе реакции.
4. Константы равновесия для всего интервала температур значительно больше единицы, поэтому в реакционной смеси при достижении состояния равновесия продукты реакции будут существенно преобладать над исходными веществами. С увеличением температуры соотношение между продуктами реакции и исходными веществами в равновесном состоянии будет уменьшаться (уменьшается значение kp), следовательно и выход продукта уменьшится. Для увеличения выхода необходимо постоянно охлаждать реакционную смесь, отводя выделяющуюся теплоту.
Таким образом для получении максимально возможного выхода ацетальдегида при проведении окисления этилена кислородом следует выбрать реактор, оснащённый теплообменной рубашкой.
Похожие работы
... кислота производилась также пиролизом ацетона через кетен, окислением узких фракций бензина, а также выделением из продуктов окисления твердого парафина. В результате развития синтетических методов производства уксусной кислоты удельный вес их вырос с 50% в 1963 г. до 70% в 1965 г. и до 90% в 1970 г. За эти же годы общий объем производства уксусной кислоты в стране вырос в три раза. В 1963 г. ...
... уксусная кислота применяется в химической, фармацевтической и легкой промышленности, а также в пищевой промышленности в качестве консерванта. Формула СН3СООН. Синтетическая пищевая уксусная кислота выпускается концентрированной (99.7 %) и в виде водного раствора (80 %). По физико-химическим показателям синтетическая пищевая уксусная кислота должна соответствовать следующим нормам: Таблица ...
... , похожих на лед; вследствие этого безводная уксусная кислота получила название ледяной уксусной кислоты. Уксусная кислота имеет большое народнохозяйственное значение. Она широко применяется в самых различных отраслях промышленности и в быту. В химической промышленности уксусная кислота используется для получения винилацетата, ацетата целлюлозы, красителей и многих других веществ. В виде солей ...
... группа в карбоксиле кислот может быть замещена различными атомами или группами (Х); образующиеся при этом вещества обычно называют функциональными производными карбоновых кислот; строение их может быть представлено общей формулой R—C—X II O Мы кратко рассмотрим образование и свойства таких производных кислот, или галогенангидриды, ангидриды, ...




0 комментариев