Навигация
Механизм реакции получения ацетальдегида
3. Механизм реакции получения ацетальдегида
Процесс синтеза ацетальдегида из этилена в присутствии палладиевого катализатора относится к гомогенно-каталитическим.
Гомогенные каталитические процессы, типа:
![]()
обычно начинаются с образования промежуточного комплекса Akt в результате обратимого воздействия между катализатором (kt) и одним из исходных реагентов (А):
![]()
Во второй стадии, образовавшийся промежуточный комплекс взаимодействует со вторым реагентом, образуя активированный комплекс [АВ]** kt:
![]()
В третьей стадии в результате распада [АВ]**kt образуются продукты реакции[20, с. 70]:
![]()
3.1 Механизм реакции
Каталитическое окисление этилена до ацетальдегида в гомогенном водном растворе на палладиево-медном катализаторе при 20—60°С известно как вакер-процесс, по названию компании, в которой в конце пятидесятых годов этот процесс был разработан Шмидтом. Этот процесс является одним из ранних примеров промышленного использования гомогенного катализа. В последующие годы значительное внимание исследователей было уделено реакционному механизму и возможностям влияния на состав образующихся продуктов
Стехиометрическая реакция, в которой Pd(II) восстанавливается до металла, была описана еще в 1894 г. Открытие Шмидта заключалось в том, что он сумел окислить Pd(0) действием CuCl2:
Pd° + 2CuCl2 ![]() PdCl2 + CuCl
PdCl2 + CuCl
Этот факт в сочетании с простым окислением соли меди кислородом или воздухом:
2CuCl + 2HCl + 1/2O2![]() 2CuCl2 + H2O;
2CuCl2 + H2O;
позволил использовать данную реакцию в промышленно важном производстве.
Общая реакция окисления этилена воздухом приведена в суммарном уравнении:
C2H4 + 1/2O2![]() CH3CHO
CH3CHO
Окисление Pd° ионом Cu2+ облегчается присутствием избытка ионов Сl, так как окислительный потенциал Pd°![]() Pd2+ существенно понижается при образовании хлоро-комплекса [PdCl4]2-, и делается возможным растворение металлического палладия.
Pd2+ существенно понижается при образовании хлоро-комплекса [PdCl4]2-, и делается возможным растворение металлического палладия.
Общая экспериментальная скорость определяется уравнением [21, с. 246]:
rOx= – d[C2H4]/dt=k[PdCl2-][C2H4]/[H+][Cl-] 2
На начальной стадии происходит очень сильное поглощение этилена, затем этилен поглощается медленнее. Объем поглощаемого вначале этилена превышает количество, необходимое для насыщения реакционного раствора этиленом (установлено в отсутствие палладиевой соли). Это четко свидетельствует об образовании этилен-палладиевого комплекса. Избыточный объем поглощаемого этилена уменьшается по мере увеличения в растворе концентрации ионов С1-но на него не влияет изменение концентрации кислоты. Довольно правдоподобное объяснение этого заключается в том, что начальную реакцию можно представить равновесной реакцией обмена лигандов:
[PdCl4]2- + C2H4![]() [PdCl3(C2H4)] - + Cl-
[PdCl3(C2H4)] - + Cl-
Очевидно, избыток С1- сдвигает равновесие влево. Последующее более медленное поглощение этилена определяется уравнением скорости, приведённым выше.
Если предположить, что плоскоквадратный комплекс [PdCl3(C2H4)]-является основным промежуточным соединением в общем процессе, то становится понятным дополни то становится понятным дополнительное ингибирование С1- ионами и Н+-ионами и результате следующих двух равновесий:
[PdCl3(C2H4)] - + H2O![]() [PdCl2(H2O)(C2H4)] + Cl-
[PdCl2(H2O)(C2H4)] + Cl-
[PdCl2(H2O)(C2H4)] ![]() [PdCl2(OH)(C2H4)]- + H+
[PdCl2(OH)(C2H4)]- + H+
Следующей, определяющей скорость реакции стадией, будет внедрение координационно связанного алкена в связь Pd—ОН с образованием палладийорганического промежуточного соединения:
[PdCl2(OH)(C2H4)]-![]() [PdCl2(CH2CH2OH)] -
[PdCl2(CH2CH2OH)] -
Затем быстрое разложение последнего продукта дает альдегид и металлический палладий:
[PdCl2(CH2CH2OH)] -![]() CH3CHO + Pd° + HCl + Cl-
CH3CHO + Pd° + HCl + Cl-
Детали именно этой реакции до сих пор являются предметом разнообразных спекуляций. Существует доказательство, что имеет место перенос водорода от β-атома углерода к α-атому углерода у палладия; предполагается также, что происходит взаимодействие металл—водород[21, с. 247]:
[PdCl2(CH2CH2OH)] -![]() H2C=CHOH
H2C=CHOH![]() [PdCl2(CH(CH3)OH)] –
[PdCl2(CH(CH3)OH)] –
Cl2PdH
![]() CH3CHO + Pd° + HCl + Cl-
CH3CHO + Pd° + HCl + Cl-
Похожие работы
... кислота производилась также пиролизом ацетона через кетен, окислением узких фракций бензина, а также выделением из продуктов окисления твердого парафина. В результате развития синтетических методов производства уксусной кислоты удельный вес их вырос с 50% в 1963 г. до 70% в 1965 г. и до 90% в 1970 г. За эти же годы общий объем производства уксусной кислоты в стране вырос в три раза. В 1963 г. ...
... уксусная кислота применяется в химической, фармацевтической и легкой промышленности, а также в пищевой промышленности в качестве консерванта. Формула СН3СООН. Синтетическая пищевая уксусная кислота выпускается концентрированной (99.7 %) и в виде водного раствора (80 %). По физико-химическим показателям синтетическая пищевая уксусная кислота должна соответствовать следующим нормам: Таблица ...
... , похожих на лед; вследствие этого безводная уксусная кислота получила название ледяной уксусной кислоты. Уксусная кислота имеет большое народнохозяйственное значение. Она широко применяется в самых различных отраслях промышленности и в быту. В химической промышленности уксусная кислота используется для получения винилацетата, ацетата целлюлозы, красителей и многих других веществ. В виде солей ...
... группа в карбоксиле кислот может быть замещена различными атомами или группами (Х); образующиеся при этом вещества обычно называют функциональными производными карбоновых кислот; строение их может быть представлено общей формулой R—C—X II O Мы кратко рассмотрим образование и свойства таких производных кислот, или галогенангидриды, ангидриды, ...


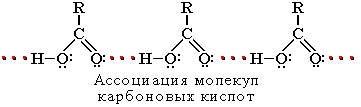


0 комментариев