Навигация
В программе HyperChem создается файл, полученный при выполнении команды Vibrations и содержащий набор частот колебательного спектра 224-tmp.log
5. В программе HyperChem создается файл, полученный при выполнении команды Vibrations и содержащий набор частот колебательного спектра 224-tmp.log.
6. В приложении Entropy с использованием подготовленных ранее файлов и в соответствии с рекомендациями разд. 2.5. рассчитываются составляющие энтропии. Необходимые для расчета молекулярные данные для 2,2,4-триметилпентана приведены в табл. 2.11. В ней даны: произведение главных центральных моментов инерции (IAIBIC) для наиболее устойчивого конформера; потенциальные барьеры вращения (Vr) и приведенные моменты инерции волчков (Ir); количество максимумов на потенциальных кривых вращения (nmax) и числа симметрии волчков (σ); номера частот, отвечающих за крутильные колебания волчков, исключенные из расчета колебательного вклада.
Таблица 2.11
Молекулярные данные 2,2,4-триметилпентана| Волчок | IAIBIC·10112 , г3/см6 | Vr, Дж/моль | Ir·1040, г/см2 | nmax | σ | ν |
| t-Bu | 1,575418 | 12472,08 | 80,51 | 6 | 3 | 1 |
| i-Pr | 21483,39 | 69,39 | 6 | 1 | 2 | |
| Me1(t-Bu) | 15523,51 | 5,324 | 3 | 3 | 4 | |
| Me2(t-Bu) | 12952,77 | 5,352 | 3 | 3 | 6 | |
| Me3(t-Bu) | 12859,60 | 5,334 | 3 | 3 | 7 | |
| Me4(i-Pr) | 12108,83 | 5,331 | 5 | 3 | 3 | |
| Me5(i-Pr) | 15357,90 | 5,342 | 3 | 3 | 5 |
Результаты расчета энтропии 2,2,4-триметилпентана представлены в табл. 2.12. Учитывая большое количество волчков в молекуле 2,2,4-триметилпентана и объемность некоторых из них, абсолютные значения энтропии при различных температурах рассчитаны без учета вклада на смешение конформеров. Для сравнения в табл. 2.11 приведены значения энтропии 2,2,4-триметилпентана, рекомендованные [1]. Ошибка расчета по методу статистической термодинамики возрастает с увеличением температуры от 298 до 600 К с -0,04 до -0,14 % отн. Зависимость ![]() от температуры для состояния идеального газа представлена на рис. 2.11.
от температуры для состояния идеального газа представлена на рис. 2.11.
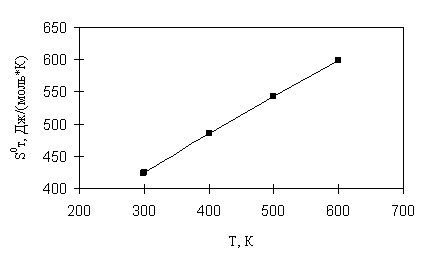
Рис. 2.11. Зависимость энтропии 2,2,4-триметилпентана от температуры
Таблица 2.12
Расчет энтропии 2,2,4-триметилпентана методом статистической термодинамики
| T, K | Вклады для расчета энтропии, Дж/(моль·К) |
Дж/(моль·К) |
Дж/(моль·К) | ||||
| -Rln(σ) |
|
|
|
| |||
| 298 | 0,00 | 167,83 | 120,66 | 92,14 | 42,40 | 423,03 | 423,21 |
| 300 | 0,00 | 167,97 | 120,75 | 92,51 | 42,99 | 424,22 | 424,38 |
| 400 | 0,00 | 173,95 | 124,33 | 110,69 | 75,91 | 484,87 | 485,97 |
| 500 | 0,00 | 178,59 | 127,12 | 124,73 | 113,11 | 543,55 | 544,59 |
| 600 | 0,00 | 182,38 | 129,39 | 135,59 | 152,01 | 599,37 | 600,24 |
Пример 2.7
Методом статистической термодинамики рассчитать ![]() п-трет-бутилфенола при температурах 298, 300, 400, 500 и 600 К.
п-трет-бутилфенола при температурах 298, 300, 400, 500 и 600 К.
Решение
1. Структурная формула молекулы рассматриваемого вещества такова:
2.
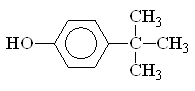
3. Вклад на симметрию ![]() молекулы рассчитывается исходя из симметрии наружного вращения п-третбутилфенола, равной 1, и симметрии п-фениленового фрагмента, имеющего ось симметрии второго порядка: –R×ln(1·2).
молекулы рассчитывается исходя из симметрии наружного вращения п-третбутилфенола, равной 1, и симметрии п-фениленового фрагмента, имеющего ось симметрии второго порядка: –R×ln(1·2).
Похожие работы
... статистической термодинамики до сих пор во многих случаях отдается предпочтение [1, 29] геометрическим параметрам молекул, вычисленным аддитивно. Привлекательность же аддитивных методов прогнозирования энтропии органических веществ, обусловленная несравнимо большей легкостью и доступностью их применения по сравнению с другими методами, является стимулом к их совершенствованию. Поэтому нами ...
... снятия вклада на межмолекулярные взаимодействия рассчитывалась бессимметрийная газофазная константа равновесия реакции . Давления насыщенного пара рассчитывались методом Ли-Кеслера [50] или по экспериментальным данным. Применение к расчету давлений насыщенного пара методики, описанной в главе 2.1, позволяет обеспечить погрешность расчета не более 10% отн. для всех давлений, приведенных в данной ...
... мере, синергетическим стилем мышления может быть некой платформой для открытого творческого диалога между учеными, мыслителями, деятелями искусства, имеющими различные творческие установки и взгляды на мир. 2. Некоторые парадоксальные следствия синергетики Множество новых парадоксальных идей, образов и представлений возникает в синергетике. Кроме того, с точки зрения синергетики может быть ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...






0 комментариев