Навигация
Вивід основного рівняння кінематичної теорії газів
2.1 Вивід основного рівняння кінематичної теорії газів
Розглянемо кубик із довжиною сторони l В кубику рухається N молекул, які створюють тиск р на грані. Маса газу рівна т
Оскільки тиск на стінки посудини є результатом ударів молекул, то при виведенні рівняння зробимотакі припущення:
швидкість руху всіх молекул однакова і дорівнює їх середній швидкості ш;
тиск молекул здійснюється паралельно до ребер кубика в трьох взаємноперпендикулярних напрямках.
Кожна молекулаггои ударі об стінку змінює свійнапрям на протилежний -ш і виникає зміна імпульсу сини:
![]()
Кожна молекула, якщо вона рукається з швидкістю w, за одиницю часу здійснить ![]() ходів. При кількості молекул N/3 сума імпульсів буде
ходів. При кількості молекул N/3 сума імпульсів буде
![]()
і буде рівна загальному тиску на грань:
![]()
![]()
де
![]() - число молекул в одиниці об'єму.
- число молекул в одиниці об'єму.
![]() , (2.1)
, (2.1)
Як уже відомо, кінетична енергія пропорційна абсолютній температурі газу:
![]() , (2.1а)
, (2.1а)
а - коефіцієнт пропорційності.
Якщо помножити ліву і праву частини рівняння (2.1) на повний об'єм газу V і підставити замість ![]() його значенняз (2.1а), то одержима
його значенняз (2.1а), то одержима
![]() ,
,
де
nV=N,
![]() ;
;
р∙V=m∙R∙T , (2.2)
де R -питома газова стала.
Рівняння одержало назву - рівняння стану ідеального газу, або рівняння Клапейрона. Із рівняння (22) можна одержати відомі закони для ідеальних газів:
при Т= const - закон Бойля-Маріотта; р = const - закон Гей-Люсака;
V=cons t- закон Шарля.
2.2 Газова стала та її фізична суть
Якщо уявити собі, що газ вагою 1 кг при тиску р вміщений в об'єм абсолютно довільної форми, то при нагріванні з об'єму ν1 перевде в об'єм ν2. При цьому виконається робота рівна сині на шлях (рис 2.1):
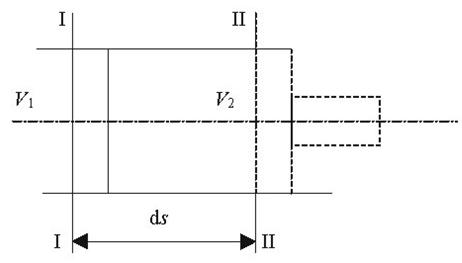
Рис2.1. До вияснення фізичного змісту газової сталої.
dL=dF∙p∙dS
де dF∙p - сила,
dF -площа,
dS – шлях
Але dF∙dS=dv, тоді
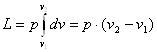 (2.3)
(2.3)
До початку розширення характеристичне рівняння матиме такий вигляд:
p∙v1=R∙T1 (2.4)
в кінці:
p∙v2=R∙T2 (2.5)
Із рівняння (2 3), (2.4) і (2.5):
![]()
Газова стала являє собою роботу розпилення, яку виконує 1кг газу при нагріванні на 10 С при р=const.
Італійський вчений Авогадро довів, що при однакових температурах і тисках в рівних об'ємах ідеальних газів міститься однакова кількість молекул, абої моль газу при нормальних умовах займає однаковий об'єм.
Для одного моля газу:
p∙Vm=μ∙R∙T
![]()
де Vт - об'єм однієї молекули;
м - молекупярна маса.
мR=R0 -універсальна газова стала. При нормальних умовах
(Р= 101325 Па, Т=273,15 К, Vm = 22,4∙10-3 м3/моль
R0=8314 Дж/моль∙К)
Знаючи універсальну газову сталу можна визначити питому:
R = 8314/μ.
3. Суміші ідеальних газів
Під газовою сумішшю розуміють суміш окремих газів, які не вступають з собою в хімічні реакції.
Кожній із газів, які входять в суміш можна розглядати як ідеальний газ і саму суміш можна розглядати як ідеальний газ. Англійський фізик Дапьтон сформулював в 1809 році наступний закон для суміші ідеальних газів: кожний із компонентів газової суміші поширений в цілому об'ємі простору, займаючи весь простір, при те маературі суміші.
Із вищесказаного можна зробити наступні висновки:
кожний газ, якш входить в суміш, має таку жтемпературуякі вся суміш;
кожний з газів займає об'єм, який займає суміш;
кожний з газів підпорядковується своєму характеристичному рівнянню, а суміш - своєму характеристичному рівнянню стану;
загальній тиск суміші газів рівний суміші парціальних тисків окремих газів, які складають суміш.
Р=Р1+Р2+...+Рп
де р1,р2,рз, ...рп -парціальний тиск окремих компонентів газу.
Парціальний тиск -це тиск, який ои мав кожний газ, що входить в суміш, коли б цей газ знаходився один в тій же кількості і займав той же об'ємі при тій же температурі, що і суміш.
Склад газової суміші визначають ваговими, об'ємними або мольними частками.
Масовою або ваговою часткою називається відношення маси окремого компоненту газу до маси всієї суміші.
![]()
де m1, m2…mn -маса окремого компоненту. т - мас а суміші.
g1+g2 +…+gn=1
Об'ємною часткою називається відношення парціального об'єму окремого компонента газу до загального об'єму суміші газів.
Парціальним об'ємом газу називається об'єм, який займав би цей газ, якщо б він знаходився при температурі і тиску суміші.
![]()
де V1, V2…Vn - парцальнийоб'єм окремого компоненту,
V - об'єм суміші.
r1+r2 +…+rn=1
Мольною часткою називається відношення кількості молей окремого компоненту газу до кількості молей всієї суміші.
![]()
де n1, n2…nn -кількість молей окремого компоненту,
n-кількістьмолей суміші.
Задання суміші мольними частками рівносильнезаданнюїї об'ємними. Молекулярна маса суміші:
μсум=r1μ1+r2 μ2+…+rnμп, (3.1)
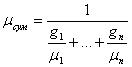 (3.2)
(3.2)
Газова постійна суміші:
![]()
Допустимо, що ми маємо суміш газів mсум
Складові частини лзі, т1, т2 .
P1∙Vсум=m1∙R1∙Tсум
P2∙Vсум=m2∙R2∙Tсум
Pn∙Vсум=mn∙Rn∙Tсум
(P1+P2 +…+Pn) Vсум = (m1∙R1+…+ mn∙Rn) Tсум
Pсум ∙Vсум=(m1∙R1+…+ mn∙Rn) Tсум
З іншої сторони:
Pсум ∙Vсум= mсум∙Rсум Tсум
Оскільки ліві частини рівнянь рівні, топовий бути рівні і праві:
mсум∙Rсум Tсум=(m1∙R1+…+ mn∙Rn) Tсум
![]()
Rсум=g1R1+...+gnRn (3.3)
Зв'язок між масовими та об'ємними частками можна встановити наступним чином:
![]()
або:
![]() (3.4)
(3.4)
Для перерахунку масових часток в об'ємі використовують наступні співвідношення:
![]()
але:
![]()
тоді:
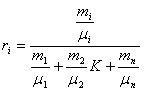
розділивши чисельник і зна менннк на mсум, одержимо
 (3.5)
(3.5)
Похожие работы
... мислення, сприяє формуванню творчого відношення до праці, вчить бережливому відношенню до матеріалів, енергії, техніки, сировини, готових продуктів праці. Загальнотехнічна підготовка є ланкою між політехнічною освітою та спеціальною частиною професійно-технічної навчання і покликана озброїти тих, що навчаються системою знань загальних основ техніки, технології та організації виробництва і праці ...
... д. цих циклів менший від термічного к. к. д. циклу Карно. Відомо, що під час досліджень термодинамічних процесів умови, за яких вони відбуваються, беруть ідеальними. Розглянемо ідеальні термодинамічні цикли двигуна внутрішнього згоряння. Припустимо, що: 1) кількість і склад робочого тіла в циклі не змінюються; 2) процеси згоряння палива і вихлоп газу замінено підведенням та відведенням теплоти ...
... вивчення. Для зменшення числа програм у розумних межах і упорядкування їхнього змісту доцільно групувати професії, підготовлювані в середніх профтехучилищах, на основі спільності предметів. Аналітичний розгляд вимог виробництва до загальнотехнічної підготовки молодих робітників — перший крок по шляху кваліфікації професій у залежності від сполуки загальнотехнічних предметів і їхнього основного ...
... факторів, як технічний рівень виробництва й рівень організації праці. Як показує проведений аналіз, підвищення продуктивності праці в ЦГПТЛ протягом І півріччя відбувалося під впливом як екстенсивних, так і інтенсивних факторів. 3.2.2 Продуктивність праці в мартенівському цеху комбінату «Запоріжсталь» Головним показником, що характеризує роботу мартенівської печі, є її продуктивність. Під ...
0 комментариев