Навигация
Реальні гази
9. Реальні гази
Реальні гази відрізняються від ідеальних тим, що молекули щх газів мають кінцеві власні об'єми і зв'язані між собою силами взаємодії, які мають електромагнітну і квантову природу. Рівняння стану РV= RТ для реальних газів не виконується
![]() .
.
де С - коефіцєнт стисливості - виражає відхилення властивостей реального газу від властивостей ідеального газу.
Суттєвою відмінністю реального газу від ідеального є також те, що реальний газ в залежності від зовнішніх умов може знаходитися в газоподібному, рідкому і твердому агрегатному стані.
Згідно правила фаз Гіббса, число інтенсивних параметрів стану N (тиск, температура, концентрація), які можуть незалежно змінюватись без зміни фаз, складає
N=m-r+2
де т -число компонентів,
r - число фаз.
Тому для чистої речовини (т = 1) в однофазному стан (r= 1) може незалежно мінятися два параметри (тиск і температура), в двофазному (r = 2) - один параметр, в трифазному (r = 3) N = 0, тобто три фази можуть знаходитись в рівновазі тільки при визначенійтемпературі і тиску (потрійна точка води).
Ван-Дер-Ваальс ввів дві поправки, які враховують відхилення реального газу від ідеального.
Перша поправка - враховує об'єм, який займають молекули.
З рівняння Кл апейрона одержуємо
![]()
При зростанні .Рдонескінченності, впадає до нуля. Для реального газу найменший об'єм рівний об'єму молекул vмол плюс об'єм проміжку між молекулами vгаз
b - найменша величина, до якої можна стиснути газ
b= vмол+ vгаз
Тоді вільний об'єм буде рівний
![]()
При Р →∞, v→b або v-b = 0.
Оскільки тиск ідеального газу за рівнянням Клапейрона визначається як
![]()
а для реального,
![]()
то при однаковій температурі тиск в реальних газах буде більший.
Друга поправка враховуєвплив сил взаємодії між молекулами.
В реальному газі син а ударів об стінку посудини буде менша в результаті того, що всі молекули гритягуються спідніми Поправка ∆Р пропорційна як числу молекул притягуючих, так і тих, що притягуються, тобто пропорційна квадрату густини газу, або обернено пропорційна квадрату його питомого об'єму.
∆p=aρ2=a/v2
де а -коефіцієнт пропорційності, який не залежить від параметрів стану. Враховуючи другу поправку, одержимо
P=RT/(v-b)- ∆p (9.1)
або
(p+ a/v2)(v-b)=RT
- рівняння Ван- Дер-Ваальса.
Вираз a/v2 називають внутрішнім тиском. Для води при t = 295°К
(20 °С) a/v2→1080МПа.
Рівняння можна використовувати длядвофазних станів. .Якщо розкрити дужки і розміститипо степенях v, одержимо:
pv3-(bp+RT)v2+av-ab (9.2)
Можливі випадки:
а)всі трикорені різні ідійсні;
б)всі три корені дійсні і рівні між собою;
в)один корінь дійсний і дв а уявні.
.Якщо в рv - діаграмі побудувати ізотерми, які відповідають рівнянню
Ван-Дер-Ваальса, то вони будуть мати внгляд показаний на рис. 9.1:
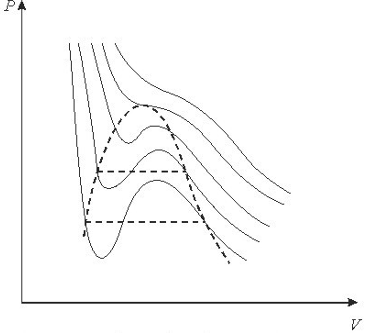
Рис. 9.1 Ізотерми, побудовані зарівняннямВан-дер-Ваапьса.
Рівняння Ван-Дер-Ваапьса при великих гу:тннах газу дає значні похибки в зв'язку з тим, що гши його виеедеіні не враховується силова асоціація і дисоціація молекул.
Молекули утворюють комплекси із двох - трьох молекул і така частинка ведесебеяк окремий газ, а реальний газ-як суміш газів, які склад аються із одиночних, подвійних і трійних комплексів. Це дозволяє врахувати рівняїня, запропоноване Вукалович ем і Новиковим.
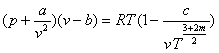
де с і m -визначаються дослідним шляхом
Розвиток кінетичної теорії газів дозволив встановити точне рівняння стану реальних газівв такомувигляді:
![]()
де В, v - варіальні кофіцієнти, які виражаються через потенціальну енергію взаємодії і температуру Т. v = 2, 3, 4 - порядковий номер варіапьного кофіцієнгу. Рівняння для зручності спрощують.
![]()
Де А і В -стільки функціями температури.
Суттєвою відмінністю реального газу від ідеального є те, що реальний газ може переходити із одного агрегатного стану в інший.
Криві фазових переходів в РІ координатах мають вигляд пжазаний на рис.9.2:
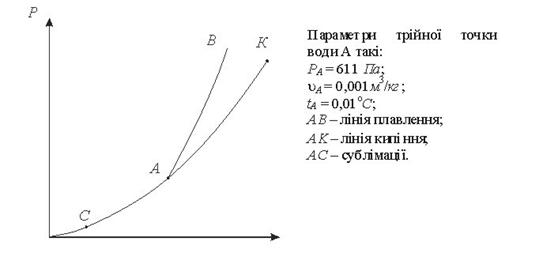
Рис. 9.2 Р t - діаграма води
Якщо стискати газ при постійній температурі t<tкр то при деякому тиску точка ) починається зрідження газу. При подальшому стисканні газ перетворюється в рідину. Процес конденсації проходить при постійному тиску. При подальшому стисненні тиск в рідині різко росте. Таке явице спостерігається і дгтяіншнхізотермпри t<tкр.
Для зображення процесів в реальних газах використовують рv, Тs
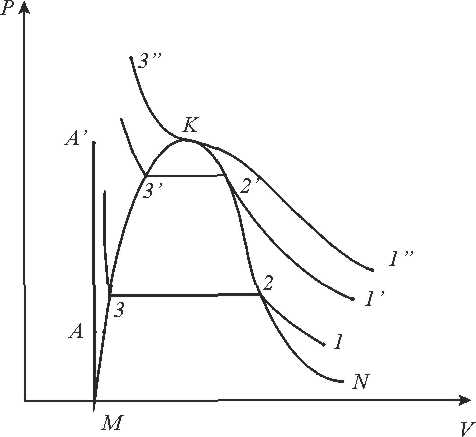
Рис. 9.3 рv - діаграма.
З'єднуючи точки горизонтальних кривих, одержимо лінії, які сходяться в точці К.
Лівіше лінії МК існує тільки рідка фаза, правіше лінії КN - тільки газ. Між пограничними кривими знаходиться область двофазного стану рідина -газ. Важливе значення в термодинаміці має існування критичної точки і критичних параметрів, які визначаються експериментально.
Можна отримати єдине рівняння стану в вигляді універсальної функції від безрозмірних параметрів
![]() ;
; ![]() ;
; ![]()
Які називаютьсяпрнведеним тиском, температурою і об'ємом.
Тоді рівняння Ван-Дер-Ваальса має вигляд
![]()
Стани речовин, коли вони мають одинакові приведені пара метри, називаються відповідними станами.
Речовини, які знаходяться в відповідних станах, називаються термодинамі чно подібними.
Похожие работы
... мислення, сприяє формуванню творчого відношення до праці, вчить бережливому відношенню до матеріалів, енергії, техніки, сировини, готових продуктів праці. Загальнотехнічна підготовка є ланкою між політехнічною освітою та спеціальною частиною професійно-технічної навчання і покликана озброїти тих, що навчаються системою знань загальних основ техніки, технології та організації виробництва і праці ...
... д. цих циклів менший від термічного к. к. д. циклу Карно. Відомо, що під час досліджень термодинамічних процесів умови, за яких вони відбуваються, беруть ідеальними. Розглянемо ідеальні термодинамічні цикли двигуна внутрішнього згоряння. Припустимо, що: 1) кількість і склад робочого тіла в циклі не змінюються; 2) процеси згоряння палива і вихлоп газу замінено підведенням та відведенням теплоти ...
... вивчення. Для зменшення числа програм у розумних межах і упорядкування їхнього змісту доцільно групувати професії, підготовлювані в середніх профтехучилищах, на основі спільності предметів. Аналітичний розгляд вимог виробництва до загальнотехнічної підготовки молодих робітників — перший крок по шляху кваліфікації професій у залежності від сполуки загальнотехнічних предметів і їхнього основного ...
... факторів, як технічний рівень виробництва й рівень організації праці. Як показує проведений аналіз, підвищення продуктивності праці в ЦГПТЛ протягом І півріччя відбувалося під впливом як екстенсивних, так і інтенсивних факторів. 3.2.2 Продуктивність праці в мартенівському цеху комбінату «Запоріжсталь» Головним показником, що характеризує роботу мартенівської печі, є її продуктивність. Під ...
0 комментариев