Навигация
Аналв основних термодинамічних процесів ідеального газу
8. Аналв основних термодинамічних процесів ідеального газу
Задачею аналізу будь-якого термодинамічного гроцесу є встановлення закономірностей зміни параметрів стану робочого тіла та виявлення особливості перетворення енергії.
З цією метою проводяться наступні операції:
виводиться рівнянняпроцесув р-v-координатах;
встановлюється залежність міжзмінюваннми параметрами в процесі;
визначається зміна внутрішньої енергії ∆u;
визначаєтьсятермодннамічна робота газу l;
визначаєтьсязовнішнятеплота q,необхідна дляздійсненняпроцесу.
Одночасно знаходиться зміна ентальпії ∆h та ентропії ∆s між початковим та кінцевим станами процесу. Отримані таким чином дані дозволяють розглянути особливості перетворення енергії в процесі та скласти схему енергобалансу.
З багатоманітності можливих процесів для аналізу вибираються спочатку простіші, чи так звані основні процеси: при постійному об'ємі (ізохорний), при постійному тиску (ізобарний), при постійній температурі (ізотермічний), а такожпроцес беззовнішньоготеплообміну (адіабатний).
Перш ніж приступити до аналізу основних термодинамічних процесів, слід звернути звагу на те, що внутрішня енергія та ентальпія є функціями стану та їх зміна не залежить від характеру процесу. Тому можна отримати розрахункові вирази для обчислення їх зміни, які будуть справедливі для будь -яких процесів з ідеальним газом.
Враховуючи, що в ізохорному процесі dv = 0, pdv= 0, вираз першого закону термодинаміки (4.3) для ізохорного пр оцесу прийме вигляд
qv=∆u
Одначе кількість теплоти можна виразититакожчерезтеплоємність
qv=cvm(t2-t1) (8.1)
Отже,
∆u=cvm(t2-t1) (8.2)
або
du=cvdt (8.3)
З виразу першого закону термодинаміки для ізобарного процесу (4.5) випливає, що
dqp=dh (8.4)
або
qp=h2-h1 (8.5)
Одначе
qp= cpm(t2-t1) (8.6)
Тоді
∆h= cpm(t2-t1) (8.7)
Або
dh=cpdt (8.8)
Таким чином, вирази (8.2) та (8.7) придатні для обчислення зміни внутрішньої енергії та штальпії в будь-якому процесі ідеального газу.
Можна також отримати загальні вирази для обчислення зміни ентропії в процесах змі ни стану ідеальних газів.
Враховуючи, що
![]()
підставимо значення dq з (4.3) та (4.5), отримаємо:
![]()
![]()
Замінившив цих виразах du з (8.3) та dh з (8.8) та враховуючи, що
![]()
![]()
Отримаємо:
![]() (8.9)
(8.9)
![]() (8.10)
(8.10)
Інтегруючи ці диференціалші рівняння, отримаємо :
![]() (8.11)
(8.11)
![]() (8.12)
(8.12)
8.1 Ізохорний процес(v =const)
В р - v -координатах графік процесу являє собою пряму лінію
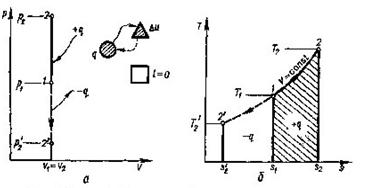
Рис. 8.1.1. Зоораженняізохорногопроцесу
В РV і ТS-координатах. паралельну осі р (рнс.8.1.1 а), причому процес може протікати з підвищенням (процес 1-2) тапониженнямтиску (процес 1-2').
Виписавши для крайніх точок 1 та 2 рівняння стану та поділивши їх почленно, отримаємо залежність між параметрами газу в ізохорному процесі:
p1v=RT1 p2v=RT2
або
![]() (8.13)
(8.13)
В ізохорному процесі dv=0 і робота не виконується (lv=0). Томувся теплота витрачається тільки на зміну внутрішньої енергії:
qv=∆u=cvm(t2-t1)
Зміна ентальпії може бути знайдена із загального виразу для всіх процесів (8.7).
Вираз для зміни ентропії в ізохорному процесі можна отримати із загального співвідношення (8.11), прийнявши v1=v2
![]() (8.14)
(8.14)
чи з врахуванням (8.12)
![]() (8.15)
(8.15)
Із (8.14) випливає, що між ентропією та температурою існує логарифмічна залежність . На Т- s - діаграмі ця залежність зображується кривою 1-2 ( рис. 8.1.1,6).
8.2 Ізобарний процес (р=сопst)
В р-v -координатах процес позначається прямою 1-2 ( рис. 8.2.1, а). Записавши рівняння стану для двох точок процесу.
pv1=RT1 pv2=RT2
та розділивши почленно друге на перше, отримаємо залежність між параметрами.
![]() (8.16)
(8.16)
Зміна внутрішньої енергії визначається за загальним виразом (8.1). Робота процесу, віднесена до 1 кг газу:
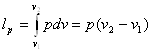 (8.17)
(8.17)
Так як для ідеального газу
pv2=RT2 pv1=RT1
то
lp=R(T2-T1) (8.18)
Кількістьтегтотнв ізобащомупроцесі може бути обчислена за(8.5)
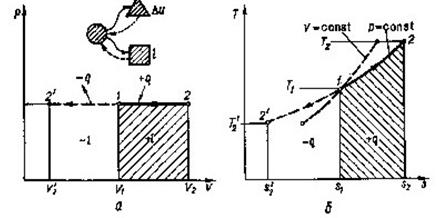
Рис 8.2.1. Зображення ізобарного процесу в РV і ТS-діаграмах.
qp=∆h=(h2-h1) (8.19)
тобто кількість теплоти в ізобарному процесі рівна зміні ентальпії.
Однач є, згідно (8.6):
qp=cpm(t2-t1)
тобто
∆h=cpm(t2-t1) (8.20)
А оскільки ентальпія є параметром стану, то в любому термодинамічному процесі ∆h можна визначитиза формулою (8.20).
Зміну ентропії в ізобарному процесі можна визначити із загального виразу (8.12),прийнявши р1 = р2,
![]() (8.21)
(8.21)
чи, враховуючи (8.16):
![]() (8.22)
(8.22)
Отже, в Т-s -координатах ізобара - логарифмічна крива (рис.8.2.1, б. пунктиром нанесена ізохора). Оскільки ср >сv, то з порівняння (8.14) та (82.1)
видно, що ізобара розташована більш полого, ніжізохора.
8.3 Ізотермічний проце с (Т = сопst)
Рівняння процесу отримаємо із рівняння стану рv = RT
рv = сопst (8.23)
В р-v - координатах ізотерма зобразиться рівнобокою гіперболою (рис. 8.3.1,а). Зв'язок мі ж параметрами встановлюється з рівняння процесу(8.23).
p1v1= p2v2 ![]()
Зміна внутрішньої енергії та ентальпії для ідеального газу в ізотермічному процесі рівна нулю (du = 0 та dh = 0)9 оскільки dТ = 0. Отже, вся підведена в процесі теплота витрачається тільки на роботу. Робота в процесі визначається за (4.4) шляхом заміни
![]()
з рівняння стану.
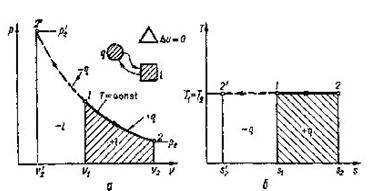
Рис 8.3.1. Зображення ізотермічного процесу в РV і ТS-діаграмах
Після інтегрування
dlT=pdv
одержимо:
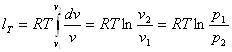 (8.23)
(8.23)
Теплота, необхідна для здійснення процесу, згідно (4 3)
![]() (8.24)
(8.24)
чи на основі (6.1)
δq=Tds
qT=T(s2-s1) (8.25)
Вираз для зміни ентропії в ізотермічно му процесі може бути отриманий із (8.24) та (825)
![]() (8.26)
(8.26)
Графік ізотермічного процесу в Т-s-координатах приведений на рис. 8.3.1,6.
Похожие работы
... мислення, сприяє формуванню творчого відношення до праці, вчить бережливому відношенню до матеріалів, енергії, техніки, сировини, готових продуктів праці. Загальнотехнічна підготовка є ланкою між політехнічною освітою та спеціальною частиною професійно-технічної навчання і покликана озброїти тих, що навчаються системою знань загальних основ техніки, технології та організації виробництва і праці ...
... д. цих циклів менший від термічного к. к. д. циклу Карно. Відомо, що під час досліджень термодинамічних процесів умови, за яких вони відбуваються, беруть ідеальними. Розглянемо ідеальні термодинамічні цикли двигуна внутрішнього згоряння. Припустимо, що: 1) кількість і склад робочого тіла в циклі не змінюються; 2) процеси згоряння палива і вихлоп газу замінено підведенням та відведенням теплоти ...
... вивчення. Для зменшення числа програм у розумних межах і упорядкування їхнього змісту доцільно групувати професії, підготовлювані в середніх профтехучилищах, на основі спільності предметів. Аналітичний розгляд вимог виробництва до загальнотехнічної підготовки молодих робітників — перший крок по шляху кваліфікації професій у залежності від сполуки загальнотехнічних предметів і їхнього основного ...
... факторів, як технічний рівень виробництва й рівень організації праці. Як показує проведений аналіз, підвищення продуктивності праці в ЦГПТЛ протягом І півріччя відбувалося під впливом як екстенсивних, так і інтенсивних факторів. 3.2.2 Продуктивність праці в мартенівському цеху комбінату «Запоріжсталь» Головним показником, що характеризує роботу мартенівської печі, є її продуктивність. Під ...
0 комментариев