Навигация
Адіабатний процес
8.4 Адіабатний процес
Адіабатним називається такий процес, при якому робоче тіло не обмінюється теплотою з навколишнім середовищем (q = 0; dq = 0).
Рівняння адіабатного процесу в р-v- координатах може бути отримано, якщо використовувати вирази першого закону термодинаміки (4.3) і (4.5) та врахувати особливості ідеального газу:
dU=cvdT dh=cpdT
Тоді:
dq=cvdT+pdv=0 або cvdT=-pdv
dq=cpdT+vdp=0 або cpdT=vdp
Звідки
![]()
або
![]()
Проінтегрувавши останній вираз, отримаємо рівняння процесу k∙lnv+lnp=0:
рvk =сопst,(8.27)
де к - показник адіабати.
В р-v- координатах адіабата зображується нерівнобокою гіперболою (рис.8.4.1,а ), що проходить трохи крутіше ізотерми. Зв'язок між параметрами р і v виходить з рівняння процесу (8.27):
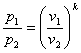 (8.28)
(8.28)
Для двох точок процесу напишемо рівняння стану:
p1v1=RT1 p2v2 =RT2
звідки
![]() (8.29)
(8.29)
Підставивши відношення тисків з (8.28), отримаємо залежність між Т і v
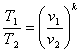 (8.30)
(8.30)
Розв'язавши спільно рівняння (8.30) і (8.29) отримаємозапежність між р і Т
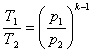 (8.31)
(8.31)
Зміна внутрішньої енергії визначається за загальним виразом (8.2); формула для роботи в процесі може бути отримана з (43):
δlq=-du або lq=-(u2-u1) (8.32)
тобто в адіабатному процесі робота здійснюється за рахунок зміни внутрішньої енергії.
З врахуванням (8.2) вираз (8.32) прийме вигляд
lq=-cvm(T2-T1)= cvm(T1-T2) (8.33)
чи з врахуванням (5.4) і
![]()
![]() (8.34)
(8.34)
За мінивши з рівнянь стану Т1 і Т2 отримаємо
![]() (8.35)
(8.35)
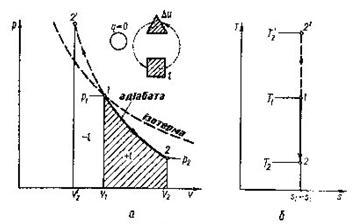
Рис. 8.4.1. Зображення адіабатного гроцесу в РV і ТS-координатах.
Перетворимо рівняння (8.34)з врахуванням (8.31)
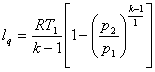 (8.36)
(8.36)
Зміна ентаттьпії в адіабатному процесі підраховується по (8.7). Зміна ентропії рівна нулю, такяк за визначенням процесу q = 0 і
ds=![]() = 0.
= 0.
Відповідно, s = сопst. Тому адіабатний процес називають ізоентропійним процесом.
В Т-s-координатах адіабата зображується вертикальною прямою (рис.8.4.1,б).
8.5 Політропнийі процесс
Любий самовільний процес зміни стану робочого тіла, що проходить при постійнійтеплоємності, називається політропним.
Рівняння політропното процесу може бути одержано з рівняння першого закону термодинаміки для ідеального газу:
dq=cvdT+pdv
dq=cрdT-vdp
Кількість підведоіої теплоти для політропного процесу
dq=cпdT (8.37)
де сп- теплоємністьполітропногопроцесу. Тоді рівняння першого закону термодинаміки для політропного процесу:
cпdT=cvdT+pdv
cпdT=cрdT-vdp
або
(cп-cv)dT=pdv
(cп-cp)dT=-vdp
Розділивши другерівняння на перше, одержимо:
![]()
Позначимо величину ![]() - постійну для даного процесу, через n
- постійну для даного процесу, через n
Тобто ![]() = п. (8.38)
= п. (8.38)
Одержима
![]() (8.39)
(8.39)
а після розділ ення змінних:
![]()
інтегрування отримаємо рівняння політропного процесу
Величина п, залежна від теплоємності процесу сп, називається показником політропи. Будучи постійним для конкретного процесу, показник політропи визначає його характер.
Політропний процес є узагальнюючим; розглянуті вище процеси є його частковими випадками.
Дійсно, зрівняння рvп = сопst при різних пмаємо:
n=0 рv0=p= сопst- ізобаричний процес;
n = ±∞ v=сопst - ізохоричний процес;
n=1 рv=сопst -ізотермічний процес;
n=k рvk=сопst - адіабатичний процес.
Зв'язок між параметрами р,v,Т і вирази для роботи в політропному
процесі аналогічні таким же в адіабатному процесі, так як рівняння попітропного процесу співпадає по формі з рівнянням адіабатного гроцесу, в якому показник к за мінений показником п :
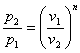 ;
; 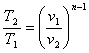 ;
; 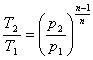 (8.40)
(8.40)
Це ж відноситься і до виразів для визначення роботи в політропному процесі:
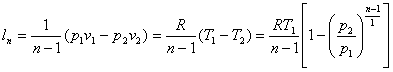
Зміна внутрішньої енергії в політропному процесі визначається по загальному виразу для ідеальних газів (8.2). Кількість тепла в процесі може бути обчислена на підставі математичного виразу першого закону термодинаміки (43)
![]() (8.41)
(8.41)
або,виходячи зуявленняпро теплоємність в процесі
![]() (8.42)
(8.42)
Вираз для теплоємності в політропному процесі отримаємо з (8.38)
![]() (8.43)
(8.43)
Показник політропн п може бути обчислений, якщо відомі р і v в двох точках процесу. Тоді з рівняння (8.40) одержуємо:
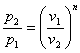
або
![]()
Звідки
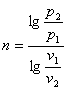 (8.44)
(8.44)
Зміну ентропії в політропному процесі може бути знайдено на основі (5.9) і (8.42):
![]() (8.45)
(8.45)
Інтегруючи цей вир аз отримаємо
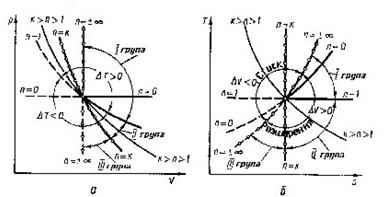
Рис 8.5.1 Зображення процесів в РV і TS координатах.
Щоб прослідкувати за розміщенням політропних процесів прн різних значеннях п в р-v і Т - s-координатах, на діаграми наносять криві окремих процесів, за якими можна визначити відносне розміщення політроп при різннх п а також знайти знак для q і ∆и в цих процесах (рис 8.5.1). Наприклад, графік паштропного процесу з показником попітрспн к>п>1 проходить між n=1 і п = к, причому при розширенні в цьому процесі теплота підводить ся (так як Д? >0), температура і внутрішня енергія зменшуються.
Характерно, що всі політропні процеси розширення (∆s>0) можна розбити натри типові групи, кожна з яких має спільну схему енергобалансу. В кожній групі процесів особливості перетворення енергії являються загальними, але кількісний розподіл трьох складових балансу енергії змінюється. В табл. 1.1 приведені особливості трьох груп політропних процесів розширення (∆и>0 ). Аналогічно можна розбити на три групи всі політропні процеси стиску (∆и <0).
Таблиця 8.5.1. Групи політропних процесів.
| Група | Межа зміни показника політропи | ∆и | q | Теплоємність в процесі | Схема енергобалансу |
| 1 | 1>n>-∞ | ∆и >0 | q>0 | Сn>0 | 1 |
| 2 | к>п> 1 | ∆и <0 | q>0 | Сn <0 | 2 |
| 3 | +∞>n>к | ∆и <0 | q<0 | Сn >0 | 3 |
Обмін енергією в термодинамічному процесі.
![]()
Похожие работы
... мислення, сприяє формуванню творчого відношення до праці, вчить бережливому відношенню до матеріалів, енергії, техніки, сировини, готових продуктів праці. Загальнотехнічна підготовка є ланкою між політехнічною освітою та спеціальною частиною професійно-технічної навчання і покликана озброїти тих, що навчаються системою знань загальних основ техніки, технології та організації виробництва і праці ...
... д. цих циклів менший від термічного к. к. д. циклу Карно. Відомо, що під час досліджень термодинамічних процесів умови, за яких вони відбуваються, беруть ідеальними. Розглянемо ідеальні термодинамічні цикли двигуна внутрішнього згоряння. Припустимо, що: 1) кількість і склад робочого тіла в циклі не змінюються; 2) процеси згоряння палива і вихлоп газу замінено підведенням та відведенням теплоти ...
... вивчення. Для зменшення числа програм у розумних межах і упорядкування їхнього змісту доцільно групувати професії, підготовлювані в середніх профтехучилищах, на основі спільності предметів. Аналітичний розгляд вимог виробництва до загальнотехнічної підготовки молодих робітників — перший крок по шляху кваліфікації професій у залежності від сполуки загальнотехнічних предметів і їхнього основного ...
... факторів, як технічний рівень виробництва й рівень організації праці. Як показує проведений аналіз, підвищення продуктивності праці в ЦГПТЛ протягом І півріччя відбувалося під впливом як екстенсивних, так і інтенсивних факторів. 3.2.2 Продуктивність праці в мартенівському цеху комбінату «Запоріжсталь» Головним показником, що характеризує роботу мартенівської печі, є її продуктивність. Під ...
0 комментариев