Навигация
Моделирование термодинамических свойств системы Cu – Ni
1.4 Моделирование термодинамических свойств системы Cu – Ni
Условно обозначим медь, как компонент 1, а никель – как компонент 2.
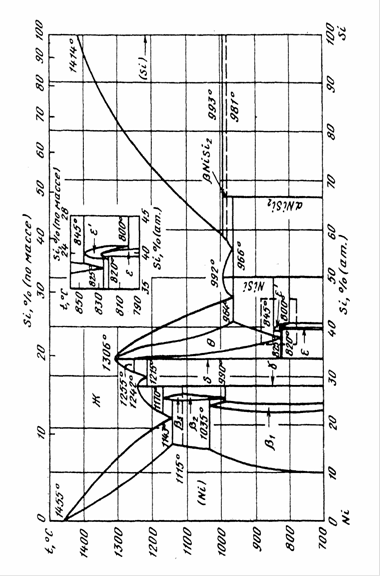
Рассмотрим низкотемпературную часть диаграммы Cu – Ni (см. рис. 1.1.). Ниже линии солидуса образуется ряд непрерывных твёрдых растворов с решёткой ГЦК. Однако при температурах ниже 342 °С наблюдается купол расслаивания на твёрдый раствор на основе меди (обозначим его, как α-фазу) и твёрдый раствор на основе никеля (обозначим его, как γ-фазу). Внутри купола находится смесь этих фаз.
На границе купола α-фаза находится в равновесии с γ-фазой. Это можно записать следующими уравнениями:
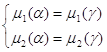 (1.8)
(1.8)
Для любого из компонентов 1 и 2 и в α- и в γ-фазе справедливо соотношение:
![]() (1.9)
(1.9)
Обе фазы имеют одинаковую структуру (ГЦК). Это можно объяснить высоким сродством меди и никеля. На диаграмме состояния (рис. 1.1.) видно, что сплав плавится конгруэнтно во всём диапазоне концентраций. Более того, линии ликвидуса и солидуса расположены очень близко друг к другу, то есть плавление происходит почти в изотермических условиях, как у чистого металла. Аналогично происходит и испарение сплава.
На основании этого можно записать, что:
![]() (1.10)
(1.10)
Тогда система (1.8) перепишется в виде:
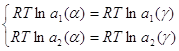 (1.11)
(1.11)
Обозначим через х мольные доли компонентов в α-фазе, а через N – мольные доли компонентов в γ-фазе, и учитывая условия нормировки их на единицу, можно систему уравнений (1.11) с учётом (1.4) и (1.7) переписать в следующем виде:
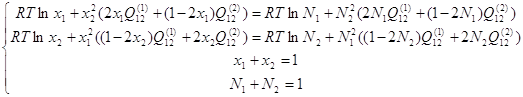 (1.12)
(1.12)
Координаты купола расслаивания при различных температурах сняты с диаграммы состояния Cu – Ni (рис. 1.1) и представлены в табл. 1.6.
Табл. 1.6. Координаты купола расслаивания твёрдого раствора при различных температурах
| t, oC | Состав α-фазы (Cu) | Состав γ-фазы (Ni) | ||
| x1 | x2 | N1 | N2 | |
| 200 | 0,650 | 0,350 | 0,013 | 0,987 |
| 225 | 0,633 | 0,367 | 0,027 | 0,973 |
| 250 | 0,580 | 0,420 | 0,053 | 0,947 |
| 275 | 0,513 | 0,487 | 0,073 | 0,927 |
| 300 | 0,467 | 0,533 | 0,113 | 0,887 |
| 325 | 0,387 | 0,613 | 0,187 | 0,813 |
| 342 | 0,300 | 0,700 | 0,300 | 0,700 |
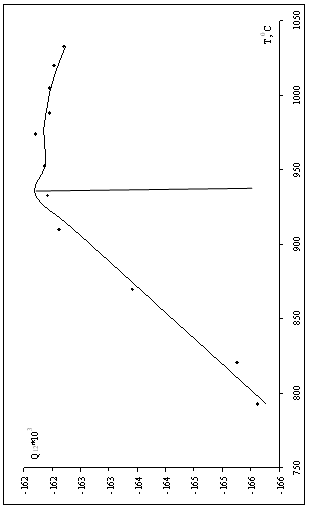
Для каждой из температур проведены вычисления значений энергий смешения. Результаты вычислений приведены в табл. 1.7, а график температурной зависимости энергий смешения – на рис. 1.2.
Табл. 1.7. Значения энергий смешения компонентов системы Cu – Ni при различных температурах
| T, K | Q12(1), Дж/моль | Q12(2), Дж/моль |
| 473 | -3197,73 | 15175,28 |
| 498 | -465,22 | 13963,91 |
| 523 | 642,88 | 12621,02 |
| 548 | -507,40 | 11923,95 |
| 573 | 870,69 | 11582,78 |
| 598 | 2055,72 | 11269,64 |

Рис. 1.2. Зависимости энергий смешения компонентов системы Cu – Ni от температуры
На основании полученных данных были вычислены уравнения температурной зависимости энергий смешения в области низких температур.
![]() (1.13)
(1.13)
![]() (1.14) [11].
(1.14) [11].
Похожие работы
... устойчивость металлов и сплавов определяется их стойкостью к коррозии в водной среде. Лучшим способом представления термодинамической информации о химической и электрохимической устойчивости металлических систем в водных растворах являются диаграммы рН-потенциал. Впервые такие диаграммы в системе элемент-вода для чистых металлов при температуре 250С были построены Марселем Пурбе и использованы им ...
... при больших значениях пленки получаются несплошные, легко отделяющиеся от поверхности металла (железная окалина) в результате возникающих внутренних напряжений. Поведение титана и его сплавов в различных агрессивных средах Реакции титана со многими элементами происходят только при высоких температурах. При обычных температурах химическая активность титана чрезвычайно мала и он практически ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...







0 комментариев