Навигация
Экспериментальная часть
2. Экспериментальная часть
2.1 Справочные термодинамические данные для расчётов системы Cu – Ni – O
Все данные, представленные в табл. 2.1. – 2.3. получены из справочной литературы [17].
Табл. 2.1. Стандартные энергии Гиббса образования некоторых соединений
| Cоединение |
| Соединение |
|
| Cu2O(т) | 147,878 | Fe3O4(т) | 1020,233 |
| CuO(т) | 127,890 | Fe2O3(т) | 744,224 |
| CuFeO2(т) | 478,300 | MnO(т) | 362,770 |
| CuFe2O4(т) | 887,480 | Mn3O4(т) | 1281,955 |
| NiO(т) | 211,430 | Mn2O3(т) | 879,280 |
| NiO2(т) | 111,630 | MnO2(т) | 465,370 |
| NiFe2O4(т) | 958,600 | Mn2O7(ж) | 262,940 |
Табл. 2.2. Стандартные энтальпии образования и энтропии некоторых веществ
| Элемент или соединение |
|
|
| Ni (г.ц.к.) | 0 |
|
| O2(г) | 0 |
|
| NiO(т) |
|
|
Табл. 2.3. Температурные ряды теплоёмкости некоторых веществ
(![]() )
)
| Элемент или соединение |
|
|
| Интервал температур, К |
| Ni (г.ц.к.) | 7,80 | 0,47 | -1,335 | 298–631 |
| O2(г) | 7,16 | 1,00 | -0,40 | 298–3000 |
| NiO(т) | -4,93 | 37,58 | 3,87 | 298–565 |
2.2 Расчёт активностей компонентов сплавов МН19 и МНЖМц30–1–1
В соответствии с ОТРР, активности компонентов сплавов можно рассчитать по формуле:
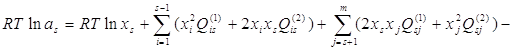
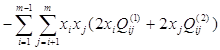 (2.1).
(2.1).
Здесь m – общее число компонентов в сплаве, s – номер компонента.
Для сплава МН19: m=2, s=1; 2, и
![]() (2.2),
(2.2),
![]() (2.3).
(2.3).
Для сплава МНЖМц30–1–1: m=4, s=1; 2; 3; 4.
В формуле (2.1) последнее слагаемое 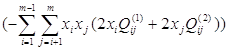 не зависит от s, и одинаково для всех компонентов. Обозначим его как А. Тогда
не зависит от s, и одинаково для всех компонентов. Обозначим его как А. Тогда
![]() (2.4),
(2.4),
![]() (2.5),
(2.5),
![]() (2.6),
(2.6),
![]() (2.7),
(2.7),
![]()
![]() (2.8).
(2.8).
Мольные доли компонентов рассчитаны исходя из известных массовых долей:
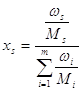 (2.9).
(2.9).
Здесь ω – массовая доля компонента в сплаве, М – молярная масса компонента.
Результаты расчётов представлены в табл. 2.4.
Табл. 2.4. Состав сплавов и активности и компонентов
| Сплав | Компонент |
|
|
|
| МН19 | Cu | 0,81 | 0,7965 | 0,4055 |
| Ni | 0,19 | 0,2035 | 0,2097 | |
| МНЖМц 30–1–1 | Cu | 0,68 | 0,6604 | 0,223 |
| Ni | 0,30 | 0,3173 | 0,268 | |
| Fe | 0,01 | 0,0111 | 2,008 | |
| Mn | 0,01 | 0,0112 | 0,184 |
2.3 Расчёт диаграммы состояния системы Cu – Ni – O при 25оС
Для построения диаграммы состояния Cu – Ni – O были использованы данные с диаграмм состояния Cu – O (рис. 1.3), Ni – O (рис. 1.4) и Сu – Ni (рис. 1.1.).
Поскольку химическое сродство никеля к кислороду выше, чем меди, то можно предположить, что почти при любом составе сплава Сu – Ni в первую очередь будет окисляться именно никель из сплава, то есть будет реализовываться равновесие сплав – NiO, а не сплав – Cu2O.
Для того, чтобы найти точку, отвечающую составу сплава, равновесного с NiO и Cu2O, нужно рассмотреть систему уравнений
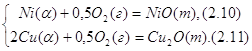 .
.
![]() (2.12),
(2.12),
![]() (2.13),
(2.13),
![]() (2.14),
(2.14),
![]() (2.15),
(2.15),
![]()
![]() (2.16).
(2.16).
сплав медный никелевый корозионный
Пусть ![]() . Подставив в (2.16) выражения для активностей меди и никеля в бинарной системе Cu – Ni в соответствии с ОТРР и преобразовав полученное выражение, получим уравнение
. Подставив в (2.16) выражения для активностей меди и никеля в бинарной системе Cu – Ni в соответствии с ОТРР и преобразовав полученное выражение, получим уравнение
![]() (2.17).
(2.17).
Значения энергий смешения ![]() взяты из табл. 1.9., значения стандартных энергий Гиббса реакций (2.10) и (2.11) рассчитаны на основании данных табл. 2.1. Найденный корень уравнения (2.17) –
взяты из табл. 1.9., значения стандартных энергий Гиббса реакций (2.10) и (2.11) рассчитаны на основании данных табл. 2.1. Найденный корень уравнения (2.17) – ![]() .
.
Таким образом, при мольной доле никеля в сплаве большей чем ![]() , никель из сплава будет окисляться в первую очередь и будет реализовываться равновесие сплав – NiO, а при мольных долях никеля меньших, чем
, никель из сплава будет окисляться в первую очередь и будет реализовываться равновесие сплав – NiO, а при мольных долях никеля меньших, чем ![]() будет окисляться медь и реализовываться равновесие сплав – Cu2O.
будет окисляться медь и реализовываться равновесие сплав – Cu2O.
На основании данных о температурной зависимости энергий смешения в системе Cu – Ni купол расслаивания был экстраполирован до области комнатных температур. Точка, характеризующая равновесие α-фазы с (α+γ) отвечает мольной доле никеля 0,277 (активность никеля в этой точке равна 0,997), а точка характеризующая равновесие γ-фазы с (α+γ) отвечает мольной доле никеля 0,999 (активность никеля равна 0,999) [11].
Для однозначного описания равновесия Ni(α) – Ni(γ) – NiO необходимо вычислить и давление кислорода в газовой фазе над конденсированной фазой.
По уравнению Ni+0,5O2(г)=NiO(т) (2.18):
![]() (2.19),
(2.19),
![]() (2.20).
(2.20).
При описании равновесий с участием только оксидных фаз принято активности этих фаз считать равными единице, и для описания равновесий необходимо рассчитать только давление кислорода в газовой фазе над оксидами.
В системе Cu2O – CuO – NiO оно определяется равновесием Cu2O – CuO, а в системе СuO – NiO – NiOx – NiO2 – равновесием NiO – NiO2. Для уравнений
Cu2O(т)+0,5O2(г)=2CuO(т) (2.21) и
NiO(т)+0,5O2(г)=NiO2(т) (2.22)
давление кислорода определяется уравнениями
![]() (2.23),
(2.23),
![]() (2.24),
(2.24),
![]() (2.25).
(2.25).
Диаграмма состояния Cu – Ni – O приведена на рис. 2.1. Рассчитанные характеристики равновесий приведены в таблице 2.5.
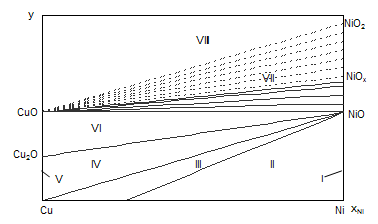
Рис. 2.1. Диаграмма состояния Cu – Ni – O при 25˚С.
Табл. 2.5. Характеристики фазовых равновесий в системе Cu – Ni – O при 25оС
| Равновесие |
| Характеристики фаз |
| α – γ – NiO |
|
|
| α – NiO – Cu2O |
|
|
| Cu2O–CuO–NiO |
|
|
| CuO – NiO – NiO2 |
|
|
На диаграмме 2.1. можно выделить 8 областей, в которых присутствуют следующие фазы:
I – γ-фаза + NiO,
II – α-фаза + γ-фаза + NiO,
III – α-фаза + NiO,
IV – α-фаза + NiO + Cu2O,
V – α-фаза + Cu2O,
VI – Cu2O + CuO + NiO,
VII – CuO + NiOx (1<x<2),
VIII – CuO + NiO2 + {O2}.
Области I и V очень малы и в масштабе диаграммы вырождаются в линии.
Анализируя диаграмму Cu – Ni – O можно сделать следующие выводы о химической устойчивости медно-никелевых сплавов:
1) Окисление сплавов начинается уже при давлениях кислорода в газовой фазе над сплавами большем чем ![]() атм. Поэтому медно-никелевые сплавы будут окисляться кислородом воздуха при 25оС.
атм. Поэтому медно-никелевые сплавы будут окисляться кислородом воздуха при 25оС.
2) Поскольку химическое сродство никеля к кислороду выше, чем меди, то начиная с мольных долей никеля выше ![]() , то есть практически во всей области составов сплавов никель будет окисляться в первую очередь.
, то есть практически во всей области составов сплавов никель будет окисляться в первую очередь.
3) Так как для образования NiO2 требуется давление кислорода в газовой фазе над сплавом большее, чем ![]() атм., то при окислении сплавов кислородом воздуха NiO2 образовываться не будет. Окисление никеля завершится образованием фазы NiOx (1<x<2).
атм., то при окислении сплавов кислородом воздуха NiO2 образовываться не будет. Окисление никеля завершится образованием фазы NiOx (1<x<2).
2.4 Расчёт равновесия CuO – NiO – NiOx при 25оС
Для того, чтобы рассчитать значение х, соответствующее максимальной степени окисленности никеля в оксиде, который может образоваться в нормальных условиях, необходимо воспользоваться уравнениями:
![]() (2.26),
(2.26),
![]() (2.27),
(2.27),
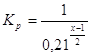 (2.28),
(2.28),
поскольку давление кислорода воздуха при нормальных условиях составляет 0,21 атм.
Для того, чтобы совместно решить систему уравнений (2.27) – (2.28) относительно х, нужно задать в явном виде зависимость ![]() от х.
от х.
Существует приближённая функциональная связь между стандартной энергией Гиббса образования оксидов данного металла из элементов и стехиометрическим составом оксидов [13]:
![]() (2.29),
(2.29),
где i, j – степени окисленности оксидов металла, для которых существуют наиболее достоверные термодинамические данные, х – степень окисленности неизвестного оксида.
Hаиболее достоверные термодинамические данные для никеля получены только для оксида NiO: ![]() . Данные для оксида Ni2O3 получены расчётным путём:
. Данные для оксида Ni2O3 получены расчётным путём: ![]() . Поскольку для гипотетического оксида NiO1,5 энергия Гиббса образования вдвое меньше, то
. Поскольку для гипотетического оксида NiO1,5 энергия Гиббса образования вдвое меньше, то ![]() [13].
[13].
Таким образом, ![]() и формула (2.29) преобразуется к виду
и формула (2.29) преобразуется к виду
![]() (2.30),
(2.30),
А в нормальных условиях ![]() (2.31).
(2.31).
Подставляя (2.31) в (2.27) и решая уравнение с учётом (2.28), можно найти значение х, соответствующее максимальной степени окисленности никеля в оксиде, который может образоваться в нормальных условиях:
х=1,346.
Таким образом, окисление медно-никелевых сплавов на воздухе заканчивается образованием CuO и нестехиометрического соединения NiO1,346.
2.5 Оценка области гомогенности фазы NiOx при различных температурах в равновесии с атмосферным воздухом
Используя уравнения (2.27), (2.28) и (2.30) можно оценить область гомогенности фазы NiOx при различных температурах в равновесии с атмосферным воздухом, то есть найти значение х, соответствующее максимальной степени окисленности никеля в оксиде, который может образоваться на воздухе при различных температурах.
Для этого нужно знать температурные зависимости стандартных энергий Гиббса образования соединений NiO и NiO1,5.
Для соединения Ni2O3 имеются только данные о стандартныx энтальпии и энтропии образования [13]:
![]() .
.
Поэтому стандартную энергию Гиббса образования можно рассчитать только приближённо, предполагая, что ![]() и
и ![]() не зависят от температуры.
не зависят от температуры.
![]() (2.32)
(2.32)
Все необходимые исходные данные для расчёта стандартной энергии Гиббса образования NiO представлены в табл. 2.2 – 2.3.
![]() (2.33),
(2.33),
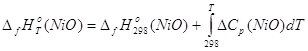 (2.34),
(2.34),
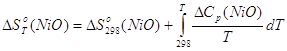 (2.35),
(2.35),
Подставляя (2.34) и (2.35) в (2.33):
![]() (2.36)
(2.36)
Причём:
![]() (2.37),
(2.37),
![]() (2.38).
(2.38).
Поскольку ![]() (2.39), то
(2.39), то
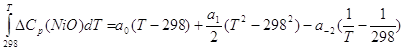 (2.40),
(2.40),
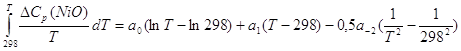 (2.41).
(2.41).
Результаты расчётов стандартных энергий Гиббса образования NiO и NiO1,5, а также зависимостей стандартных энергий Гиббса образования NiOx от х представлены в табл. 2.6.
Табл. 2.6. Стандартные энергии Гиббса образования оксидов никеля при различных температурах
| T, K |
|
|
|
|
| 100 | -201905 | -451030 | -225515 |
|
| 200 | -211430 | -425460 | -212730 |
|
| 273 | -211775 | -406794 | -203397 |
|
| 298 | -211430 | -400400 | -200200 |
|
| 400 | -208650 | -374320 | -187160 |
|
| 500 | -204977 | -348750 | -174375 |
|
Рассчитанные значения х, соответствующие максимальной степени окисленности никеля в оксиде, который может образоваться на воздухе представлены в табл. 2.7.
Табл. 2.7. Значения х при различных температурах
| T, K | 100 | 200 | 273 | 298 | 400 | 500 |
| x | 1,939 | 1,505 | 1,377 | 1,346 | 1,232 | 1,143 |
2.6 Построение диаграмм рН – потенциал систем сплав МН19 – H2O и сплав МНЖМц30–1–1 – Н2О при 25оС
Линии на диаграммах рН – потенциал рассчитываются по равновесным процессам. В общем виде для процесса
![]() (2.42)
(2.42)
![]() (2.43).
(2.43).
Поскольку ![]() , то
, то
![]() (2.44).
(2.44).
Здесь φi – равновесный электродный потенциал реакции, φio – стандартный электродный потенциал.
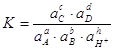 (2.45).
(2.45).
И, после подстановки (2.45) в (2.44), перехода от натуральных логарифмов к десятичным и учёта того, что ![]() :
:
![]() (2.46).
(2.46).
Диаграммы рН – потенциал строят, зафиксировав активности компонентов, находящихся в растворе, так чтобы последний член равенства (2.46) был постоянным. Затем строят прямую линию, пересекающую ось потегциалов в точке ![]() с тангенсом угла наклона, равным
с тангенсом угла наклона, равным ![]() . При 25оС
. При 25оС ![]() .
.
Наклонные линии на диаграмме ![]() будут соответствовать равновесиям, в которых принимают участие и электроны и ионы Н+, горизонтальные линии
будут соответствовать равновесиям, в которых принимают участие и электроны и ионы Н+, горизонтальные линии ![]() – равновесиям, в которых не принимают участие ионы Н+, вертикальные линии
– равновесиям, в которых не принимают участие ионы Н+, вертикальные линии ![]() – чисто химическим равновесиям, без участия электронов.
– чисто химическим равновесиям, без участия электронов.
Линии чисто химических равновесий нельзя построить с использованием уравнений (2.43) – (2.46). Вместо них используются уравнения
![]() (2.47),
(2.47),
![]() (2.48),
(2.48),
![]() (2.49).
(2.49).
В данной работе построены диаграммы рН – потенциал для систем сплав МН19 – вода и сплав МНЖМц30–1–1 – вода при активностях ионов в растворе равных ![]() ,
, ![]() ,
, ![]() .
.
При построении линий, соответствующим равновесиям с участием металлов, их активности принимаются равными активностям компонентов сплавов МН19 и МНЖМц30–1–1 (см. табл. 2.4.). Активности всех оксидов принимаются равными единице.
На всех построенных диаграммах все оксиды представлены в виде негидратированных форм.
При построении диаграмм были использованы литературные данные [14 – 16].
Диаграмма рН – потенциал системы сплав МН19 – Н2О при условии ![]() приведена на рис. 2.2. Основные химические и электрохимические равновесия указаны в табл. 2.8.
приведена на рис. 2.2. Основные химические и электрохимические равновесия указаны в табл. 2.8.
Диаграмма рН – потенциал системы сплав МН19 – Н2О при условии ![]() приведена на рис. 2.3. Основные химические и электрохимические равновесия указаны в табл. 2.9.
приведена на рис. 2.3. Основные химические и электрохимические равновесия указаны в табл. 2.9.
Диаграмма рН – потенциал системы сплав МН19 – Н2О при условии ![]() приведена на рис. 2.3. Основные химические и электрохимические равновесия указаны в табл. 2.10.
приведена на рис. 2.3. Основные химические и электрохимические равновесия указаны в табл. 2.10.
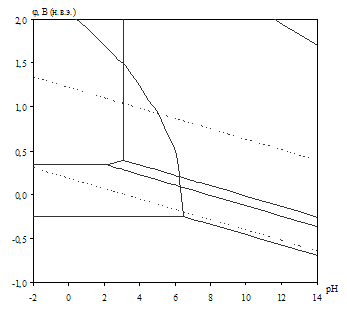
Рис. 2.2. Диаграмма рН – потенциал системы сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() .
.
Табл. 2.8. Основные химические и электрохимические равновесия в системе сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]()
| № линии | Электродная реакция | Равновесный потенциал (В) или рН раствора |
| 1 |
| -0,248 |
| 2 |
| 0,135–0,0591pH |
| 3 |
|
|
| 4 |
| 0,338 |
| 5 |
| 0,465–0,0591pH |
| 6 |
| 0,575–0,0591pH |
| 7 |
| 0,211+0,0591pH |
| 8 |
| pH 3,08 |
| 9 |
| 3,360–0,1182pH |
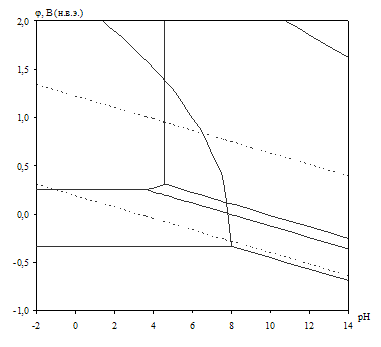
Рис. 2.3. Диаграмма рН – потенциал системы сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() .
.
Табл. 2.9. Основные химические и электрохимические равновесия в системе сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]()
| № линии | Электродная реакция | Равновесный потенциал (В) или рН раствора |
| 1 |
| -0,337 |
| 2 |
| 0,135–0,0591pH |
| 3 |
|
|
| 4 |
| 0,250 |
| 5 |
| 0,465–0,0591pH |
| 6 |
| 0,575–0,0591pH |
| 7 |
| 0,034+0,0591pH |
| 8 |
| pH 4,58 |
| 9 |
| 3,272–0,1182pH |
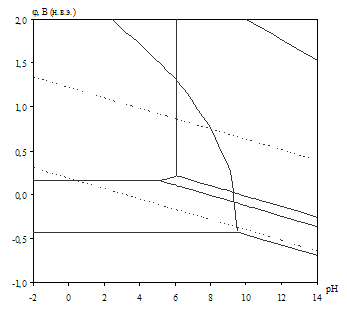
Рис. 2.4. Диаграмма рН – потенциал системы сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() .
.
Табл. 2.10. Основные химические и электрохимические равновесия в системе сплав МН19 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]()
| № линии | Электродная реакция | Равновесный потенциал (В) или рН раствора |
| 1 |
| -0,425 |
| 2 |
| 0,135–0,0591pH |
| 3 |
|
|
| 4 |
| 0,161 |
| 5 |
| 0,465–0,0591pH |
| 6 |
| 0,575–0,0591pH |
| 7 |
| -0,144+0,0591pH |
| 8 |
| pH 6,08 |
| 9 |
| 3,183–0,1182pH |
На диаграмме рН – потенциал системы сплав МН19 – Н2О (вне зависимости от того, какими заданы активности ионов в растворе) можно выделить 10 областей преобладания различных фаз:
I. α (мельхиор МН19),
II. α + Ni2+,
III. α + NiOx,
IV. Cu2O + Ni2+,
V. Cu2O + NiOx,
VI. Cu2+, Ni2+,
VII. NiOx + Cu2+,
VIII. CuO + Ni2+,
IX. CuO + NiOx,
X. CuO + ![]() .
.
В области I сплав МН19 не подвергается коррозии (иммунность), в областях II и VI сплав корродирует, причём в области II происходит селективная коррозия никеля из сплава, а в области VI – общая коррозия сплава. В областях III–V и VII–IX происходит образование на поверхности сплава пассивационной оксидной плёнки, которая может быть как однофазной (области III–IV, VII–VIII), так и двухфазной (V, IX). В области Х происходит перепассивация сплава по никелю (окисление пассивационной плёнки и переход никеля в раствор в виде никелат-ионов).
Сравнение диаграмм, построенных при различных значениях активностей ионов в растворе, показывает, что с уменьшением активностей ионов снижаются потенциалы растворения компонентов сплава и потенциал перепассивации мельхиора по никелю. Области активной коррозии расширяются, а области пассивности наоборот уменьшаются и сдвигаются в щелочную область.
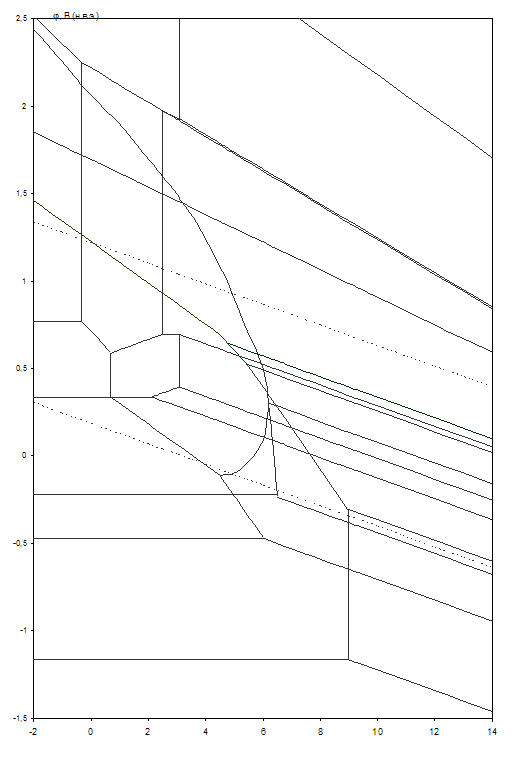
Рис. 2.5. Диаграмма рН – потенциал системы сплав МНЖМц30–1–1 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() .
.
Табл. 2.11. Основные химические и электрохимические равновесия в системе сплав МНЖМц30–1–1 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]()
| № линии | Электродная реакция | Равновесный потенциал (В) или рН раствора |
| 1 |
| -1,165 |
| 2 |
| -0,473 |
| 3 |
| -0,233 |
| 4 |
| 0,337 |
| 5 |
| 0,771 |
| 6 |
| -0,634–0,0591pH |
| 7 |
| pH 8,95 |
| 8 |
| -0,117–0,0591pH |
| 9 |
| 0,150–0,0591pH |
| 10 |
| 0,225–0,0591pH |
| 11 |
| 0,953–0,2364pH |
| 12 |
|
|
| 13 |
| pH 6,23+ |
| 14 |
| 0,420–0,1182pH |
| 15 |
| 0,463–0,0591pH |
| 16 |
| 0,575–0,0591pH |
| 17 |
| 0,211+0,0591pH |
| 18 |
| 0,668–0,0591pH |
| 19 |
| pH 0,70 |
| 20 |
| 0,713–0,1773pH |
| 21 |
| 0,546+0,0591pH |
| 22 |
| pH 3,08 |
| 23 |
| 0,695 |
| 24 |
| 0,877–0,0591pH |
| 25 |
| 1,813–0,2364pH |
| 26 |
| 1,490–0,1773pH |
| 27 |
| 0,846–0,0591pH |
| 28 |
| 0,926–0,0591pH |
| 29 |
| 1,226–0,1182pH |
| 30 |
| 1,695–0,0788pH |
| 31 |
| pH -0,32 |
| 32 |
| pH 2,53 |
| 33 |
| 2,200–0,1577pH |
| 34 |
| 2,220–0,0985pH |
| 35 |
| 2,169–0,0788pH |
| 36 |
| 2,230–0,0985pH |
| 37 |
| 3,360–0,1182pH |
На диаграмме можно выделить 46 областей преобладания различных фаз:
I. α (мельхиор МНЖМц30–1–1),
II. α + Mn2+,
III. α + MnO,
IV.α + Mn2+, Fe2+,
V. α + [(Fe1-xNix) Fe2O4] + Mn2+,
VI.α + [(Fe1-xNix) Fe2O4] + MnO,
VII. α + Mn2+, Ni2+, Fe2+,
VIII. α + CuFeO2 + Ni2+, Mn2+,
IX.α + CuFeO2 + [(Fe1-xNix) Fe2O4] + Ni2+, Mn2+,
X. α + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XI.α + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + MnO,
XII. α + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XIII. Cu2+, Mn2+, Fe2+, Ni2+,
XIV. CuFeO2 + Mn2+, Ni2+,
XV. Cu2O + CuFeO2 + Mn2+, Ni2+,
XVI. CuO + CuFeO2 + Mn2+, Ni2+,
XVII. Cu2O + CuFeO2 + [(Fe1-xNix) Fe2O4] + Mn2+, Ni2+,
XVIII. Cu2O + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XIX. Cu2O + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XX. CuO + CuFeO2 + [(Fe1-xNix) Fe2O4] + Mn2+, Ni2+,
XXI. CuO + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XXII. CuO + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XXIII. CuO + CuFeO2 + Mn3O4 + Ni2+,
XXIV. CuO + CuFeO2 + NiOx + Mn2+,
XXV. CuO + CuFeO2 + NiOx + Mn3O4,
XXVI. CuO + CuFeO2 + Mn2O3 + Ni2+,
XXVII. CuO + CuFeO2 + NiOx + Mn2O3,
XXVIII. CuFe2O4 + Mn2O3 + Ni2+,
XXIX. CuFe2O4 + Mn2O3 + NiOx,
XXX. Cu2+, Mn2+, Fe3+, Ni2+,
XXXI. Fe2O3 + Cu2+, Mn2+, Ni2+,
XXXII. CuFe2O4 + Ni2+, Mn2+,
XXXIII. CuFe2O4 + MnO2 + Ni2+,
XXXIV. CuFe2O4 + NiOx + MnO2,
XXXV. MnO2 + Cu2+, Ni2+, Fe3+,
XXXVI. MnO2 + Fe2O3 + Cu2+, Ni2+,
XXXVII. Cu2+, Fe3+, Ni2+,![]() ,
,
XXXVIII. Fe2O3 + Cu2+, Ni2+,![]() ,
,
XXXIX. CuFe2O4 + Ni2+,![]() ,
,
XL. CuFe2O4 + NiOx + ![]() ,
,
XLI. Fe2O3 + NiOx + Cu2+, ![]() ,
,
XLII. CuFe2O4 + NiOx + ![]() ,
,
XLIII. Cu2+, Ni2+, ![]() ,
,
XLIV. NiOx + Cu2+, Fe3+,![]() ,
,
XLV. CuO + NiOx + ![]() ,
,
XLVI. CuO + ![]() .
.
Диаграмма рН – потенциал системы сплав МНЖМц30–1–1 – Н2О при условии ![]() приведена на рис. 2.6. Основные химические и электрохимические равновесия указаны в табл. 2.12.
приведена на рис. 2.6. Основные химические и электрохимические равновесия указаны в табл. 2.12.
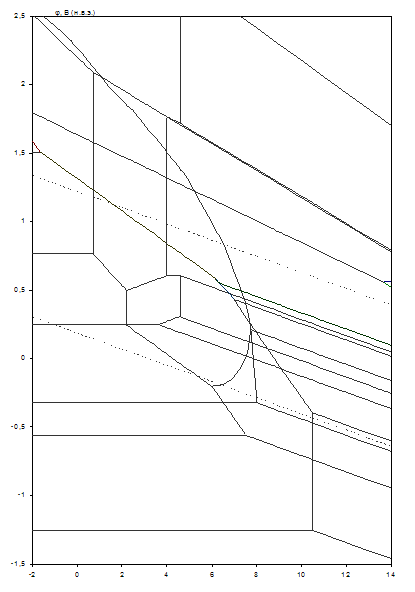
Рис. 2.6. Диаграмма рН – потенциал системы сплав МНЖМц30–1–1 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() .
.
Табл. 2.12. Основные химические и электрохимические равновесия в системе сплав МНЖМц30–1–1 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]()
| № линии | Электродная реакция | Равновесный потенциал (В) или рН раствора |
| 1 |
| -1,254 |
| 2 |
| -0,562 |
| 3 |
| -0,322 |
| 4 |
| 0,249 |
| 5 |
| 0,771 |
| 6 |
| 1,510 |
| 7 |
| -0,634–0,0591pH |
| 8 |
| pH 10,45 |
| 9 |
| -0,117–0,0591pH |
| 10 |
| 0,150–0,0591pH |
| 11 |
| 0,225–0,0591pH |
| 12 |
| 1,219–0,2364pH |
| 13 |
|
|
| 14 |
| pH 7,73+ |
| 15 |
| 0,509–0,1182pH |
| 16 |
| 0,463–0,0591pH |
| 17 |
| 0,575–0,0591pH |
| 18 |
| 0,034+0,0591pH |
| 19 |
| 0,668–0,0591pH |
| 20 |
| pH 2,20 |
| 21 |
| 0,890–0,1773pH |
| 22 |
| 0,369+0,0591pH |
| 23 |
| pH 4,58 |
| 24 |
| 0,607 |
| 25 |
| 0,877–0,0591pH |
| 26 |
| 2,079–0,2364pH |
| 27 |
| 1,667–0,1773pH |
| 28 |
| 0,846–0,0591pH |
| 29 |
| 0,926–0,0591pH |
| 30 |
| 1,315–0,1182pH |
| 31 |
| 1,117–0,2364pH |
| 32 |
| 1,636–0,0788pH |
| 33 |
| 0,588 |
| 34 |
| 2,176–0,1182pH |
| 35 |
| pH 0,68 |
| 36 |
| pH 4,03 |
| 37 |
| 2,200–0,1577pH |
| 38 |
| 2,161–0,0985pH |
| 39 |
| 2,081–0,0788pH |
| 40 |
| 2,171–0,0985pH |
| 41 |
| 3,272–0,1182pH |
На диаграмме можно выделить 48 областей преобладания различных фаз:
I. α (мельхиор МНЖМц30–1–1),
II. α + Mn2+,
III. α + MnO,
IV.α + Mn2+, Fe2+,
V. α + [(Fe1-xNix) Fe2O4] + Mn2+,
VI.α + [(Fe1-xNix) Fe2O4] + MnO,
VII. α + Mn2+, Ni2+, Fe2+,
VIII. α + CuFeO2 + Ni2+, Mn2+,
IX.α + CuFeO2 + [(Fe1-xNix) Fe2O4] + Ni2+, Mn2+,
X. α + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XI.α + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + MnO,
XII. α + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XIII. Cu2+, Mn2+, Fe2+, Ni2+,
XIV. CuFeO2 + Mn2+, Ni2+,
XV. Cu2O + CuFeO2 + Mn2+, Ni2+,
XVI. CuO + CuFeO2 + Mn2+, Ni2+,
XVII. Cu2O + CuFeO2 + [(Fe1-xNix) Fe2O4] + Mn2+, Ni2+,
XVIII. Cu2O + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XIX. Cu2O + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XX. CuO + CuFeO2 + [(Fe1-xNix) Fe2O4] + Mn2+, Ni2+,
XXI. CuO + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XXII. CuO + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XXIII. CuO + CuFeO2 + Mn3O4 + Ni2+,
XXIV. CuO + CuFeO2 + NiOx + Mn2+,
XXV. CuO + CuFeO2 + NiOx + Mn3O4,
XXVI. CuO + CuFeO2 + Mn2O3 + Ni2+,
XXVII. CuO + CuFeO2 + NiOx + Mn2O3,
XXVIII. CuFe2O4 + Mn2O3 + Ni2+,
XXIX. CuFe2O4 + Mn2O3 + NiOx,
XXX. Cu2+, Mn2+, Fe3+, Ni2+,
XXXI. Fe2O3 + Cu2+, Mn2+, Ni2+,
XXXII. CuFe2O4 + Ni2+, Mn2+,
XXXIII. CuFe2O4 + MnO2 + Ni2+,
XXXIV. CuFe2O4 + NiOx + MnO2,
XXXV. Cu2+, Mn3+, Fe3+, Ni2+,
XXXVI. MnO2 + Cu2+, Ni2+, Fe3+,
XXXVII. MnO2 + Fe2O3 + Cu2+, Ni2+,
XXXVIII. Cu2+, Fe3+, Ni2+,![]() ,
,
XXXIX. Fe2O3 + Cu2+, Ni2+,![]() ,
,
XL. CuFe2O4 + Ni2+,![]() ,
,
XLI. CuFe2O4 + NiOx + ![]() ,
,
XLII. CuFe2O4 + NiOx + ![]() ,
,
XLIII. Fe2O3 + NiOx + Cu2+, ![]() ,
,
XLIV. CuFe2O4 + NiOx + ![]() ,
,
XLV. Cu2+, Ni2+, ![]() ,
,
XLVI. NiOx + Cu2+ + ![]() ,
,
XLVII. CuO + NiOx + ![]() ,
,
XLVIII. CuO + ![]() .
.
Диаграмма рН – потенциал системы сплав МНЖМц30–1–1 – Н2О при условии ![]() приведена на рис. 2.7. Основные химические и электрохимические равновесия указаны в табл. 2.13.
приведена на рис. 2.7. Основные химические и электрохимические равновесия указаны в табл. 2.13.
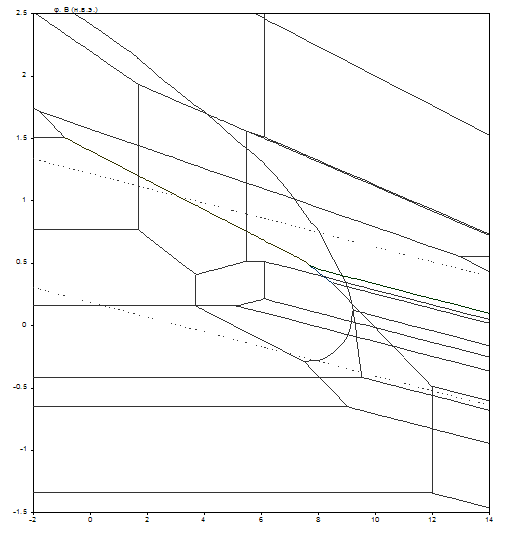
Рис. 2.7. Диаграмма рН – потенциал системы сплав МНЖМц30–1–1 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() .
.
Табл. 2.13. Основные химические и электрохимические равновесия в системе сплав МНЖМц30–1–1 – Н2О при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]()
| № линии | Электродная реакция | Равновесный потенциал (В) или рН раствора |
| 1 |
| -1,342 |
| 2 |
| -0,650 |
| 3 |
| -0,410 |
| 4 |
| 0,160 |
| 5 |
| 0,771 |
| 6 |
| 1,510 |
| 7 |
| -0,634–0,0591pH |
| 8 |
| pH 11,95 |
| 9 |
| -0,117–0,0591pH |
| 10 |
| 0,150–0,0591pH |
| 11 |
| 0,225–0,0591pH |
| 12 |
| 1,485–0,2364pH |
| 13 |
|
|
| 14 |
| pH 9,23+ |
| 15 |
| 0,597–0,1182pH |
| 16 |
| 0,463–0,0591pH |
| 17 |
| 0,575–0,0591pH |
| 18 |
| -0,144+0,0591pH |
| 19 |
| 0,668–0,0591pH |
| 20 |
| pH 3,70 |
| 21 |
| 1,068–0,1773pH |
| 22 |
| 0,191+0,0591pH |
| 23 |
| pH 6,08 |
| 24 |
| 0,518 |
| 25 |
| 0,877–0,0591pH |
| 26 |
| 2,345–0,2364pH |
| 27 |
| 1,845–0,1773pH |
| 28 |
| 0,846–0,0591pH |
| 29 |
| 0,926–0,0591pH |
| 30 |
| 1,403–0,1182pH |
| 31 |
| 1,506–0,1182pH |
| 32 |
| 1,295–0,2364pH |
| 33 |
| 1,577–0,0788pH |
| 34 |
| 0,588 |
| 35 |
| 2,087–0,1182pH |
| 36 |
| pH 1,68 |
| 37 |
| pH 5,53 |
| 38 |
| 2,200–0,1577pH |
| 39 |
| 2,102–0,0985pH |
| 40 |
| 1,992–0,0788pH |
| 41 |
| 2,112–0,0985pH |
| 42 |
| 3,183–0,1182pH |
На диаграмме можно выделить 49 областей преобладания различных фаз:
I. α (мельхиор МНЖМц30–1–1),
II. α + Mn2+,
III. α + MnO,
IV.α + Mn2+, Fe2+,
V. α + [(Fe1-xNix) Fe2O4] + Mn2+,
VI.α + [(Fe1-xNix) Fe2O4] + MnO,
VII. α + Mn2+, Ni2+, Fe2+,
VIII. α + CuFeO2 + Ni2+, Mn2+,
IX.α + CuFeO2 + [(Fe1-xNix) Fe2O4] + Ni2+, Mn2+,
X. α + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XI.α + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + MnO,
XII. α + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XIII. Cu2+, Mn2+, Fe2+, Ni2+,
XIV. CuFeO2 + Mn2+, Ni2+,
XV. Cu2O + CuFeO2 + Mn2+, Ni2+,
XVI. CuO + CuFeO2 + Mn2+, Ni2+,
XVII. Cu2O + CuFeO2 + [(Fe1-xNix) Fe2O4] + Mn2+, Ni2+,
XVIII. Cu2O + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XIX. Cu2O + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XX. CuO + CuFeO2 + [(Fe1-xNix) Fe2O4] + Mn2+, Ni2+,
XXI. CuO + CuFeO2 + [(Fe1-xNix) Fe2O4] + NiOx + Mn2+,
XXII. CuO + CuFeO2 + [(Fe1-x-yNixMny) (Fe2-zMnzO4)] + NiOx,
XXIII. CuO + CuFeO2 + Mn3O4 + Ni2+,
XXIV. CuO + CuFeO2 + NiOx + Mn2+,
XXV. CuO + CuFeO2 + NiOx + Mn3O4,
XXVI. CuO + CuFeO2 + Mn2O3 + Ni2+,
XXVII. CuO + CuFeO2 + NiOx + Mn2O3,
XXVIII. CuFe2O4 + Mn2O3 + Ni2+,
XXIX. CuFe2O4 + Mn2O3 + NiOx,
XXX. Cu2+, Mn2+, Fe3+, Ni2+,
XXXI. Fe2O3 + Cu2+, Mn2+, Ni2+,
XXXII. CuFe2O4 + Ni2+, Mn2+,
XXXIII. CuFe2O4 + MnO2 + Ni2+,
XXXIV. CuFe2O4 + NiOx + MnO2,
XXXV. Cu2+, Mn3+, Fe3+, Ni2+,
XXXVI. MnO2 + Cu2+, Ni2+, Fe3+,
XXXVII. MnO2 + Fe2O3 + Cu2+, Ni2+,
XXXVIII. Cu2+, Fe3+, Ni2+,![]() ,
,
XXXIX. Fe2O3 + Cu2+, Ni2+,![]() ,
,
XL. CuFe2O4 + Ni2+,![]() ,
,
XLI. CuFe2O4 + NiOx + ![]() ,
,
XLII. CuFe2O4 + NiOx + ![]() ,
,
XLIII. Fe2O3 + NiOx + Cu2+, ![]() ,
,
XLIV. CuFe2O4 + NiOx + ![]() ,
,
XLV. Cu2+, Ni2+, ![]() ,
,
XLVI. NiOx + Cu2+ + ![]() ,
,
XLVII. CuO + NiOx + ![]() ,
,
XLVIII. Cu2+, ![]() .
.
XLIX. CuO + ![]() .
.
Из анализа диаграмм можно сделать следующие выводы:
Область I – это область иммунности мельхиора МНЖМц30–1–1, области II, IV, VII – это области селективной коррозии. В области II селективно растворяется марганец, в области IV – железо и марганец, в области VII – никель, железо и марганец. В областях XIII, XXX, и при низких активностях ионов в растворе, XXXV, XXXVIII, XLV, XLVIII происходит общая коррозия мельхиора, то есть все компоненты в том или ином виде переходят в раствор.
В остальных областях на поверхности мельхиора образуется пассивирующая плёнка. Она может быть как одно – так и многофазной. В областях V, VI, IX–XI, XVII, XVIII, XX, XXI происходит образование так называемых смешанных железо-никелевых шпинелей – твёрдых растворов между Fe3O4 и NiFe2O4 вида [(Fe1-xNix) Fe2O4]. В областях XII, XIX, XXII образуются железо-никеле-марганцевые шпинельные растворы вида
[(Fe1-x-yNixMny) (Fe2-zMnzO4)]. Образование шпинелей приводит к упрочнению пассивирующей плёнки и улучшению её защитных свойств.
Сравнение диаграмм, построенных при различных активностях, показывает, что, как и в случае сплава МН19, при понижении активностей ионов в растворе коррозионная стойкость мельхиора МНЖМц30–1–1 снижается, поскольку снижаются потенциалы активного растворения металлов и потенциалы перепассивации мельхиора по всем компонентам, расширяется область активного растворения, а область пассивности уменьшается и сдвигается в щелочную область. Кроме того, при малых активностях ионов в растворе на диаграмме появляются новые области, связанные с образованием Mn3+ и ![]() .
.
Сплав МНЖМц30–1–1 по сравнению с МН19 обладает рядом различий в коррозионном поведении. Область иммунности значительно меньше, иммунность наблюдается только при сильной катодной поляризации. За счёт образования ферритов меди и никеля уменьшается область активного растворения в кислых средах, хотя область селективной коррозии марганца весьма широкая. Несмотря на то, что перепассивация мельхиора по марганцу и железу достигается уже при сравнительно невысоких значениях потенциалов, никелат-ионы (как и для сплава МН19) образуются только в условиях сильной анодной поляризации.
Линии a и b на диаграммах (рис. 2.2 – 2.7) определяют электрохимическое поведение воды (см. табл. 2.14).
Табл. 2.14. Электрохимические равновесия в воде
| № линии | Электродная реакция | Равновесный потенциал (В) |
| a |
| 0,186–0,0591pH |
| b |
| 1,219–0,0591pH |
В области ниже линии a происходит катодное восстановление воды с выделением водорода. Область между линиями a и b определяет электрохимическую устойчивость воды. Выше линии b происходит окисление воды с выделением кислорода на аноде.
2.7 Обсуждение результатов
В работе определены активности компонентов мельхиоров МН19 и МНЖМц30–1–1. Установлено, что активность железа в мельхиоре МНЖМц30–1–1 выше единицы. Это означает, что мельхиор МНЖМц30–1–1 является метастабильной системой. При старении сплава железо выделяется из мельхиора в свободном виде в качестве новой фазы. Это вызывает упрочнение сплава и улучшение коррозионной стойкости против ударной коррозии, что подтверждает литературные данные [1].
Построена диаграмма состояния Cu – Ni – O и проанализирована химическая устойчивость медно-никелевых сплавов. Установлено, что медно-никелевые сплавы окисляются кислородом воздуха в нормальных условиях. Подтверждено, что окисление никеля из сплава на воздухе заканчивается образованием фазы нестехиометрического состава NiOx, что подтверждается диаграммой состояния Ni – O (рис. 1.4., [14]). Однако установлено, что в нормальных условиях и при повышенной температуре соединение NiO2 не образуется, что не подтверждается диаграммой 1.4.
Построены диаграммы рН – потенциал систем МН19 – Н2О и МНЖМц30–1–1 – Н2О и проанализирована электрохимическая устойчивость мельхиоров. Подтверждены литературные данные о высокой коррозионной стойкости МНЖМц30–1–1. Установлено, что область активного растворения сплава при высоких активностях ионов в растворе мала и сплав подвержен коррозии только в кислых средах, а в нейтральных и щелочных на его поверхности образуется пассивирующая плёнка [1, 4, 6].
Выводы
1) В работе в рамках обобщённой теории «регулярных» растворов рассчитаны температурные зависимости энергий смешения компонентов бинарной системы Cu – Ni.
2) Рассчитаны активности компонентов мельхиоров МН19 и МНЖМц30–1–1.
3) На основании построенной при 25оС диаграммы состояния Cu – Ni – О, проанализирована химическая устойчивость медно-никелевых сплавов.
4) Оценена область гомогенности фазы NiOx при различных температурах в равновесии с атмосферным воздухом.
5) На основании построенных диаграмм рН – потенциал систем МН19 – Н2О и МНЖМц30–1–1 – Н2О при 25оС и различных активностях ионов в растворе проанализирована электрохимическая устойчивость мельхиоров, определены области их различного коррозионного поведения.
Список литературы
1. Смирягин А.П. Промышленные цветные металлы и сплавы. М.: Металлургиздат, 1974. 559 с.
2. Лахтин Ю.М., Леонтьева В.П. Материаловедение. М.: Машиностроение, 1990. 527 с.
3. Краткая химическая энциклопедия/ Гл. ред. Кнунянц И.Л.
М.: Советская энциклопедия, 1964. Т. 3. С. 70 – 74.
4. Червяков В.И., Маркосьян Г.Н., Пчельников А.П. Коррозионное поведение медно-никелевых сплавов в нейтральных хлоридных сульфидсодержащих растворах // Защита металлов, 2004. Т. 40. №2. С. 123 – 127.
5. Кузнецов Ю.И., Рылкина М.В. Некоторые особенности локальной депассивации бинарных сплавов // Защита металлов, 2004. Т. 40. №5. С. 505 – 512.
6. Сирота Д.С., Пчельников А.П. Электрохимическое поведение α-фазы системы Cu30Ni – H в растворах гидроксида натрия // Защита металлов, 2005. Т. 41. №6. С. 652 – 655.
7. Сирота Д.С., Пчельников А.П. Электрохимическое поведение β-фазы системы Cu30Ni – H в растворах гидроксида натрия // Защита металлов, 2005. Т. 41. №6. С. 598 – 601.
8. Маркосьян Г.Н., Сирота Д.С., Пчельников А.П. Коррозия гидридов никеля и сплава Cu30Ni в кислородсодержащих растворах // Защита металлов, 2005. Т. 41. №4. С. 390 – 394.
9. Диаграммы состояния двойных металлических систем/ Под ред. Лякишева Н.П.М.: Машиностроение, 1997. Т. 2. С. 283 – 286.
10. Тюрин А.Г. Моделирование термодинамических свойств растворов. Челяб. гос. ун-т. Челябинск, 1997. 74 с.
11. Николайчук П.А. Определение термодинамических активностей компонентов бронзы БрБ2: Курсовая работа/ Челяб. гос. ун-т. Челябинск, 2006. 29 с.
12. Ермолаева И.В. Термодинамика химической и электрохимической устойчивости латуни ЛЦ40Мц1,5 (ЛМц58,5–1,5): Дипломная работа/ Челяб. гос. ун-т. Челябинск, 2004. 70 с.
13. Тюрин А.Г. Термодинамика химической и электрохимической устойчивости сплавов. Ч. 1. Общие принципы. Высокотемпературное окисление. Челяб. гос. ун-т. Челябинск, 2004. 86 с.
14. Тюрин А.Г. Термодинамика химической и электрохимической устойчивости сплавов. Ч. 2. Низкотемпературное окисление. Челяб. гос. ун-т. Челябинск, 2004. 91 с.
15. Справочник по электрохимии/ Под ред. Сухотина А.М.Л.: Химия, 1981. 488 с.
16. Тюрин А.Г. О природе влияния меди на коррозионную стойкость железа // Защита металлов, 2004. Т. 40. №3. С. 256 – 262.
17. Равновесные превращения металлургических реакций/ Рузинов Л.П., Гуляницкий Б.С.М.: Металлургия, 1975. 416 с.
Похожие работы
... устойчивость металлов и сплавов определяется их стойкостью к коррозии в водной среде. Лучшим способом представления термодинамической информации о химической и электрохимической устойчивости металлических систем в водных растворах являются диаграммы рН-потенциал. Впервые такие диаграммы в системе элемент-вода для чистых металлов при температуре 250С были построены Марселем Пурбе и использованы им ...
... при больших значениях пленки получаются несплошные, легко отделяющиеся от поверхности металла (железная окалина) в результате возникающих внутренних напряжений. Поведение титана и его сплавов в различных агрессивных средах Реакции титана со многими элементами происходят только при высоких температурах. При обычных температурах химическая активность титана чрезвычайно мала и он практически ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...







0 комментариев